(2 中国林业科学研究院森林生态环境与自然保护研究所, 北京 100091)
(2 Ecology and Nature Conservation Institute, Chinese Academy of Forestry, Beijing 100091, China)
森林生态系统对于水源涵养、气候调节、资源利用和生态平衡等都具有重要作用[1]。然而,由于部分地区森林植被结构中人工林占比较高,树木抗逆性和稳定性较差、抵御病虫害的风险相对较弱,一些森林生态系统仍存在被病虫害侵害的风险[2]。因此,及时有效地开展病虫害防控就显得非常必要。病虫害防控主要包括间接的营林措施和直接的控害措施两大类,其中营林措施可发挥持续的控害作用,但通常复杂且耗时耗力耗资。化学防治手段短期内控害效果好,但易使害虫产生抗药性且对环境及非靶标生物不利[3, 4]。相比之下,生物防治是代替化学药剂的更加绿色、环保、经济和安全的直接防治手段之一[5]。随着人们对生态环境和自身安全日益重视,生物防治在森林害虫的治理中发挥着越来越重要的作用。
生物防治一般指利用天敌昆虫、病原微生物、其他食虫动物以及昆虫信息素、植物源杀虫剂和抗生素等代谢产物来防治害虫[1, 6]。除单一生物防治因子可独立发挥控害作用外,不同生物因子之间还可能存在协同作用关系。如树木可通过释放某些次生代谢物质吸引天敌从而抵御植食性害虫[1];一些病毒与寄生蜂共存时可有效提高寄生蜂对寄主害虫的控制作用[7]。然而,不同生防因子作用于同一生境甚至是同一害虫时,各因子之间也可能存在一定的干扰或拮抗作用。如Koller等[8]统计了36种寄生蜂与17种病原微生物联合应用时对目标害虫的控制效果,发现约有12%的组合表现出明显的拮抗作用。Zhou等[9]发现松褐天牛Monochamus alternatus幼虫期天敌白僵菌Beauveria spp.可能对同时期另一天敌花绒寄甲Dastarcus helophoroides产生一定侵染作用,野外同时释放或施用上述两种天敌前,需对白僵菌菌株的安全性进行检测和评估。昆虫信息素本身成分和结构复杂,林间多种信息素的组合使用可能会影响其实际效果[10]。
近年来,随着分子生物学技术、高通量测序技术和纳米技术的发展,更多害虫致害机制以及生防因子控害机理被揭示;林木抗虫育种、RNAi生物杀虫剂、共生菌Wolbachia害虫防治技术、工程菌改造技术、遗传防治技术以及基于纳米载体的生物防治技术[11, 12]等多种新兴技术逐渐应用到害虫生物防治过程中。通过与原有天敌或其代谢产物相结合,增强天敌的精细化管理,有望形成靶标专一性更强、防控效果更高、环境更友好的新型生物防治技术,在害虫管理中发挥更有效的作用[13]。
1 森林害虫生物防治现状 1.1 天敌昆虫天敌昆虫包括捕食性和寄生性两大类,前者指通过捕食其他昆虫维持生存的昆虫;而后者则指在生活史的某些阶段生活于寄主害虫体内或体表,通过消耗寄主营养物质杀死害虫的昆虫[14, 15]。目前,关于天敌昆虫控害作用的研究更多集中在其直接的取食效应(consumptive effects)方面[16];然而,除直接取食致死作用外,天敌昆虫还存在间接的非取食效应(non-consumptive effects),即天敌风险效应(enemy-risk effects)、非致死效应(non-lethal effects)或性状介导的相互作用(trait-mediated interactions)[17](表 1)。
| 表 1 天敌昆虫及其控害作用 |
尽管研究人员发现,天敌昆虫的非取食效应对害虫造成的影响几乎与其直接取食的效果相当[20],但迄今为止有关天敌昆虫非取食效应的研究和应用仍相对较少,生产上利用天敌昆虫时更多关注其直接取食作用。目前,捕食性天敌昆虫中至少有70种天敌实现了商业化生产,其中瓢虫、草蛉和瘿蚊等是产量最高、应用最广的几个类群,已在全世界绝大多数国家成功繁育并用于森林害虫的生物防治[25]。Symondson等[26]发现通常野外应用广食性捕食者后可有效抑制害虫种群数量。Boldorini等[27]对已发表文献中捕食者的控害效果进行整理分析,发现捕食者可导致害虫种群数量下降约73%。然而需要注意的是,目前仍有许多捕食性天敌在大规模繁育和生产过程中存在工作量繁重、成本高而效益低等问题;一些种类的饲养由于依赖于寄主植物-天然食料(植食性害虫)-捕食者三级营养饲养系统,因而其规模化繁育和野外应用受到很大限制[25]。
在所有实现商品化生产的寄生性天敌昆虫中,赤眼蜂、蚜小蜂、茧蜂、金小蜂和肿腿蜂等是应用较广的种类,已被大量释放到林间用于松毛虫Dendrolimus spp.、美国白蛾Hyphantria cunea、天牛、吉丁等森林害虫的防治[28-30]。如20世纪90年代起,通过繁育释放上亿头蚜小蜂,有效控制了北美地区多种粉虱类害虫[31]。赤眼蜂中约30%的种类已被人工规模化繁育,并用于30多个国家农林害虫的生物防治[32]。尽管寄生蝇占整个寄生性天敌昆虫的20%,然而其在生产上一直被低估。目前仅有约20种寄生蝇可人工规模化繁育,其他许多种类的生物生态学特性、饲养技术和使用方法均未研究和报道[33]。
1.2 昆虫病原微生物 1.2.1 昆虫病毒昆虫病毒是从昆虫体内分离出的对特定昆虫具有毒杀效果的病原微生物[34]。研究发现,昆虫病毒已知的宿主主要包括鳞翅目、双翅目、膜翅目、鞘翅目、直翅目、半翅目、脉翅目、缨翅目和蜚蠊目的许多种类,这些病毒进入害虫体内后利用害虫自身结构和病毒增殖,最终对害虫产生致死作用。目前已发现杆状病毒、质型多角体病毒、浓核病毒、痘病毒等至少20类病毒可对昆虫产生毒杀作用[35]。然而,尽管病毒种类繁多,但并非所有病毒均具有专化程度高、致病性强、易于生产、对环境安全且在环境中稳定等特性,即并非所有昆虫病毒均适用于开发生物防治产品[36]。在所有昆虫病毒中,核型多角体病毒(nucleopolyhedrosis viruses, NPVs)和颗粒体病毒(granuloviruses, GVs)等杆状病毒是研究和应用最多的类别,目前已发现其对700多种昆虫尤其是鳞翅目昆虫具有控制作用(表 2),昆虫被侵染后的表现症状也最为明显[37]。在2014年原中国农业部批准的11种商业化病毒杀虫剂中,NPVs和GVs占比高达80%以上[38]。Grégoire等[39]发现,一些杆状病毒可有效寄生舞毒蛾Lymantria dispar、松针毒蛾L. monacha、欧洲云杉叶蜂Gilpinia hercyniae和松黄叶蜂Neodiprion Sertifer等害虫的幼虫。自2000年以来,南非对苹果异形小卷蛾颗粒体病毒CrleGV进行了商业化生产和林间施用,以控制苹果异形小卷蛾Thaumatotibia leucotreta;当地研究人员经长期观测后发现,该病毒的控害效果达30%~90%,效果可持续4个月以上[40]。
| 表 2 常见昆虫病原微生物及其靶标害虫 |
昆虫病原细菌是细菌中对昆虫具有抑制或毒杀作用的菌种的统称,其可通过分泌毒素或其他次生代谢产物来抑制害虫种群数量;此外,一些菌种还可触发植物的诱导性系统抗性(induced systemic resistance, ISR),使植物提前具备抵御害虫的能力[41]。目前已发现的昆虫病原细菌主要包括芽孢杆菌Bacillus spp.、类芽孢杆菌Paenibacillus spp.、假单胞菌Pseudomonas spp.、链霉菌Streptomyces spp.、溶杆菌Lysobacter spp.和沙雷氏菌Seratia spp.等[5, 42-43]。然而,由于部分昆虫病原细菌存在杀虫谱较广、感染害虫时稳定性相对较差、长期使用易导致害虫抗性增强等问题,因此目前市场上广泛应用的昆虫病原细菌仍较少,主要是苏云金芽孢杆菌Bacillus thuringiensis (Bt)[44]。该菌主要通过分泌伴胞晶体毒蛋白、溶细胞毒素蛋白和营养期杀虫蛋白等对多种害虫进行毒杀[45](表 2)。20世纪50~80年代,美国和加拿大林业部门对Bt的飞防技术进行了深入探究,明确了以山梨醇作为Bt的主要配方来提高航空喷洒效果。20世纪80年代中期以来,Bt已被用于超过800万公顷林地的害虫防治,成为北美地区防治森林害虫最成功的商业产品之一[46]。类似地,Bt是我国微生物农药中生产量最大的细菌农药,占整个微生物农药市场份额的95%,年产量可达3万吨,对美国白蛾、杨扇舟蛾Clostera anachoreta等多种森林害虫均具有较强的控制效果[47-49]。
1.2.3 昆虫病原真菌昆虫病原真菌是真菌中对昆虫具有毒杀作用的菌种的统称(非微孢子虫),其主要通过分生孢子附着于目标昆虫角质层,在特定信号下发芽并释放酶等物质,穿透昆虫角质层后到达血淋巴,通过消耗寄主的营养物质从而杀死昆虫。据不完全统计,目前已报道的昆虫病原真菌约有700种,然而其中被成功分离并实现大规模工业化生产的主要包括白僵菌、绿僵菌Metarhizium spp.、轮枝菌Lecanicillium spp.和拟青霉Isaria spp.等少数类群[50, 51]。de Faria等[52]发现,在实现商业化的110种昆虫病原真菌中,球孢白僵菌Beauveria bassiana和金龟子绿僵菌Metarhizium anisopliae是产量最高、应用最广的种类(表 2),两者在所有商业化昆虫病原真菌的市场份额中分别占40%和39%。此外,随着研究的不断深入,近十年来世界各地尤其是亚洲和拉丁美洲的许多昆虫病原真菌也被逐渐开发出来用于害虫的生物防治[53]。目前,这些商品化真菌杀虫剂已相对成熟,用于林间以防治舞毒蛾、松毛虫、云杉八齿小蠹Ips typographus、中欧山松大小蠹Dendroctonus ponderosae、红棕象甲Rhynchophorus ferrugineus、光肩星天牛Anoplophora glabripennis、白蜡窄吉丁Agrilus planipennis、斑衣蜡蝉Lycorma delicatula和柏蚜Cinara cupressi等害虫,对目标害虫幼虫或成虫的防治效果达到45%以上[50, 54]。
1.2.4 昆虫病原线虫斯氏线虫Steinernema spp.和异小杆线虫Heterorhabditis spp.是常见于土壤中的用于防治森林害虫的两类昆虫病原线虫(表 2),具有杀虫效率高、靶标性强、环保安全、易于规模化生产和施用等优势,主要通过侵染期幼虫侵染和寄生昆虫、在后者血腔内释放共生菌和增殖以及导致昆虫死亡来发挥控害作用[39]。目前,已有10多种昆虫病原线虫实现了商业化生产,被用于叶蜂Cephalcia spp.、天牛、松树象甲Hylobius spp.、鳃金龟Melolontha spp.、舞毒蛾等害虫的防治实践[55],取得了明显的效果。如Battitsti[56]明确,芜菁夜蛾线虫Steinernema feltiae和卡森斯氏线虫S. kraussei对腮扁叶蜂Cephalcia arvensis的致死率可达50%以上;Eidt等[57]发现,在幼苗根部施用小卷蛾斯氏线虫S. carpocapsae后可减轻松象甲Hylobius congener对该幼苗的危害。然而需要注意的是,由于病原线虫对野外自然环境较为敏感,林间施用时效果并不稳定。如Kapranas等[58]发现,病原线虫对温度和水分极为敏感,当林间温度低于25℃、降水多、土壤湿度较高时,线虫对害虫的控制作用明显较高,反之则控害效果较差。因而,在整个微生物农药市场中,昆虫病原线虫的占比还相对较小[44]。
1.3 昆虫信息素过去一般认为,化学信息物质(semiochemical)按作用范围可分为作用于种内的信息素(pheromone)和作用于种间的化感物质(allelochemicals)两大类[4]。随着研究的不断深入,研究人员发现许多化学物质既可作用于种内又可作用于种间,往往很难区分,因此目前将pheromone和semiochemical统一称作信息素。昆虫信息素指昆虫产生的一类用于影响其他个体定位寄主及生存栖境、交配、交流互动等行为和反应的微量化学物质,包括性信息素、聚集信息素、示踪信息素和报警信息素等多种。在这些信息素中,关于鳞翅目雌虫性信息素和鞘翅目昆虫信息素的研究和应用最广[59, 60]。由于具有准确性高、专一性强和使用便捷等优点,昆虫信息素已被用于昆虫监测、趋避、阻断交配和诱杀。如通过林间悬挂性诱剂,北美等地成功控制了当地舞毒蛾和苹果蠹蛾Cydia pomonella的种群数量[61, 62]。黄杉大小蠹Dendroctonus pseudotsugae、红翅大小蠹D. rufipennis、西方松大小蠹D. brevicomis等害虫的化学信息素已被成功分离和鉴定[4],并用于害虫的监测、检测和种群管理。白蜡吉丁啮小蜂Tetrastichus planipennisi等天敌昆虫的性信息素也已被鉴定和人工合成,对于提高林间天敌昆虫的监测效率以及释放后的效果评估等具有重要作用[63]。
1.4 植物源杀虫剂植物源杀虫剂是基于菊、樟、楝、红豆杉等植物自身的次生代谢产物制成的,对某些害虫具有毒杀、驱避和抑制作用的杀虫剂,主要包括除虫菊素、鱼藤酮、生物碱、尼古丁和植物精油等诸多类别[43]。与化学杀虫剂相比,植物源杀虫剂具有杀虫成分天然可降解、原料实惠易得、相对安全环保等优势,因而越来越受到各国尤其是拉丁美洲和非洲等发展中国家农林业研究与管理人员的关注[64, 65]。Isman[64]发现,自21世纪以来,有关植物源杀虫剂的研究和应用较20世纪80年代增加近10倍,商品化植物源农药占所有生物农药市场比重的5.6%,占所有农药使用量的0.05%。为明确针对蛀干害虫桃红颈天牛Aromia bungii的高效安全的防治方法,Sunamura等[66]探究了噻虫嗪和呋虫胺两种烟碱类杀虫剂对该天牛幼虫的控制作用,认为通过对树干注射较低浓度的上述杀虫剂可在短时间内控制桃红颈天牛初孵幼虫,而老熟幼虫则需要相对较大剂量和较长时期的处理。Liu等[67]经室内研究明确了除虫菊素Pyrethrins Ⅱ对松褐天牛的控制作用。Qu等[43]发现印楝油、薄荷油、迷迭香油等植物精油成分复杂,可降低害虫抗药性的产生。然而,目前我国对植物源杀虫剂的研究和开发更多集中在筛选新的来源植物上,而在寻找已知活性成分的分子模板、基团改造、合成杀虫活性更强的化合物等方面则相对较少[68]。
1.5 其他生防产品微孢子虫和蒲螨Pyemotes spp.等其他生物同样被用作森林害虫的生防产品。微孢子虫专性寄生于节肢动物等生物的细胞内,通过吸收宿主营养而损害或杀死宿主[39]。据报道,目前微孢子虫中的一些种类已实现商业化生产,用于鳞翅目和直翅目等多种农林害虫的生物防治,并取得较为明显的效果[69]。近年来,捕食螨和寄生螨的商业化程度逐渐提高,P. giganticus和P. dryas是多种森林害虫的优势捕食螨[70];中华甲虫蒲螨P. zhonghuajia和摩泽蒲螨P. moseri等寄生性蒲螨已被开发并广泛应用于多种蛀干害虫的林间防治[71, 72]。
此外,微生物及食虫动物等还可通过释放抗生素、毒素肽、杀虫蛋白、水解酶等代谢产物毒杀害虫[5]。考虑到某些生物自身产生这些代谢产物的能力有限,为提高实际应用中的产量和效率并降低成本,目前生产上也会通过利用其他生物以及新型技术手段来创制或开发这些生防产品。为解决昆虫信息素提取时工序复杂、耗资较大等问题,目前生产上正在尝试利用化学、微生物和植物合成等手段进行改良[59]。此外,考虑到信息素在野外应用时活性易受温度、光照和雨水等环境条件影响,效果并不稳定,类信息素已被开发出来以应用于森林害虫的综合防治。
2 新型生物防治技术研发及应用前景 2.1 林木抗虫育种树木中某些种类通常基于自身形态、结构、养分和代谢产物等对一些害虫甚至是入侵性害虫具有天然抵御能力,而传统的林木抗虫育种即通过无性繁殖或收集种子等其他生物材料进行抗性树种的筛选和育种。这种常规的林木抗虫育种在国内外均具有较为悠久的历史[73]。近年来,这一方法在针对国内的桉树和槐树,以及国外的松树、榆树和栗树等的保护中应用较多,并取得了较为明显的成效。
此外,利用树木自身次生代谢物质的抗虫机理,结合DNA重组等分子手段,将抗性基因导入树木体内或进行定向遗传修饰,是目前新兴的林木抗虫育种方法[74]。该方法具有高效稳定、专一性强等优点,近年来受到越来越多研究人员的关注。在所有林业树种中,杨树是我国研究林木抗性基因工程的主要模式植物,其常用的抗性基因包括微生物源、动物源和植物源三类,其中基于杨树的Bt抗虫转基因研究已居世界前列[75]。然而,转基因抗虫更多应用于农业领域和室内研究,并未在林间实现大规模野外应用。如尽管杨树多个抗虫新品种被推出并用于野外抗虫试验和安全性检测评估,但研究人员发现这些转基因杨树对多食性害虫的控制作用有限。Ding等[76]发现室内喂食转基因杨树叶片可降低美国白蛾幼虫的取食能力,但美国白蛾寄主植物十分广泛,仅靠少数几种转基因抗虫树种并不能实现对害虫野外种群的有效控制,反而可能会无意中提高其抗性。
2.2 RNAi生物杀虫剂RNA干扰(RNA interference, RNAi)是细胞转录过程中的基因沉默机制之一,可通过双链RNA (double stranded RNA, dsRNA)诱发同源mRNA降解,阻止靶标基因表达[77]。RNAi生物农药通过RNA干扰抑制靶标基因的转录,减少蛋白质翻译,从而抑制、杀死害虫,达到对有害生物种群的可持续控制[78]。随着基因组测序技术的不断发展,大量与害虫危害相关的关键基因被发现,为虫害的遗传学控制提供了丰富的候选靶标,推动了以RNAi为核心的RNAi生物农药的实践和发展。目前,dsRNA技术的应用主要分为四种策略:(1) HIGS (转基因植物)策略;(2) SIGS (喷洒)策略;(3) NDGS (纳米载体递送)策略;(4) VIGS (病毒或微生物表达和递送)策略。
dsRNA技术在农业害虫防治方面已取得很好的研究进展,但在森林害虫防治方面应用较少。已有研究表明,dsRNA技术对南方松大小蠹Dendroctonus frontalis、华山松大小蠹D. armandi、光肩星天牛、舞毒蛾、云杉卷叶蛾Choristoneura fumiferana、白蜡窄吉丁和柳蓝叶甲Plagiodera versicolora等森林害虫有较好的防治效果[79]。但dsRNA技术的防控效率受很多因素影响,不同物种间对靶标基因的敏感性也是不同的。如Kyre等[80]以热激蛋白HSP、阻断肽SHI和细胞凋亡抑制因子IAP为靶标合成dsRNA,分别饲喂南方松大小蠹成虫10天发现,dsHSP组和dsSHI组达到约100%和86.67%的死亡率,而dsIAP组并不导致死亡;但是,利用合成的dsRNA饲喂或喷洒中欧山松大小蠹成虫7天发现,三组均可达到100%的死亡率[81]。此外,dsRNA的递送方式也会影响其防控效率。Dhandapani等[82, 83]发现,以IAP、液泡分选蛋白SNF7和sSJ特异性蛋白SSK为靶标合成dsRNA饲喂光肩星天牛,后者死亡率可分别达到90%、75%和80%;而以注射方式处理时,死亡率分别为100%、50%和40%。目前,森林害虫dsRNA农药的递送主要是基于SIGS和VIGA策略衍生的五种递送方式(图 1),包括基于SIGS策略的喷洒法、注射法和浸根法[84-86],以及基于VIGS策略的病毒表达递送法和微生物表达递送法[87, 88]。此外,基于NDGS策略的纳米载体渗透递送系统可提高dsRNA的有效性[89],被认为是一种潜在的可以通过叶柄吸收、树干注射和根系吸收的非转基因的森林害虫dsRNA农药递送方法。但由于纳米材料已被证实对人类和动物健康有害,且对生态环境有负面影响[90],因此纳米载体渗透递送系统的应用还有待进一步研究。
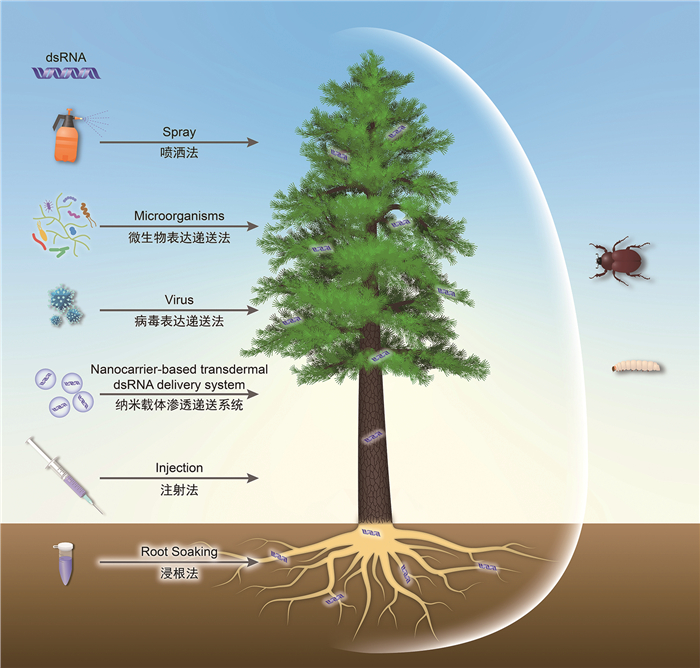
|
图 1 森林害虫dsRNA农药的递送方法 |
Wolbachia是无脊椎动物胞内专性寄生的、可经卵传给下一代的革兰阴性共生菌,主要寄生在昆虫的生殖器官中[91, 92]。它能在宿主细胞内进行复制和传播,通过母系遗传方式在昆虫种群中传播。Wolbachia具有多种杀虫机制,如影响昆虫的生殖方式、代谢过程、免疫反应等,使其在害虫及虫媒疾病的防控中具有广阔应用前景。
Wolbachia在害虫防治中的应用主要集中在以下两个方面。(1)通过直接感染害虫,降低其繁殖能力和生存能力。Wolbachia对宿主的调控作用主要包括细胞质不兼容性(cytoplasmic incompatibility, CI)、杀雄、雌性化、孤雌生殖等生殖调控和其他调控方式,其中最常见的机制是细胞质不兼容性[93],即携带Wolbachia的雄虫与野外未携带Wolbachia的雌虫交配后所产的卵不能孵化。而通过释放携带Wolbachia的雄虫来控制靶标昆虫的技术被称为昆虫不相容技术(incompatible insect technique, IIT)[94]。郑小英等[95]通过人工转染建立和鉴定了携带三种Wolbachia菌型(wAlbA、wAlbB和wPip)的白纹伊蚊HC蚊株,应用昆虫不相容技术结合昆虫绝育技术(IIT-SIT),大规模生产HC雄蚊并在开放式试验场释放,基本清除了白纹伊蚊的种群,并且没有产生种群替换问题。Gong等[96]通过胚胎显微注射技术在半翅目昆虫中实现Wolbachia转染,既能令其后代不育,又能阻断病毒传播。用Wolbachia接种烟粉虱Bemisia tabaci后,粉虱若虫和成虫数量均显著减少[97]。(2)通过调控害虫的解毒代谢等生理过程,提高其对抗虫剂的敏感性。研究发现,高温胁迫可显著抑制褐飞虱Nilaparvata lugens体内温度敏感性共生菌Wolbachia,进而抑制褐飞虱解毒代谢酶基因表达,破坏共生菌介导的宿主的解毒代谢,这一发现为森林害虫防治提供了新的思路和方法[98]。目前,Wolbachia害虫防治技术研究主要集中于虫媒疾病和农业害虫,但Wolbachia共生菌具有环保、安全的优点,作为一种新兴的生物防治手段,在森林害虫防治中具有巨大的潜力和优势,未来将发挥更大作用。
2.4 工程菌改造技术近年来,许多环境友好型工程菌正被开发为化学杀虫剂的潜在替代品。但是,工程菌具有低毒、见效慢等特性[99],其毒力还受到温度、湿度、紫外线强度等环境因素影响[100],严重制约了工程菌杀虫剂的推广与应用。因此,许多研究人员寻求各种方法改造工程菌来提高杀虫效果。常用于工程菌改造的技术有基因工程技术和诱变技术。
基因工程已被证明是一种很有前途的策略,可以显著提高工程菌的毒力,增强其抗逆性[101]。利用分子遗传学或重组DNA技术等方法,可通过合适的载体将杀虫基因、外源毒素导入工程菌中,从而获得具有高毒力、高杀虫能力的菌株。在爪哇虫草菌Cordyceps javanica中分别过表达枯草杆菌蛋白酶基因CJPRB、CJPRB1和三肽酶基因CJ-CLN2-1后,三种突变菌株对美国白蛾的毒力都显著增强[102]。除导入毒力因子外,近年来在工程菌中过表达非编码小RNA和dsRNA干扰宿主关键基因,同样提高了工程菌的毒力,为增强工程菌对森林害虫的毒力提供了新途径[103]。此外,Chen等[101]利用基于芽生孢子的遗传转化技术、尿嘧啶营养缺陷型和ura5回补技术,在球孢白僵菌中建立了一个高效的CRISPR/Cas9介导的基因编辑系统,为工程菌改造提供了更为先进的技术手段,在防治森林害虫方面具有巨大潜力。诱变法主要包括物理诱变和化学诱变。常用的物理诱变是紫外诱变技术,紫外线辐射可直接作用于工程菌的DNA分子,破坏DNA分子的结构和功能。紫外诱变白僵菌和绿僵菌获得的突变菌株可显著提升对苜蓿叶象甲Hypera postica、松毛虫、桑天牛Apriona germari、蝗蝻等森林害虫的防治效果[104-106]。但物理诱变技术存在无法控制诱变方向、工作量大、诱变产物安全性不确定等问题。化学诱变是利用化学物质对工程菌进行诱变的化学技术,常用的化学诱变剂包括亚硝基脲、乙酰甲基亚硝胺、乙酰甲酸乙酯、亚硫酸钠等。但化学诱变剂对人体存在致畸致癌作用,在实际应用中受到一定限制。
2.5 遗传防治技术遗传防治技术是近年来森林害虫生物防治领域的重要发展方向,其基本原理是将一种不育的昆虫释放到自然群体中,与正常昆虫交配后产生不育卵,从而使害虫野生种群减少、基本消灭或被取代。与传统的化学药剂防治相比,其具有不污染环境,且害虫不易产生抗性等优点。目前主要通过辐射不育、遗传不育和基因工程等方式对害虫进行处理。
辐射不育是利用辐射源对害虫进行照射处理,在昆虫体内产生显性致死突变,产生不育但有交配竞争能力的昆虫[107]。辐射不育被广泛应用于昆虫学领域,成为害虫遗传防治的有效手段。马怀云等[108]使用4.90 C/kg的60Co-γ射线对桑天牛雄虫进行辐照处理,使其可育率降低至9%,且未发现活幼虫;马尾松毛虫Dendrolimus punctatus老熟蛹经10~80 Gy剂量的60Co-γ射线照射后,雌虫与正常雄虫交尾后所产卵的孵化率随辐射剂量加大而明显降低[109];牟建军等[110]使用40 Gy剂量的60Co-γ射线处理松褐天牛,通过与未经辐照的松褐天牛之间的配比试验发现,在该剂量60Co-γ射线的照射下,松褐天牛雌、雄虫生育力显著下降。昆虫不育技术所使用的辐射不育可以达到阻断害虫繁殖的目的,但在性别分离和效率上仍存在局限性[111]。当前,CRISPR技术的应用成为遗传防治的一种新途径。通过CRISPR引导的基因驱动技术,可以实现将不育基因传递到整个野生种群中,为害虫防治提供了新的工具和策略。基于CRISPR技术,目前已成功开发出了精准的昆虫不育技术(pgSIT),该系统利用基因编辑使雄性昆虫在释放后无法繁殖,从而不断抑制害虫种群。Kandul等[112]通过在父本种群中引入携带Cas9和靶向雌性存活和雄性生育必需基因的gRNA (引导RNA),在F1代产生后,通过Cas9/gRNA介导的基因编辑使得雌性显性致死和雄性不育。CRISPR技术提供了针对性强、高效且可持续的防治策略,但在森林害虫中的应用鲜有报道,预计未来将会有更多基于CRISPR的创新策略被开发出来,以应对森林生态系统中害虫问题的挑战。
2.6 基于纳米载体的生物防治技术纳米材料是指结构尺寸为1~100 nm的粒子,因其独特的物理化学特性,在病虫害防控领域显示出广阔的应用前景。纳米载体与传统化学农药相结合形成的纳米农药,在降低农药使用量、减少环境污染的同时,可实现活性成分的对靶释放,提高控害率并延长持效性[113],在森林害虫防控中被广泛关注[114]。
此外,基于纳米载体的生物防治技术也为病虫害绿色防控提供了新途径。目前,基于纳米载体的生物防治技术主要有如下几种。(1) 纳米载体携带昆虫病毒DNA,可扩大病毒防治谱。核型多角体病毒(NPV)具有致病力强、易降解和环境友好等优点,但进入非寄主细胞需要细胞受体识别,导致其防治谱窄,限制了其应用。而核酸型纳米载体结合棉铃虫NPV病毒DNA可导致飞蝗Locusta spp.、小地老虎Agrotis ypsilop等死亡,扩大了棉铃虫NPV的防治谱[115, 116]。(2) 纳米载体携带昆虫信息素与植物次生代谢物,可提高活性成分的稳定性和分散性。Shangguan等[117]以聚己内酯为核层材料、聚羟基丁酸酯为壳层材料,制备了具有核壳结构的负载斜纹夜蛾Spodoptera litura性信息素的微纳纤维,缓解了负载性信息素的早期“突释”现象,并有效延长了释放时间,在田间试验中表现出持续良好的斜纹夜蛾诱捕能力。(3) 纳米载体携带Bt毒蛋白,可提高其毒力。以Mg(OH)2作为苏云金芽孢杆菌(Bt) Cry1Ac蛋白的纳米载体,合成Cry1Ac-Mg(OH)2复合材料,研究发现其可显著提高Cry1Ac蛋白对茶尺蠖Ectropis obliqua的杀虫作用[118]。(4) 纳米载体携带外源dsRNA,可提高其有效性[113]。目前,基于纳米载体的生物防治技术主要在农业害虫防控中取得较好的成效,在森林害虫中的相关研究尚缺乏。
3 结语与展望生物防治是森林害虫防治技术的重要组成部分,传统生物防治与新型生物防治技术的结合提高了其防治效率与应用前景。传统的生物防治主要包括天敌昆虫、昆虫病原微生物、昆虫信息素和植物源杀虫剂等产品的应用,具有绿色、环保、经济和安全等优势,但也普遍存在人力成本高、稳定性差以及时效性短等缺点,直接影响了其商业化生产与应用。新型生物防治技术的发展以及与传统生物防治技术的结合,增强了生物防治靶标特异性、有效性、稳定性以及时效性等,展现出广阔的应用前景。但许多新型防治技术的应用尚存在安全性评估问题,限制了目前的实际应用,例如纳米技术、dsRNA技术、共生菌Wolbachia害虫防治技术等。
我国森林害虫生物防治目前仍处于发展阶段。在天敌昆虫的应用方面,加拿大等北美国家利用多种捕食性、拟寄生性天敌昆虫长期开展针对森林害虫的防治实践[119]。我国天敌昆虫资源被不断挖掘和丰富,但与欧美发达国家相比,仍存在明显差距。在规模化繁育天敌方面,虽然已开发了赤眼蜂等产品,但其控害作用评价还不够充分,田间效能评价还不够深入[120]。在病原微生物的研究与应用方面,我国处于国际前沿水平。在昆虫病原细菌领域,我们与国外几乎处于并跑水平,目前世界范围内细菌杀虫剂的基础研究均已进入深水区,因此新思路和新技术的运用显得尤为重要。在昆虫病原真菌领域,我国在菌种资源库、工程菌构建,抗逆和毒力基因挖掘等方面已取得重要进展,在应用和产业化方面已达国际领先水平。但分子改良的昆虫病原真菌仍未投入应用,存在田间防效稳定性差、储藏期短、成本较高等问题[121]。在昆虫病毒方面,我国的病毒类生物农药的品种和产品数量与发达国家相当,相关的专利数量全球领先,但在产品质量控制和应用技术方面亟待加强[122]。在昆虫性信息素的生物合成及其产业化方面,国际上一些企业已实现产业化,而国内企业还没有开展类似工作。但我国在诱捕器研发、性诱测报,特别是智能化测报技术方面明显走在前列。目前国内成功应用性信息素防治的森林害虫包括美国白蛾、松毛虫、白杨透翅蛾Paranthrene tabaniformis、毒蛾、木蠹蛾等,全国已布点安装各类智能测报系统4 600多台套,极大提高了监测预警准确性和时效性,技术总体处于国际领先水平[123]。在新型生物防治技术研究与应用方面,借助新的工具手段,例如CRISPR/Cas9系统、Medea元件、Killer-Rescue系统、Wolbachia-细胞质不亲和性系统等,美国、加拿大、英国等多个国家已经启动了不同规模的下一代害虫遗传防治项目;我国在害虫遗传防治领域起步较晚,对下一代遗传防治策略的研究几乎是空白,未来需借鉴国外先进经验,对重大害虫开展更多的遗传防治基础和应用性研究[124]。
未来随着科技的进步以及多学科的交叉融合,森林害虫生物防治将朝着生态融合、基因编辑、高效精准防治和多层次综合防治等方向发展。近年来,随着“Next Generation Biological Control”(新一代生物防治)观念的提出,人们更加意识到应利用遗传学和基因组学技术来精准化管理有害生物[125]。除加强对森林害虫本身的研究外,深入理解害虫伴生微生物菌群功能,加强对微生物防治制剂的研发,有望提升森林害虫的高效防治[126]。例如,在昆虫病毒杀虫剂方面,除大规模发掘杀虫功能基因外,还应加大对病毒的遗传改造,增强其环境相容性和稳定性,并推进生产工艺的现代化[121]。组合型生物防治在森林害虫治理方面表现出较大潜力,例如寄生蜂和昆虫病原微生物的许多组合是相容的,显著提高了防治效率[127, 128]。多种生物防治技术的组合应用是森林害虫生物防治的未来发展趋势。此外,在森林害虫综合管理中,对害虫潜在暴发地的预测和早期预警是未来应优先考虑的事项。遥感技术与新型空间成像技术结合,辅以针对性的现场检测和管理,有望高效提升森林害虫的早期检测[126],优化造林措施,也有助于森林害虫防控[129]。总之,在国家政策支持和法规规范下,随着交叉学科的互融互促,特别是生物信息学、合成生物学、模型统计学的综合应用,生物防治在森林害虫综合治理方面具有广阔前景,未来有望开发更多的新型生物防治技术和产品,更大程度上实现森林害虫的持续、高效、无害化精准治理。
| [1] |
Fernandez-Conradi P, Castagneyrol B, Jactel H, et al. Combining phytochemicals and multitrophic interactions to control forest insect pests. Curr Opin Insect Sci, 2021, 44: 101-6. DOI:10.1016/j.cois.2021.04.007 |
| [2] |
Diagne C, Leroy B, Vaissière AC, et al. High and rising economic costs of biological invasions worldwide. Nature, 2021, 592: 571-6. DOI:10.1038/s41586-021-03405-6 |
| [3] |
Sparks TC, Nauen R. IRAC: mode of action classification and insecticide resistance management. Pestic Biochem Physiol, 2015, 121: 122-8. DOI:10.1016/j.pestbp.2014.11.014 |
| [4] |
Seybold SJ, Bentz BJ, Fettig CJ, et al. Management of western North American bark beetles with semiochemicals. Annu Rev Entomol, 2018, 63: 407-32. DOI:10.1146/annurev-ento-020117-043339 |
| [5] |
Ajuna HB, Lim HI, Moon JH, et al. The prospect of hydrolytic enzymes from Bacillus species in the biological control of pests and diseases in forest and fruit tree production. Int J Mol Sci, 2023, 24: 16889. DOI:10.3390/ijms242316889 |
| [6] |
Monteagudo N, Benayas JMR, Andivia E, et al. Avian regulation of crop and forest pests, a meta-analysis. Pest Manage Sci, 2023, 79: 2380-9. DOI:10.1002/ps.7421 |
| [7] |
Cusumano A, Volkoff AN. Influence of parasitoid-associated viral symbionts on plant-insect interactions and biological control. Curr Opin Insect Sci, 2021, 44: 64-71. DOI:10.1016/j.cois.2021.03.009 |
| [8] |
Koller J, Sutter L, Gonthier J, et al. Entomopathogens and parasitoids allied in biocontrol: a systematic review. Pathogens, 2023, 12: 957. DOI:10.3390/pathogens12070957 |
| [9] |
Zhou Y, Lu C, Chen Z, et al. Pathogenicity virulence of Beauveria spp. and biosafety of the BbMQ strain on adult ectoparasitic beetles, Dastarcus helophoroides Fairmaire (Coleoptera: Colydiidae). Front Vet Sci, 2023, 10: 1077473. DOI:10.3389/fvets.2023.1077473 |
| [10] |
吴帆, 刘深云, 张莉, 等. 昆虫信息素研究进展. 植物保护学报, 2023, 50: 287-97. |
| [11] |
Nikolouli K, Colinet H, Renault D, et al. Sterile insect technique and Wolbachia symbiosis as potential tools for the control of the invasive species Drosophila suzukii. J Pest Sci, 2018, 91: 489-503. DOI:10.1007/s10340-017-0944-y |
| [12] |
Su CY, Liu SS, Cao SH, et al. Self-assembled bovine serum albumin nanoparticles as pesticide delivery vectors for controlling trunk-boring pests. J Nanobiotechnol, 2020, 18: 165. DOI:10.1186/s12951-020-00725-z |
| [13] |
Yuan J, Zhang J, Zhang Y, et al. Protocols for CRISPR/Cas9 mutagenesis of the oriental fruit fly Bactrocera dorsalis. J Visualized Exp, 2022. DOI:10.3791/64195 |
| [14] |
Elkinton JS, Boettner GH, Broadley HJ. Successful biological control of winter moth, Operophtera brumata, in the northeastern United States. Ecol Appl, 2021, 31: e02326. DOI:10.1002/eap.2326 |
| [15] |
Wang L, Li C, Luo Y, et al. Current and future control of the wood‐boring pest Anoplophora glabripennis. Insect Sci, 2023, 30: 1534-51. DOI:10.1111/1744-7917.13187 |
| [16] |
Stüber M, Tack AJM, Zewdie B, et al. Multi-scale mosaics in top-down pest control by ants from natural coffee forests to plantations. Ecology, 2021, 102: e03376. DOI:10.1002/ecy.3376 |
| [17] |
Hermann SL, Landis DA. Scaling up our understanding of non-consumptive effects in insect systems. Curr Opin Insect Sci, 2017, 20: 54-60. DOI:10.1016/j.cois.2017.03.010 |
| [18] |
Preisser EL, Bolnick DI, Grabowski JH. Resource dynamics influence the strength of non-consumptive predator effects on prey. Ecol Lett, 2009, 12: 315-23. DOI:10.1111/j.1461-0248.2009.01290.x |
| [19] |
Lee DH, Nyrop JP, Sanderson JP. Non-consumptive effects of the predatory beetle Delphastus catalinae (Coleoptera: Coccinellidae) on habitat use patterns of adult whitefly Bemisia argentifolii (Hemiptera: Aleyrodidae). Appl Entomol Zool, 2014, 49: 599-606. DOI:10.1007/s13355-014-0294-7 |
| [20] |
Buchanan AL, Hermann SL, Lund M, et al. A meta-analysis of non-consumptive predator effects in arthropods: the influence of organismal and environmental characteristics. Oikos, 2017, 126: 1233-40. DOI:10.1111/oik.04384 |
| [21] |
Fill A, Long EY, Finke DL. Non-consumptive effects of a natural enemy on a non-prey herbivore population. Ecol Entomol, 2012, 37: 43-50. DOI:10.1111/j.1365-2311.2011.01333.x |
| [22] |
Ingerslew KS, Finke DL. Non-consumptive effects stabilize herbivore control over multiple generations. PLoS One, 2020, 15: e0241870. DOI:10.1371/journal.pone.0241870 |
| [23] |
党英侨, 王小艺. 农林害虫天敌昆虫的捕食、拟寄生和寄生现象. 生物学教学, 2021, 46: 7-10. |
| [24] |
Fan ZY, Zhu ZP, Peng J, et al. Non-consumptive effects of Encarsia formosa on the reproduction and metabolism of the whitefly Bemisia tabaci. BioControl, 2021, 66: 639-48. DOI:10.1007/s10526-021-10099-2 |
| [25] |
Morales-Ramos JA, Rojas MG, Shapiro-Ilan DI. Mass production of beneficial organisms: invertebrates and entomopathogens (first editon): Cambridge: Academic Press, 2014.
|
| [26] |
Symondson WOC, Sunderland KD, Greenstone MH. Can generalist predators be effective biocontrol agents?. Annu Rev Entomol, 2002, 47: 561-94. DOI:10.1146/annurev.ento.47.091201.145240 |
| [27] |
Boldorini GX, Mccary MA, Romero GQ, et al. Predators control pests and increase yield across crop types and climates: a meta-analysis. Proc R Soc B, 2024, 291: 20232522. DOI:10.1098/rspb.2023.2522 |
| [28] |
Kim JC, Baek S, Park SE, et al. Colonization of Metarhizium anisopliae on the surface of pine tree logs: a promising biocontrol strategy for the Japanese pine sawyer, Monochamus alternatus. Fungal Biol, 2020, 124: 125-34. DOI:10.1016/j.funbio.2019.12.006 |
| [29] |
Yang ZQ, Wang XY, Zhang YN. Recent advances in biological control of important native and invasive forest pests in China. Biol Control, 2014, 68: 117-28. DOI:10.1016/j.biocontrol.2013.06.010 |
| [30] |
Abell KJ, Duan JJ, Shrewsbury PM. Determining optimal parasitoid release timing for the biological control of emerald ash borer (Coleoptera: Buprestidae). Fla Entomol, 2020, 102: 691. DOI:10.1653/024.102.0403 |
| [31] |
Morales-Ramos JA, Goolsby JA, Geden C, et al. Production of hymenopteran parasitoids[M]//Morales-Ramos JA, Rojas MG, Shapiro-Ilan DI. Mass production of beneficial organisms: invertebrates and entomopathogens (second editon). Cambridge: Academic Press, 2023
|
| [32] |
Consoli FL, Parra JRP, Zucchi RA. Egg parasitoids in agroecosystems with emphasis on Trichogramma: Cham: Springer, 2010.
|
| [33] |
Dindo ML, Grenier S. Production of dipteran parasitoids[M]//Morales-Ramos JA, Rojas MG, Shapiro-Ilan DI. Mass production of beneficial organisms: invertebrates and entomopathogens (second editon). Cambridge: Academic Press, 2023
|
| [34] |
Rohrmann GF. Baculovirus Molecular Biology: 4th edition. Bethesda (MD): National Center for Biotechnology Information (US), 2019.
|
| [35] |
Liu Y, Wang G, Qin Y, et al. Sustainable nano-pesticide platform based on Pyrethrins Ⅱ for prevention and control Monochamus alternatus. J Nanobiotechnol, 2022, 20: 183. DOI:10.1186/s12951-022-01409-6 |
| [36] |
Wagemans J, Holtappels D, Vainio E, et al. Going viral: virus-based biological control agents for plant protection. Annu Rev Phytopathol, 2022, 60: 21-42. DOI:10.1146/annurev-phyto-021621-114208 |
| [37] |
Sosa-Gómez DR, Morgado FS, Corrêa RFT, et al. Entomopathogenic viruses in the neotropics: current status and recently discovered species. Neotrop Entomol, 2020, 49: 315-31. DOI:10.1007/s13744-020-00770-1 |
| [38] |
Sun XL. History and current status of development and use of viral insecticides in China. Viruses, 2015, 7: 306-19. DOI:10.3390/v7010306 |
| [39] |
Grégoire JC, Gould JR. Forest insect-natural enemy interactions[M]//Allison JD, Paine TD, Slippers B, et al. Forest entomology and pathology. Volume 1: entomology. Cham: Springer, 2023
|
| [40] |
Moore S, Kirkman W, Richards G, et al. The Cryptophlebia leucotreta granulovirus-10 years of commercial field use. Viruses, 2015, 7: 1284-312. DOI:10.3390/v7031284 |
| [41] |
Paliwal D, Hamilton AJ, Barrett GA, et al. Identification of novel aphid-killing bacteria to protect plants. Microb Biotechnol, 2022, 15: 1203-20. DOI:10.1111/1751-7915.13902 |
| [42] |
Smee MR, Real-Ramirez I, Zuluaga Arias C, et al. Epiphytic strains of Pseudomonas syringae kill diverse aphid species. Appl Environ Microbiol, 2021, 87: e00017-21. |
| [43] |
Qu M, Merzendorfer H, Moussian B, et al. Bioinsecticides as future mainstream pest control agents: opportunities and challenges. Front Agric Sci Eng, 2022, 9: 82-97. DOI:10.15302/J-FASE-2021404 |
| [44] |
Skrzecz I, Sierpińska A, Tumialis D. Entomopathogens in the integrated management of forest insects: From science to practice. Pest Manage Sci, 2024, 80: 2503-14. DOI:10.1002/ps.7871 |
| [45] |
Nutaratat P, Werapan B, Phosrithong N, et al. Vegetative insecticidal protein (Vip3A) production by Bacillus thuringiensis Bt294 and its efficacy against Lepidopteran pests (Spodoptera exigua). Biotechnol Rep, 2023, 40: e00812. DOI:10.1016/j.btre.2023.e00812 |
| [46] |
Nealis V, Conder N. Biological control using Bacillus thuringiensis (B.t. )[EB/OL]. (2020-07-10). https://natural-resources.canada.ca/forests/fire-insects-disturbances/top-insects/13401. 2020
|
| [47] |
Li JL, Chen JY, Cai P. Research progress of occurrence and comprehensive control of fall webworm [Hyphantria cunea (Drury)]. Plant Dis Pests, 2013, 4: 32-5, 44. |
| [48] |
Li L, Chen Z, Yu Z. Mass production, application and market development of Bacillus thuringiensis biopesticides in China[M]//Fiuza LM, Polanczyk RA, Crickmore N. Bacillus thuringiensis and Lysinibacillus sphaericus. Cham: Springer, 2017: 185-212
|
| [49] |
Wang P, Wei H, Sun W, et al. Effects of Bt-Cry1Ah1 transgenic poplar on target and non-target pests and their parasitic natural enemy in field and laboratory trials. Forests, 2020, 11: 1255. DOI:10.3390/f11121255 |
| [50] |
Dara SK, Montalva C, Barta M. Microbial control of invasive forest pests with entomopathogenic fungi: a review of the current situation. Insects, 2019, 10: 341. DOI:10.3390/insects10100341 |
| [51] |
Mann AJ, Davis TS. Entomopathogenic fungi to control bark beetles: a review of ecological recommendations. Pest Manage Sci, 2021, 77: 3841-6. DOI:10.1002/ps.6364 |
| [52] |
de Faria MR, Wraight SP. Mycoinsecticides and mycoacaricides: a comprehensive list with worldwide coverage and international classification of formulation types. Biol Control, 2007, 43: 237-56. DOI:10.1016/j.biocontrol.2007.08.001 |
| [53] |
Jaronski ST, Mascarin GM. Mass production of fungal entomopathogens[M]//Lacey LA. Microbial control of insect and mite pests. Cambridge: Academic Press, 2017: 141-55
|
| [54] |
Kim IK, Park YK, Koh SH. Chalcidoid wasps parasitizing pupae of fall webworm, Hyphantria cunea (Drury), in South Korea. Entomol Res, 2011, 41: 278. |
| [55] |
Shapiro-Ilan DI, Leite LG, Han R. Production of entomopathogenic nematodes[M]//Morales-Ramos JA, Rojas MG, Shapiro-Ilan DI. Mass production of beneficial organisms: invertebrates and entomopathogens (second editon). Cambridge: Academic Press, 2023: 293-315
|
| [56] |
Battitsti A. Effects of entomopathogenic nematodes on the spruce web-spinning sawfly Cephalcia arvensis panzer and its parasitoids in the field. Biocontrol Sci Technol, 1994, 4: 95-102. DOI:10.1080/09583159409355317 |
| [57] |
Eidt DC, Zervos S, Pye AE, et al. Control of Hylobius congener Dalle, Torre, Shenkling, and Marshall (Coleoptera: Curculionidae) using entomopathogenic nematodes. Can Entomol, 1995, 127: 431-8. DOI:10.4039/Ent127431-3 |
| [58] |
Kapranas A, Malone B, Quinn S, et al. Efficacy of entomopathogenic nematodes for control of large pine weevil, Hylobius abietis: effects of soil type, pest density and spatial distribution. J Pest Sci, 2017, 90: 495-505. DOI:10.1007/s10340-016-0823-y |
| [59] |
Petkevicius K, Löfstedt C, Borodina I. Insect sex pheromone production in yeasts and plants. Curr Opin Biotechnol, 2020, 65: 259-67. DOI:10.1016/j.copbio.2020.07.011 |
| [60] |
Keeling CI, Tittiger C, MacLean M, et al. Pheromone production in bark beetles[M]//Blomquist GJ, Vogt RG. Insect pheromone biochemistry and molecular biology. Cambridge: Academic Press, 2021: 123-62
|
| [61] |
Witzgall P, Stelinski L, Gut L, et al. Codling moth management and chemical ecology. Annu Rev Entomol, 2008, 53: 503-22. DOI:10.1146/annurev.ento.53.103106.093323 |
| [62] |
Lance DR, Leonard DS, Mastro VC, et al. Mating disruption as a suppression tactic in programs targeting regulated lepidopteran pests in US. J Chem Ecol, 2016, 42: 590-605. DOI:10.1007/s10886-016-0732-9 |
| [63] |
Cossé AA, Zilkowski BW, Zou YF, et al. Female-produced sex pheromone of Tetrastichus planipennisi, a parasitoid introduced for biological control of the invasive emerald ash borer, Agrilus planipennis. J Chem Ecol, 2020, 46: 508-19. DOI:10.1007/s10886-020-01188-0 |
| [64] |
Isman MB. Botanical insecticides: a global perspective[M]// Gross AD, Coats JR, Duke SO, et al. Biopesticides: state of the art and future opportunities. Washington: American Chemical Society, 2014: 21-30
|
| [65] |
George-Onaho JA, Ete JA, Ayandokun AE, et al. Botanical insecticides: the way to go for sustainable environmental management[C]//7th Biennial Forest and Forest Products Society 2021 Conference Proceeding, 2021: 243-47
|
| [66] |
Sunamura E, Tamura S, Taki H, et al. Efficacy of two neonicotinoid insecticides against invasive wood borer Aromia bungii larvae in dietary toxicity test. Insects, 2021, 12: 592. DOI:10.3390/insects12070592 |
| [67] |
Liu L, Yu H, Wang D. Genomic and biological characteristics of an alphabaculovirus isolated from Trabala vishnou gigantina. Virus Res, 2022, 308: 198630. DOI:10.1016/j.virusres.2021.198630 |
| [68] |
董小绮, 康兆勇, 刘胜男, 等. 新型植物源天然产物杀虫剂研究进展. 农药学学报, 2023, 25: 969-89. |
| [69] |
Zhang L, Lecoq M. Nosema locustae (Protozoa, Microsporidia), a biological agent for locust and grasshopper control. Agronomy, 2021, 11: 711. DOI:10.3390/agronomy11040711 |
| [70] |
Purti, Rinku, Jaglan RS, et al. Biological control of coleopteran pests. Int J Bio-Resour Stress Manage, 2018, 9: 421-34. DOI:10.23910/IJBSM/2018.9.3.3C0249 |
| [71] |
Cui ZJ, Zhang YL, Zhang X, et al. Life history and mortality factors of Agrilus mali matsumura (Coleoptera: Buprestidae) in wild apples in Northwestern China. Agric For Entomol, 2019, 21: 309-17. DOI:10.1111/afe.12333 |
| [72] |
He L, Li L, Yu L, et al. Optimizing cold storage of the ectoparasitic mite Pyemotes zhonghuajia (Acari: Pyemotidae), an efficient biological control agent of stem borers. Exp Appl Acarol, 2019, 78: 327-42. DOI:10.1007/s10493-019-00386-0 |
| [73] |
Food and Agriculture Organization of the United Nations (FAO). State of the world's forest genetic resources (SOW-FGR). FAO, Rome. http://www.fao.org/3/a-i3825e.pdf. 2014
|
| [74] |
李薇, 李淑娴. 林木抗虫性研究进展. 西南林业大学学报, 2018, 38: 180-90. |
| [75] |
丁莉萍, 王宏芝, 魏建华. 杨树转基因研究进展及展望. 林业科学研究, 2016, 29: 124-32. |
| [76] |
Ding LP, Chen YJ, Wei XL, et al. Laboratory evaluation of transgenic Populus davidiana×Populus bolleana expressing Cry1Ac + SCK, Cry1Ah3, and Cry9Aa3 genes against gypsy moth and fall webworm. PLoS One, 2017, 12: e0178754. DOI:10.1371/journal.pone.0178754 |
| [77] |
Fire A, Xu SQ, Montgomery MK, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature, 1998, 391: 806-11. DOI:10.1038/35888 |
| [78] |
Hammond SM, Caudy AA, Hannon GJ. Post-transcriptional gene silencing by double-stranded RNA. Nat Rev Genet, 2001, 2: 110-9. DOI:10.1038/35052556 |
| [79] |
Singewar K, Fladung M. Double-stranded RNA (dsRNA) technology to control forest insect pests and fungal pathogens: challenges and opportunities. Funct Integr Genomic, 2023, 23: 185. DOI:10.1007/s10142-023-01107-y |
| [80] |
Kyre BR, Rodrigues TB, Rieske LK. RNA interference and validation of reference genes for gene expression analyses using qPCR in southern pine beetle, Dendroctonus frontalis. Sci Rep, 2019, 9: 5640. DOI:10.1038/s41598-019-42072-6 |
| [81] |
Kyre BR, Bentz BJ, Rieske LK. Susceptibility of mountain pine beetle (Dendroctonus ponderosae Hopkins) to gene silencing through RNAi provides potential as a novel management tool. Forest Eco Manag, 2020, 473: 118322. DOI:10.1016/j.foreco.2020.118322 |
| [82] |
Dhandapani RK, Duan JJ, Palli SR. Orally delivered dsRNA induces knockdown of target genes and mortality in the Asian long‐horned beetle, Anoplophora glabripennis. Arch Insect Biochem Physiol, 2020, 104: e21679. DOI:10.1002/arch.21679 |
| [83] |
Dhandapani RK, Gurusamy D, Duan JJ, et al. RNAi for management of Asian long-horned beetle, Anoplophora glabripennis: identification of target genes. J Pest Sci, 2020, 93: 823-32. DOI:10.1007/s10340-020-01197-8 |
| [84] |
Wang M, Jin H. Spray-induced gene silencing: a powerful innovative strategy for crop protection. Trends Microbiol, 2017, 25: 4-6. DOI:10.1016/j.tim.2016.11.011 |
| [85] |
Dalakouras A, Jarausch W, Buchholz G, et al. Delivery of hairpin RNAs and small RNAs into woody and herbaceous plants by trunk injection and petiole absorption. Front Plant Sci, 2018, 9: 1253. DOI:10.3389/fpls.2018.01253 |
| [86] |
Bragg Z, Rieske LK. Feasibility of systemically applied dsRNAs for pest-specific RNAi-induced gene silencing in white oak. Front Plant Sci, 2022, 13: 830226. DOI:10.3389/fpls.2022.830226 |
| [87] |
Zhang Y, Xu L, Li S, et al. Bacteria-mediated RNA interference for management of Plagiodera versicolora (Coleoptera: Chrysomelidae). Insects, 2019, 10: 415. DOI:10.3390/insects10120415 |
| [88] |
Kolliopoulou A, Kontogiannatos D, Swevers L. The use of engineered plant viruses in a trans-kingdom silencing strategy against their insect vectors. Front Plant Sci, 2020, 11: 917. DOI:10.3389/fpls.2020.00917 |
| [89] |
Yan S, Ren B, Zeng B, et al. Improving RNAi efficiency for pest control in crop species. BioTechniques, 2020, 68: 283-90. DOI:10.2144/btn-2019-0171 |
| [90] |
Olivier JC, Fenart L, Chauvet R, et al. Indirect evidence that drug brain targeting using polysorbate 80-coated polybutylcyanoacrylate nanoparticles is related to toxicity. Pharm Res, 1999, 16: 1836-42. DOI:10.1023/A:1018947208597 |
| [91] |
Gerth M, Gansauge MT, Weigert A, et al. Phylogenomic analyses uncover origin and spread of the Wolbachia pandemic. Nat Commun, 2014, 5: 5117. DOI:10.1038/ncomms6117 |
| [92] |
Foray V, Pérez-Jiménez MM, Fattouh N, et al. Wolbachia control stem cell behavior and stimulate germline proliferation in filarial nematodes. Dev Cell, 2018, 45: 198-211. DOI:10.1016/j.devcel.2018.03.017 |
| [93] |
Ross PA, Turelli M, Hoffmann AA. Evolutionary ecology of Wolbachia releases for disease control. Annu Rev Genet, 2019, 53: 93-116. DOI:10.1146/annurev-genet-112618-043609 |
| [94] |
Kaur R, Shropshire JD, Cross KL, et al. Living in the endosymbiotic world of Wolbachia: a centennial review. Cell Host Microbe, 2021, 29: 879-93. DOI:10.1016/j.chom.2021.03.006 |
| [95] |
郑小英, 吴瑜, 张东京, 等. 沃尔巴克氏体(Wolbachia)结合昆虫绝育技术控制白纹伊蚊种群. 南京农业大学学报, 2020, 43: 387-91. |
| [96] |
Gong JT, Li Y, Li TP, et al. Stable introduction of plant-virus-inhibiting Wolbachia into planthoppers for rice protection. Curr Biol, 2020, 30: 4837-45. DOI:10.1016/j.cub.2020.09.033 |
| [97] |
Magaji MDY, Mohammed IU, Jega IY, et al. Effect of Wolbachia as biocontrol agent on fecundity and survival of cassava whitefly in northwest Nigeria. Arch Agric Environ Sci, 2023, 8: 125-9. DOI:10.26832/24566632.2023.080205 |
| [98] |
Zhang Y, Cai T, Ren Z, et al. Decline in symbiont-dependent host detoxification metabolism contributes to increased insecticide susceptibility of insects under high temperature. ISME J, 2021, 15: 3693-703. DOI:10.1038/s41396-021-01046-1 |
| [99] |
St Leger RJ, Wang C. Genetic engineering of fungal biocontrol agents to achieve greater efficacy against insect pests. Appl Microbiol Biot, 2010, 85: 901-7. DOI:10.1007/s00253-009-2306-z |
| [100] |
Sharma A, Sharma S, Yadav PK. Entomopathogenic fungi and their relevance in sustainable agriculture: a review. Cogent Food Agr, 2023, 9: 2180857. DOI:10.1080/23311932.2023.2180857 |
| [101] |
Chen J, Lai Y, Wang L, et al. CRISPR/Cas9-mediated efficient genome editing via blastospore-based transformation in entomopathogenic fungus Beauveria bassiana. Sci Rep, 2017, 8: 4576. |
| [102] |
Wang W, Wang Y, Dong G, et al. Development of Cordyceps javanica BE01 with enhanced virulence against Hyphantria cunea using polyethylene glycol-mediated protoplast transformation. Front Microbiol, 2022, 13: 972425. DOI:10.3389/fmicb.2022.972425 |
| [103] |
Hu J, Xia Y. Increased virulence in the locust‐specific fungal pathogen Metarhizium acridum expressing dsRNAs targeting the host F1F0-ATPase subunit genes. Pest Manag Sci, 2019, 75: 180-6. |
| [104] |
赵春梅, 童清. 球孢白僵菌优良菌株选育研究. 林业实用技术, 2013, 56: 36-7. |
| [105] |
靳磊, 贺月林, 刘红, 等. 紫外诱变选育球孢白僵菌高产菌株. 湖南农业科学, 2011, 41: 30-1, 5. |
| [106] |
卢振起, 黄秋娴, 李雯, 等. 桑天牛生物防治专用高毒力球孢白僵菌菌株的紫外线诱变选育. 蚕业科学, 2013, 39: 1198-201. |
| [107] |
王建斌. 辐射不育技术在害虫防治中的应用. 西南林学院学报, 2010, 30: 33-5. |
| [108] |
马怀云, 崔应时, 彭镇华, 等. 桑天牛辐射不育的研究. 森林病虫通讯, 1999, 18: 8-10. |
| [109] |
何丽华, 翁宏飚, 牛宝龙, 等. 60Coγ射线辐照对马尾松毛虫繁殖力的影响. 中国森林病虫, 2009, 28: 25-6. |
| [110] |
牟建军, 吾中良, 陈卫平, 等. 松墨天牛辐射不育效应研究. 中国森林病虫, 2009, 28: 13-5. |
| [111] |
Yan Y, Aumann RA, Häcker I, et al. CRISPR-based genetic control strategies for insect pests. J Integr Agric, 2023, 22: 651-68. |
| [112] |
Kandul NP, Liu J, Buchman A, et al. Precision guided sterile males suppress populations of an invasive crop pest. GEN Biotechnol, 2022, 1: 372-85. |
| [113] |
Yan S, Hu Q, Li J, et al. A star polycation acts as a drug nanocarrier to improve the toxicity and persistence of botanical pesticides. ACS Sustainable Chem Eng, 2019, 7: 17406-13. |
| [114] |
Ma Y, Yu M, Sun Z, et al. Biomass-based, dual enzyme-responsive nanopesticides: eco-friendly and efficient control of pine wood nematode disease. ACS Nano, 2024, 18: 13781-93. |
| [115] |
Moscardi F. Assessment of the application of baculoviruses for control of Lepidoptera. Annu Rev Entomol, 1999, 44: 257-89. |
| [116] |
Liu X, Zheng Y, Zhang S, et al. Perylenediimide-cored cationic nanocarriers deliver virus DNA to kill insect pests. Polym Chem-UK, 2016, 7: 3740-6. |
| [117] |
Shangguan W, Xu H, Ding W, et al. Nano-micro core-shell fibers for efficient pest trap. Nano Lett, 2023, 23: 11809-17. |
| [118] |
Pan X, Cao F, Guo X, et al. Development of a safe and effective Bacillus thuringiensis-based nanobiopesticide for controlling tea pests. J Agr Food Chem, 2024, 72: 7807-17. |
| [119] |
MacQuarrie CJK, Lyons DB, Seehausen ML, et al. A history of biological control in Canadian forests, 1882-2014. Can Entomol, 2016, 148: S239-69. |
| [120] |
王勇, 李天昊, 王汐亚, 等. 中国赤眼蜂寄生生态学与工厂化繁殖应用新进展. 植物保护, 2023, 49: 399-409. |
| [121] |
陈学新, 杜永均, 黄健华, 等. 我国作物病虫害生物防治研究与应用最新进展. 植物保护, 2023, 49: 340-70. |
| [122] |
张宏军, 陶岭梅, 刘学, 等. 我国生物农药登记管理情况分析. 中国生物防治学报, 2022, 38: 9-17. |
| [123] |
刘万才, 刘振东, 朱晓明, 等. 我国昆虫性信息素技术的研发与应用进展. 中国生物防治学报, 2022, 38: 803-11. |
| [124] |
严盈, 万方浩. 害虫遗传防治的研究历史与现状. 生物安全学报, 2015, 24: 81-93. |
| [125] |
Leung K, Ras E, Ferguson KB, et al. Next‐generation biological control: the need for integrating genetics and genomics. Biol Rev, 2020, 95: 1838-54. |
| [126] |
Sun JH, Koski TM, Wickham JD, et al. Emerald ash borer management and research: decades of damage and still expanding. Annu Rev Entomol, 2024, 69: 239-58. |
| [127] |
Roy HE, Pell JK. Interactions between entomopathogenic fungi and other natural enemies: implications for biological control. Biocontrol Sci Techn, 2000, 10: 737-52. |
| [128] |
Quesada-Moraga E, Garrido-Jurado I, Yousef-Yousef M, et al. Multitrophic interactions of entomopathogenic fungi in BioControl. BioControl, 2022, 67: 457-72. DOI:10.1007/s10526-022-10163-5?utm_source=xmol&utm_content=meta |
| [129] |
Klapwijk MJ, Bylund H, Schroeder M, et al. Forest management and natural biocontrol of insect pests. Forestry, 2016, 89: 253-62. |
 2025, Vol. 37
2025, Vol. 37 

 王小艺,中国林业科学研究院森林生态环境与自然保护研究所研究员、博士生导师、首席专家。主要从事林业重大害虫生物防治工作,近年来针对林木蛀干害虫和食叶害虫,明确了共享寄主的寄生蜂种间竞争共存的生态学机制,发现了寄生蜂利用振动定位寻找隐蔽性寄主害虫的机制,测定了寄生蜂的生存策略与寄主质量之间的关系等,为人工繁育天敌提供了科学依据。先后主持国家重点研发计划项目、国家自然科学基金等多项研究课题。累计发表论文220多篇,其中SCI论文60多篇;授权发明专利11项;出版专著3部;
王小艺,中国林业科学研究院森林生态环境与自然保护研究所研究员、博士生导师、首席专家。主要从事林业重大害虫生物防治工作,近年来针对林木蛀干害虫和食叶害虫,明确了共享寄主的寄生蜂种间竞争共存的生态学机制,发现了寄生蜂利用振动定位寻找隐蔽性寄主害虫的机制,测定了寄生蜂的生存策略与寄主质量之间的关系等,为人工繁育天敌提供了科学依据。先后主持国家重点研发计划项目、国家自然科学基金等多项研究课题。累计发表论文220多篇,其中SCI论文60多篇;授权发明专利11项;出版专著3部; 孙江华,河北大学生命科学学院教授、博士生导师,国家杰出青年科学基金获得者。曾任中国科学院动物研究所研究员、中国科学院特聘研究员、中国科学院大学岗位教授等。现兼任《昆虫学报》主编、国际昆虫学大会执委(CICE)、FAO Asia-Pacific Forest Invasive Species Network Coordinator、全国林业有害生物防治技术标准化委员会副主任等。长期从事信息化合物介导的“寄主植物-害虫-伴生真菌-细菌”多物种互作及共生入侵机制研究,代表性成果发表于PNAS、Science Advances、Nature Communications、ISME Journal、Microbiome、Current Biology、New Phytologist等,总计150余篇;先后4次受邀在Annual Review系列杂志和Trends in Parasitology撰写综述论文
孙江华,河北大学生命科学学院教授、博士生导师,国家杰出青年科学基金获得者。曾任中国科学院动物研究所研究员、中国科学院特聘研究员、中国科学院大学岗位教授等。现兼任《昆虫学报》主编、国际昆虫学大会执委(CICE)、FAO Asia-Pacific Forest Invasive Species Network Coordinator、全国林业有害生物防治技术标准化委员会副主任等。长期从事信息化合物介导的“寄主植物-害虫-伴生真菌-细菌”多物种互作及共生入侵机制研究,代表性成果发表于PNAS、Science Advances、Nature Communications、ISME Journal、Microbiome、Current Biology、New Phytologist等,总计150余篇;先后4次受邀在Annual Review系列杂志和Trends in Parasitology撰写综述论文