(2 福建农林大学资源与环境学院,福州 350002)
(2 College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002, China)
生物电化学系统(bioelectrochemical system, BES)是利用电活性微生物作为生物催化剂,以电极作为电子供体或受体,实现生物氧化(生物阳极)或还原(生物阴极)反应的新兴技术[1]。其本质是电活性微生物与电极直接交换电子(胞外电子传递),实现“电”驱动的生物氧化/还原反应[2, 3]。因此,BES在绿色清洁能源生产、污水处理、环境污染修复、生物传感、生物腐蚀防护与高值化学品生物合成等方面具有重大的应用潜力,已成为环境、能源领域研究的热点与前沿[4, 5]。
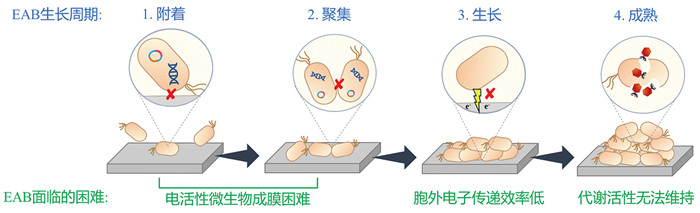
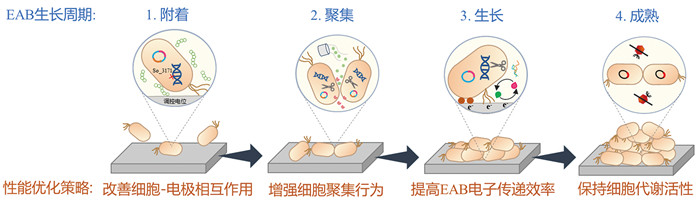
在BES中,电活性微生物通常会聚集生长在电极表面形成电活性生物膜(electroactive biofilm, EAB)[6, 7]。EAB的生命周期分为生长与衰亡,其中生长通常分为附着、聚集、生长与成熟四个阶段[8]。EAB的形成起始于电活性微生物在电极表面的附着。附着是一个复杂的过程,受生长介质、基质和细胞表面不同特性等因素的调节[9]。初始附着之后,电活性微生物在电极表面聚集。聚集方式包括已附着的电活性微生物的二次分裂生长及电解液中更多的电活性微生物加入聚集体。聚集的电活性微生物在自身合成的胞外聚合物(extracellular polymeric substance, EPS) 包裹下形成初始群落,从而建立了EAB的基础。EAB并非均质,膜内存在许多孔洞与缝隙,其间充斥着大量营养物质、细胞代谢产物、细胞色素c、纳米导线、胞外DNA (extracellular DNA, eDNA)、胞外多糖与电子穿梭体等物质[10, 11]。EAB在生长过程中可通过电子穿梭体与电极之间发生间接的电子传递,或通过细胞色素c及纳米导线与电极之间发生直接的电子传递[12]。这支撑了EAB的持续生长、成熟。
高效的BES需要高性能的EAB,然而培育高性能的EAB往往面临以下挑战(图 1):(1)在电活性微生物附着、聚集过程中,微生物与电极、微生物与微生物之间相互作用力弱导致电活性微生物成膜困难;(2)随着EAB不断增长,EAB内部传质阻力变大,代谢底物传质受阻而代谢产物积累,此外,电子传递阻力增大,导致EAB内部及EAB与电极间电子传递效率逐渐降低;(3) EAB成熟期的代谢活性无法维持,迅速进入衰亡阶段。本文围绕优化EAB性能这一目标,针对EAB生长周期四个阶段面临的问题,将介绍促进EAB形成的策略,总结优化EAB电子传递效率的方法,归纳保持EAB代谢活性的途径,将为提升EAB性能提供指导。
|
图 1 EAB生长周期及面临的困难 |
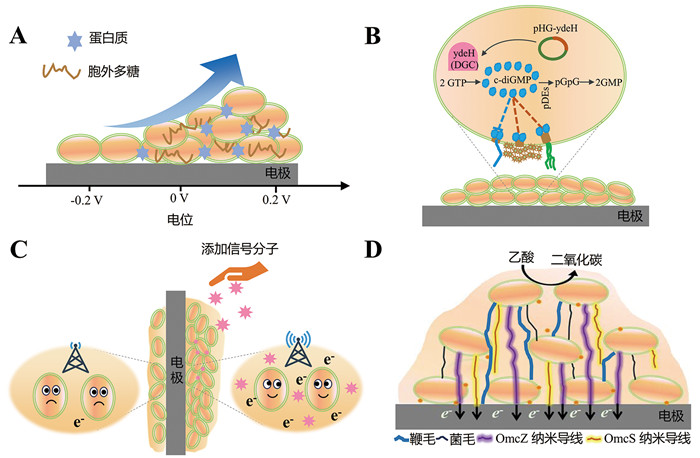
电活性微生物在电极上附着是EAB形成的前提,因此促进电活性微生物与电极之间的相互作用有利于EAB的形成。Yu等[13]发现电场会影响细胞表面的亲水性从而影响细胞在电极上的附着(图 2A)。他们基于XDLVO (Extended Derjaguin, Landau, Verwey, Overbeek) 理论,认为细胞在电极上的附着受“细胞-电极”间理夫绪兹-凡德瓦尔力、静电和路易斯酸碱相互作用影响;电场的引入会改变电活性微生物与电极的表面电荷,从而影响静电相互作用。实验结果显示:在外加电场的存在下,静电力显著影响EAB的附着;其中EAB与电极之间的电位差在±0.6 V范围内,电位差越大,EAB在电极上的附着效果越好。此外,提高电极表面的亲水性也可促进电活性微生物与电极之间的相互作用,加速EAB的形成[14]。Zhang等[15]发现,向阳极室中添加鼠李糖脂可显著促进电活性微生物在电极上的附着,使EAB生物量提高约16%。这是由于鼠李糖脂是一类具有较强界面活性的生物表面活性剂,具有亲水性和疏水性基团,疏水性基团可吸附在疏水阳极表面使阳极界面的特性由疏水性变为亲水性,从而有利于电活性微生物的附着与EAB的形成。c-diGMP是细胞内的次级信号分子,可影响细胞的附着与分离,参与生物膜的形成[16, 17]。Liu等[18]通过在希瓦氏菌胞内表达控制c-diGMP合成的基因ydeH,提高了胞内c-diGMP的浓度,从而显著增强了希瓦氏菌形成EAB的能力(图 2B)。相似地,Hu等[19]成功利用对近红外光响应的基因回路来调节c-diGMP浓度,从而调控EAB的形成。此外,大量的研究证明通过增强胞外多糖、eDNA或结构蛋白等结构因子的合成和分泌,也可显著提高电活性微生物与电极之间的黏附以及EAB的形成能力[20, 21]。
|
A:调控电场;B:改变c-diGMP浓度;C:添加信号分子;D:表达鞭毛与纳米导线 图 2 促进EAB形成的策略 |
电活性微生物在电极上聚集是EAB形成的必然条件,增强细胞聚集行为有助于EAB的形成。群感效应(quorum sensing, QS)是微生物通过感知化学信号分子浓度变化来调控微生物群落行为与功能的现象,通过控制QS可增强电活性微生物聚集,促进生物膜的形成[22]。Chen等[23]发现,添加化学信号分子高丝氨酸内酯(acylhomoserine lactone, AHL)可显著提高混菌EAB中电活性微生物的数量并改善EAB的致密性。此外,Fang等[24]发现添加了AHL后,较难成膜的土壤地杆菌在阴极上形成的EAB生物量明显增加,并且EAB内蛋白质和多糖组分的丰度也显著提高(图 2C)。胞外多糖在电活性微生物聚集形成EAB的过程中也发挥着重要作用。Zhuang等[25]发现,突变编码胞外多糖的基因后硫还原地杆菌细胞将无法聚集,从而无法形成EAB。此外,研究人员还成功通过改变培养条件促进了电活性微生物在电极上的聚集。例如,Li等[26]证明,将阳极电极水平放置能比垂直放置更快形成EAB,并且EAB生物量显著增加。
鞭毛与纳米导线是EAB的重要组成部分。鞭毛可作为EAB骨架支撑EAB的结构,而纳米导线介导了EAB跨膜及与电极界面的电子传递[10, 27]。Ye等[28]的研究表明,Pili与OmcZ纳米导线同样具有很强的生物膜支架功能,可维持EAB的三维结构,使地杆菌形成结构稳定且厚度较高的EAB (图 2D)。基于此,Liu等[27]通过诱导鞭毛的表达,不但提高了地杆菌EAB的稳定性与厚度,而且促进了电活性微生物的附着与聚集。
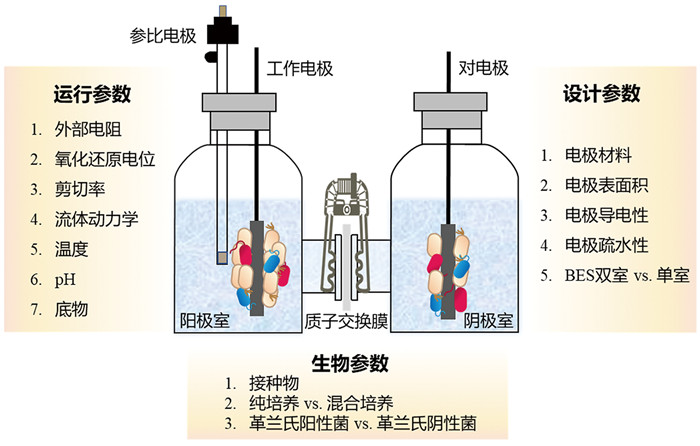
2 优化EAB生存环境及其组成、结构,提高EAB电子传递效率 2.1 优化BES的设计、运行及生物参数EAB是BES的催化核心,其生长受到BES各项参数的影响(图 3)[6]。BES可分为单室BES和双室BES,其中双室BES更为常见。双室BES由阳极室、阴极室、工作电极、对电极、参比电极、质子交换膜、外电路与电活性微生物等构成,通过质子交换膜将阳极室与阴极室隔开。电极材料是影响EAB生长与电子传递的首要因素[29]。据报道,采用具有较高比表面积的碳纤维材料作为阳极电极相对于石墨棒电极能产生更高的EAB生物量,并且电流密度可提高40%;对电极进行纳米材料修饰有助于增加EAB可利用的电极表面积,从而最大限度地增加电极接受来自EAB的电子,提高EAB电子传递效率,提升BES污水处理效率[6, 30]。此外,采用导电性与亲水性较好的电极材料也可以促进EAB的电子传递效率。
|
图 3 优化BES的重要参数 |
BES的运行参数可影响EAB的性能。研究表明,施加低于细胞内阻的外部电阻会促进EAB的生长,并使BES的电流密度最大化[31]。电极氧化还原电位对EAB的影响类似于外部电阻。据报道,混菌EAB在-0.15 V的氧化还原电位下表达大量的EPS与纳米导线结构,从而产生比在+0.37 V时高出17倍的电流密度[32]。不仅如此,采用合适的电极氧化还原电位还能富集出具有高效胞外电子传递能力的电活性微生物[33]。调控电解液剪切率可通过影响EAB的生长,提高BES的性能。研究发现,EAB在120 s-1剪切率下能获得比在0.3 s-1剪切率下高出2倍的厚度以及高出5倍的生物量。同时,形成的EAB更致密,细胞与细胞之间接触得更好,从而具有更高的电子传递速率[34]。因此,研究者可在间歇、强制流动条件下富集EAB,以去除浮游微生物和松散附着的EAB细胞,提高EAB的功率密度[35]。此外,适宜的温度、pH值、底物有助于电活性微生物的富集与EAB的生长,提升BES污水处理效率。
EAB中存在的微生物种类取决于接种物的来源,而BES的设计与运行参数最终决定了EAB中微生物的组成。通常在严格的厌氧条件下,以乙酸作为电子供体的BES中,会富集大量的地杆菌属[36]。该属微生物具有高效的胞外电子传递能力,能够形成产电能力很强的EAB,使得BES的运行性能得到大幅度的提升。通常革兰氏阴性细菌比革兰氏阳性细菌产生的电流更高,而两者的混合物往往比单个物种产生的电流密度更高。这暗示微生物之间的相互作用可提高EAB的性能[6]。此外,混菌形成的EAB通常比纯菌EAB具有更高的稳定性。因此,由铜绿假单胞菌、中间苍白杆菌、冷海希瓦氏菌与弗氏柠檬酸杆菌等微生物形成的混菌EAB,被广泛运用于生物传感器制备,用于检测污水中的BOD (biochemical oxygen demand) 等[37]。
2.2 基于合成生物学改造EAB一般认为EAB电子传递分为三步:细胞内电子传递到胞外、电子跨EAB传递、“EAB-电极”界面传递。自然生长的EAB往往只具备较低的电子传递效率,而合理地利用合成生物学(synthetic biology)技术可显著增强EAB的电子传递能力(图 4)。EAB中的EPS (包括胞外多糖、胞外蛋白和eDNA)含量大约占EAB总有机物的90%,是EAB的主要组成部分。研究者通过合成生物学增加EAB中的胞外多糖与eDNA等组分,成功提高了电子跨EAB传递效率与EAB结构的稳定性[38, 39]。优化EAB中的结构组分亦可提高电子跨EAB传递效率并增加EAB厚度[40]。Wang等[41]利用基因工程技术对硫还原地杆菌EAB的胞外基质中的菌毛进行工程化处理。他们将硫还原地杆菌的菌毛标记上多聚组氨酸,然后通过加入镍(Ⅱ)诱导“组氨酸-镍”配位。该处理导致细胞的菌毛相互缠绕,从而提高了EAB的厚度,增加了EAB微环境中电活性位点的浓度,并降低了EAB内的电阻,最终显著提高了EAB的电子传递效率。
|
图 4 基于合成生物学的EAB性能提升 |
细胞色素构成电活性微生物胞外电子传递通路并直接作用于EAB与电极之间的电子传递,提高其含量有助于提升EAB的电子传递效率。Su等[42]通过增加大肠杆菌中跨膜电子传递细胞色素蛋白复合体(CymA-MtrABC)表达后,大肠杆菌的产电量增加了77%。Orianna等[43]发现在希瓦氏菌中过表达外膜MtrC细胞色素时,可显著提高EAB产生的电流。类似地,Vellingiri等[44]通过在希瓦氏菌中过表达内膜CymA细胞色素亦显著提高了该菌的产电性能。微生物纳米导线(导电菌毛和细胞色素纳米线)是电活性微生物表面具有导电性的纤维状表面附属结构,其可长距离传递电子至距离细胞较远的电极,从而提高EAB的电子传递效率[45]。在无电活性的大肠杆菌或在电活性较低的铜绿假单胞菌中表达硫还原地杆菌的导电菌毛,被认为可显著提高这两种微生物在BES中的产电性能[46, 47]。不过由于异源蛋白在宿主细胞中表达与稳定性差异,且纳米导线的组装机制复杂,目前通过合成生物学在不同的EAB中大量表达特定的纳米导线仍存在一定困难。
电子穿梭体也是介导EAB电子传递的重要途径。通过合成生物学技术增加电子穿梭体在电活性微生物体内的合成和分泌可提高EAB与电极之间的电子传递效率[48]。改变细胞膜通透性也可提高电子穿梭体介导的细胞胞外电子传递效率。不过细胞膜作为保护细胞免受细胞外环境影响的屏障,其通透性的改变可能会给细胞带来一定伤害[49]。此外,通过合成生物学还可从QS、细胞次生信使系统、全局调控子(global regulator)层面对EAB进行多维调控,以促进电子传递过程[50-53]。
2.3 基于合成微生物生态学改造EAB电活性微生物一般只能利用简单的底物,这严重限制了EAB的适用性与灵活性。通过合成生物学技术已成功改造了大肠杆菌的代谢通路,扩大了大肠杆菌可利用的底物谱。但该技术比较复杂、耗时费力,并且具有一定的物种特异性,并不适用于大多数微生物[54]。合成微生物生态学(synthetic microbial ecology)通过对生态系统进行合理的设计,把两个或两个以上的微生物组合在一个特征明确并受控的环境中,利用微生物间的代谢过程、生态过程、相互作用,形成具有所需特征和功能的微生物相互作用与群落[55]。近年来,研究人员基于合成微生物生态学对EAB中的微生物群落进行合理的设计,构建了合成微生物群落(synthetic microbial consortium),为扩大EAB的底物利用范围提供了可能[56]。Rabaey团队[57, 58]与Lin等[59]将非电活性微生物与电活性微生物进行共培养,利用非电活性微生物来代谢复杂的底物以产生简单代谢产物为电活性微生物提供底物,电活性微生物氧化底物后将电子直接传递给电极,从而形成具有高效产电能力的EAB[57-59]。Liu等[60]将电活性希瓦氏菌与2种发酵菌(大肠杆菌与枯草芽孢杆菌)设计为合成微生物群落,在该群落中大肠杆菌分解葡萄糖产生乳酸为希瓦氏菌提供碳源,枯草芽孢杆菌则产生核黄素为希瓦氏菌提供电子穿梭体,而希瓦氏菌一方面作为产电菌产生电能,另一方面将乳酸氧化为乙酸盐,为大肠杆菌与枯草芽孢杆菌提供简单的碳源,三种菌在该体系中通过“分工”合作为彼此扩大了可利用的底物范围,实现了糖源高效稳定发电(图 5A)。Prokhorova等[61]则将三种电活性菌即希瓦氏菌、硫还原地杆菌与金属还原地杆菌进行合成微生物群落设计,通过希瓦氏菌氧化乳酸为硫还原地杆菌提供乙酸盐与氢气,为金属还原地杆菌提供丙酸盐,从而扩大两种地杆菌可利用的底物范围,使地杆菌高效地发挥胞外电子传递功能。该混合微生物群落不但能在阳极电极上形成稳定的EAB,高效地降解有机污染物,而且对阳极氧化还原电势的改变具有明显高于单菌的弹性。
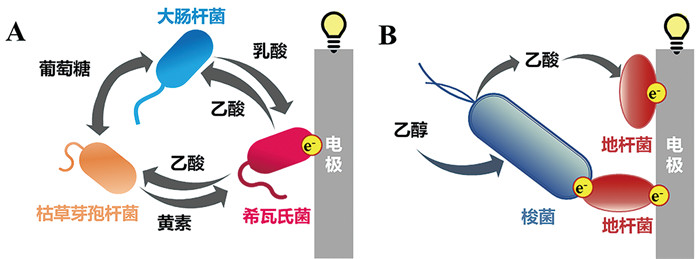
|
A:枯草芽孢杆菌、大肠杆菌与希瓦氏菌互营;B:梭菌与地杆菌互营 图 5 利用合成微生物群落技术构建EAB |
鉴于目前电活性微生物种类较少,研究人员也尝试利用合成生物学技术对非电活性微生物进行改造,使其具备胞外电子传递通路,但改造成效甚微,仅在大肠杆菌中取得一定进展[50]。最近研究发现,基于合成微生物生态学还可以使非电活性微生物获得胞外电子传递能力。Liu等[62]以合成微生物生态学为理念,将非电活性梭菌与具有高效胞外电子传递能力的地杆菌共培养,发现梭菌与地杆菌之间发生细胞间融合,梭菌胞内电子传递途径与地杆菌的胞外电子传递通路整合以实现梭菌胞外电子传递,而地杆菌则可利用梭菌代谢产生的电子与乙酸进行胞外呼吸,最终形成基于种间互营的高效的EAB (图 5B)。该研究为实现非电活性微生物胞外电子传递提供了新方法,也为理解微生物种间的能量耦合以及微生物共生提供了新的视角。
目前绝大多数基于合成微生物生态学设计的合成微生物群落都建立在互营型相互作用的基础上,但是在可培养的微生物物种之间,竞争往往才是占主导的微生物相互作用[63]。自然选择学说指出物竞天择,适者生存。竞争往往会导致选择性变异,即产生更适合在生态位中生存的变异物种[64]。若能将竞争关系加以利用,则可能与互营型合成微生物群落一样为BES带来事半功倍的效果,助力BES的发展。
3 诱导细胞更新、抑制细胞衰亡,保持EAB代谢活性 3.1 定期清除衰亡EAB在BES运行过程中,成熟的EAB代谢活性始终无法保持在较高的水平,EAB中的细胞会随着时间不断衰亡,导致BES的运行性能持续降低。通过定期清除衰亡的EAB,可以诱导EAB再生[65-67]。例如,通过对电解液进行搅拌、调控电解液流速、机械清洗的方式可为EAB提供一个搅动的环境从而清除衰亡EAB[65];此外,通过酶处理、氧化反应、添加化学品(如抗生素)等方式也可导致EAB的剥落[66]。然而,这些方法可能导致整个EAB脱落,也可能破坏细胞结构或对细胞产生毒害,从而导致EAB性能不可逆地降低。Islam等[65]发现,在短时间内(30 min)采用低频超声(20 kHz)可成功剥落表层EAB,并且不会损害细胞(图 6A)。需要注意的是,虽然该超声波处理会同时去除活细胞和死细胞,但当部分EAB脱落后,EAB中的电活性微生物能够更有效地获取营养物质,从而形成高代谢活性的EAB。Islam等[66]还发现,采用中等力度的剪切力(9.34 mPa)也可在短时间内有效清除外层EAB,起到保持EAB代谢活性的效果,并且这种方法可适用于大型BES中大规模衰亡的EAB (图 6A)。此外,Zhang等[67]发现,通过对发生衰亡的EAB进行短暂地极化处理(断开阳极与阴极之间的连接)也可清除部分EAB,并且他们观察到处理后的EAB可快速生长,展现出更高的电化学活性(图 6A)。
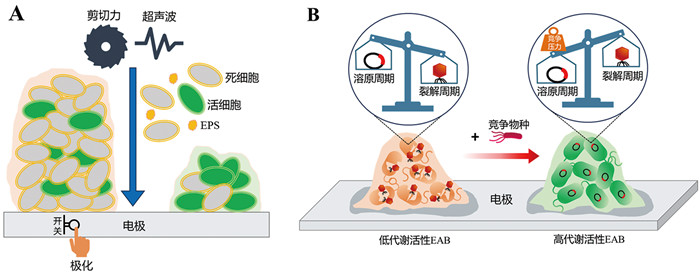
|
A:利用剪切力、超声波或极化处理的方式清除衰亡的EAB,以诱导EAB再生;B:利用“生态竞争”疗法抑制原噬菌体激活,从而复苏衰亡的EAB 图 6 保持EAB代谢活性的策略 |
一般来说,引起EAB衰亡的因素有两种:代谢底物/产物在EAB内部扩散受限或跨EAB氧化还原梯度不足以维持电子传递[68-72]。随着EAB不断生长,由于扩散限制,电解液中底物很难扩散进入EAB内部,并且微生物代谢产生的副产物也无法扩散出EAB。这导致EAB内部微生物代谢受损,从而引起内层EAB的衰亡。此外,EAB会形成一个跨膜氧化还原梯度,即靠近电极的EAB处于较高电势环境,而远离电极的EAB处于低电势环境。随着EAB逐渐增厚,外层电势将无法支撑微生物的胞外电子传递,从而导致外层EAB逐渐衰亡。因此,EAB的衰亡呈现显著的分层现象(“内死外活”和“外活内死”)。然而在多数情况下,成熟EAB中死亡细胞被发现贯穿于整个EAB,甚至在EAB生长初期其内部就出现大量死亡细胞[73-76]。研究发现这种衰亡形式是由电活性微生物自身携带的原噬菌体被激活所引起[77]。为消除噬菌体对EAB代谢活性的影响,Liu等[77]通过基因敲除的手段构建了缺失原噬菌体的硫还原地杆菌突变株,成功获得了长期运行下不衰亡的EAB。考虑到基因敲除手段的复杂性与特异性,探寻简单快速且普适性高的抑制原噬菌体激活的方法对维持EAB的活性显得尤为重要。研究表明,宿主细胞的状态会影响原噬菌体的激活。当微生物在最佳条件下生长时,原噬菌体会激活裂解性周期[78-80];相反,当宿主处于压力条件下时,例如温度、pH或渗透压改变,原噬菌体将主要停留在溶原性生命周期中[81-84]。鉴于此,Ye等[85]以合成微生物生态学为理念,创新性地向衰亡的硫还原地杆菌EAB中引入竞争性物种铀还原地杆菌,抑制了硫还原地杆菌的原噬菌体激活,恢复了衰亡的硫还原地杆菌EAB活性(图 6B)。该“生态竞争”疗法突出了种间竞争在维持EAB稳定中的重要作用,为复苏衰亡的EAB提供了新策略。相比于利用超声波与剪切力等外力进行定期清除衰亡的EAB,Ye等提出的“生态竞争”疗法可操作性更强、耗能更低并且省时,在一定程度上更易于推广实施。
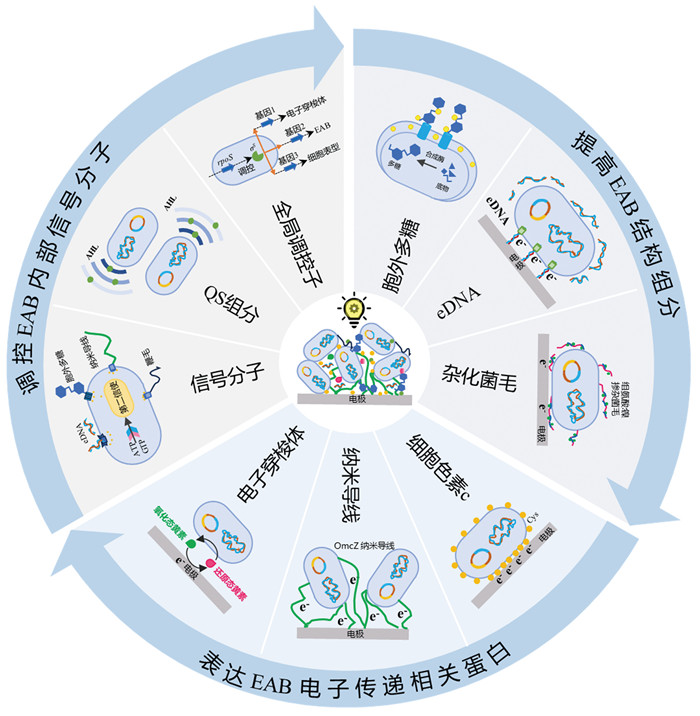
4 结语与展望目前,BES研究已取得了一定的进展,但还未达到规模化、产业化发展的标准。EAB是BES的核心,本文针对EAB生长周期中存在的困难与挑战详细综述了相应的解决策略(图 7)以提升EAB性能:通过影响电场与次级信号分子等来增强微生物与电极之间的相互作用以促进电活性微生物在电极上的附着;通过增加化学信号分子与胞外多糖等来促进电活性微生物在电极上的聚集;从BES系统构型设计、运行参数优化、接种微生物选择及EAB结构与组分优化等角度提升生长期EAB的胞外电子传递效率;定期清除衰亡EAB或引入“生态竞争”以保持成熟期EAB的代谢活性。
|
图 7 基于EAB生长周期的EAB性能提升 |
EAB电子传递效率低是提升EAB性能面临的关键与核心问题。对于EAB电子传递机制的研究目前仅限于少数模式微生物。即便如此,我们对电子传递过程的认识还只局限于少数细胞色素c,对于EAB中电子传递尚处于空白。这直接导致基于合成生物学的微生物“电能化”改造目标分子单一,改造后细胞电活性不高。电活性微生物的分离、鉴定、电子传递表征,是挖掘新型电子传递途径,丰富电子传递“元件”库的必要条件。同时,EAB电子传递是“胞内→胞外”,“生物膜内→膜外”,“有机→无机”,涉及多物质、多体系、多界面的电子传递过程。对于该系统的效能的优化、提高,有必要融合材料学、电化学、生物信息学、合成生物学、合成微生物生态学与分子生物学等学科领域的知识,通过跨学科的交叉突破电子传递的瓶颈,最终推动BES从实验室向规模化与产业化发展。
| [1] |
Recio-Garrido D, Perrier M, Tartakovsky B. Modeling, optimization and control of bioelectrochemical systems. Chem Eng J, 2016, 289: 180-90. DOI:10.1016/j.cej.2015.11.112 |
| [2] |
Logan BE, Rossi R, Ragab A, et al. Electroactive microorganisms in bioelectrochemical systems. Nat Rev Microbiol, 2019, 17: 307-19. DOI:10.1038/s41579-019-0173-x |
| [3] |
Paquete CM, Rosenbaum MA, Ba?eras L, et al. Let's chat: communication between electroactive microorganisms. Bioresour Technol, 2022, 347: 126705. DOI:10.1016/j.biortech.2022.126705 |
| [4] |
Pant D, Singh A, Van Bogaert G, et al. Bioelectrochemical systems (BES) for sustainable energy production and product recovery from organic wastes and industrial wastewaters. RSC Adv, 2012, 2: 1248-63. DOI:10.1039/C1RA00839K |
| [5] |
Tang Y, Deng D, Zhou L, et al. Analysis of electricity generation and community of electroactive biofilms enriched from various wastewater treatment stages. J Electroanal Chem, 2017, 803: 72-80. DOI:10.1016/j.jelechem.2017.09.004 |
| [6] |
Borole AP, Reguera G, Ringeisen B, et al. Electroactive biofilms: current status and future research needs. Energy Environ Sci, 2011, 4: 4813-34. DOI:10.1039/c1ee02511b |
| [7] |
Ter Heijne A, Pereira MA, Pereira J, et al. Electron storage in electroactive biofilms. Trends Biotechnol, 2021, 39: 34-42. DOI:10.1016/j.tibtech.2020.06.006 |
| [8] |
Sharma S, Mohler J, Mahajan SD, et al. Microbial biofilm: a review on formation, infection, antibiotic resistance, control measures, and innovative treatment. Microorganisms, 2023, 11: 1614. DOI:10.3390/microorganisms11061614 |
| [9] |
Donlan RMJ. Biofilms: microbial life on surfaces. Emerg Infect Dis, 2002, 8: 881. DOI:10.3201/eid0809.020063 |
| [10] |
Conners EM, Rengasamy K, Bose A. Electroactive biofilms: how microbial electron transfer enables bioelectrochemical applications. J Ind Microbiol Biotechnol, 2022, 49: kuac012. DOI:10.1093/jimb/kuac012 |
| [11] |
Kumar R, Singh L, Zularisam AW. Exoelectrogens: recent advances in molecular drivers involved in extracellular electron transfer and strategies used to improve it for microbial fuel cell applications. Renew Sust Energ Rev, 2016, 56: 1322-36. DOI:10.1016/j.rser.2015.12.029 |
| [12] |
Hu Y, Han X, Shi L, et al. Electrochemically active biofilm-enabled biosensors: current status and opportunities for biofilm engineering. Electrochim Acta, 2022, 428: 140917. DOI:10.1016/j.electacta.2022.140917 |
| [13] |
Yu M, Guo W, Liang Y, et al. Towards rapid formation of electroactive biofilm: insights from thermodynamics and electric field manipulation. Water Res, 2024, 261: 121992. DOI:10.1016/j.watres.2024.121992 |
| [14] |
Liang Y, Feng H, Shen D, et al. Enhancement of anodic biofilm formation and current output in microbial fuel cells by composite modification of stainless steel electrodes. J Pow Sour, 2017, 342: 98-104. DOI:10.1016/j.jpowsour.2016.12.020 |
| [15] |
Zhang Y, Jiang J, Zhao Q, et al. Accelerating anodic biofilms formation and electron transfer in microbial fuel cells: role of anionic biosurfactants and mechanism. Bioelectrochemistry, 2017, 117: 48-56. DOI:10.1016/j.bioelechem.2017.06.002 |
| [16] |
Baraquet C, Harwood CS. Cyclic diguanosine monophosphate represses bacterial flagella synthesis by interacting with the Walker A motif of the enhancer-binding protein FleQ. Proc Natl Acad Sci USA, 2013, 110: 18478-83. DOI:10.1073/pnas.1318972110 |
| [17] |
Thormann KM, Duttler S, Saville RM, et al. Control of formation and cellular detachment from Shewanella oneidensis MR-1 biofilms by cyclic di-GMP. J Bacteriol, 2006, 188: 2681-91. DOI:10.1128/JB.188.7.2681-2691.2006 |
| [18] |
Liu T, Yu YY, Deng XP, et al. Enhanced Shewanella biofilm promotes bioelectricity generation. Biotechnol Bioeng, 2015, 112: 2051-9. DOI:10.1002/bit.25624 |
| [19] |
Hu Y, Liu X, Ren ATM, et al. Optogenetic modulation of a catalytic biofilm for the biotransformation of indole into tryptophan. ChemSusChem, 2019, 12: 5142-8. DOI:10.1002/cssc.201902413 |
| [20] |
Yu R, Hou C, Liu A, et al. Extracellular DNA enhances the adsorption of Sulfobacillus thermosulfidooxidans strain ST on chalcopyrite surface. Hydrometallurgy, 2018, 176: 97-103. DOI:10.1016/j.hydromet.2018.01.018 |
| [21] |
Yu S, Wei Q, Zhao T, et al. A survival strategy for Pseudomonas aeruginosa that uses exopolysaccharides to sequester and store iron to stimulate Psl-dependent biofilm formation. Appl Environ Microbiol, 2016, 82: 6403-13. DOI:10.1128/AEM.01307-16 |
| [22] |
Whiteley M, Diggle SP, Greenberg EP. Progress in and promise of bacterial quorum sensing research. Nature, 2017, 551: 313-20. DOI:10.1038/nature24624 |
| [23] |
Chen S, Jing X, Tang J, et al. Quorum sensing signals enhance the electrochemical activity and energy recovery of mixed-culture electroactive biofilms. Biosens Bioelectron, 2017, 97: 369-76. DOI:10.1016/j.bios.2017.06.024 |
| [24] |
Fang Y, Deng C, Chen J, et al. Accelerating the start-up of the cathodic biofilm by adding acyl-homoserine lactone signaling molecules. Bioresour Technol, 2018, 266: 548-54. DOI:10.1016/j.biortech.2018.07.095 |
| [25] |
Zhuang Z, Yang G, Mai Q, et al. Physiological potential of extracellular polysaccharide in promoting Geobacter biofilm formation and extracellular electron transfer. Sci Total Environ, 2020, 741: 140365. DOI:10.1016/j.scitotenv.2020.140365 |
| [26] |
Li T, Zhou L, Qian Y, et al. Gravity settling of planktonic bacteria to anodes enhances current production of microbial fuel cells. Ap Energy, 2017, 198: 261-6. DOI:10.1016/j.apenergy.2017.04.078 |
| [27] |
Liu X, Zhuo S, Jing X, et al. Flagella act as Geobacter biofilm scaffolds to stabilize biofilm and facilitate extracellular electron transfer. Biosens Bioelectron, 2019, 146: 111748. DOI:10.1016/j.bios.2019.111748 |
| [28] |
Ye Y, Liu X, Nealson KH, et al. Dissecting the structural and conductive functions of nanowires in Geobacter sulfurreducens electroactive biofilms. mBio, 2022, 13: e03822-21. |
| [29] |
Liu Y, Harnisch F, Fricke K, et al. The study of electrochemically active microbial biofilms on different carbon-based anode materials in microbial fuel cells. Biosens Bioelectron, 2010, 25: 2167-71. DOI:10.1016/j.bios.2010.01.016 |
| [30] |
Mahmoud RH, Samhan FA, Ibrahim MK, et al. Formation of electroactive biofilms derived by nanostructured anodes surfaces. Bioproc Biosyst Eng, 2021, 44: 759-68. DOI:10.1007/s00449-020-02485-4 |
| [31] |
Aelterman P, Versichele M, Marzorati M, et al. Loading rate and external resistance control the electricity generation of microbial fuel cells with different three-dimensional anodes. Bioresour Technol, 2008, 99: 8895-902. DOI:10.1016/j.biortech.2008.04.061 |
| [32] |
Torres CI, Krajmalnik-Brown R, Parameswaran P, et al. Selecting anode-respiring bacteria based on anode potential: phylogenetic, electrochemical, and microscopic characterization. Environ Sci Technol, 2009, 43: 9519-24. DOI:10.1021/es902165y |
| [33] |
Mao L, Verwoerd WS. Selection of organisms for systems biology study of microbial electricity generation: a review. Int J Energy Envir E, 2013, 4: 17. DOI:10.1186/2251-6832-4-17 |
| [34] |
Pham HT, Boon N, Aelterman P, et al. High shear enrichment improves the performance of the anodophilic microbial consortium in a microbial fuel cell. Microb Biotechnol, 2008, 1: 487-96. DOI:10.1111/j.1751-7915.2008.00049.x |
| [35] |
Borole AP, Hamilton CY, Vishnivetskaya T, et al. Improving power production in acetate-fed microbial fuel cells via enrichment of exoelectrogenic organisms in flow-through systems. Biochem Eng J, 2009, 48: 71-80. DOI:10.1016/j.bej.2009.08.008 |
| [36] |
Lee J, Phung NT, Chang IS, et al. Use of acetate for enrichment of electrochemically active microorganisms and their 16S rDNA analyses. FEMS Microbiol Lett, 2003, 223: 185-91. DOI:10.1016/S0378-1097(03)00356-2 |
| [37] |
Salvian A, Farkas D, Ramirez-Moreno M, et al. Resilience of anodic biofilm in microbial fuel cell biosensor for BOD monitoring of urban wastewater. NPJ Clean Water, 2024, 7: 53. DOI:10.1038/s41545-024-00350-5 |
| [38] |
Xiao Y, Zhao F. Electrochemical roles of extracellular polymeric substances in biofilms. Curr Opin Electroche, 2017, 4: 206-11. DOI:10.1016/j.coelec.2017.09.016 |
| [39] |
Xiao Y, Zhang E, Zhang J, et al. Extracellular polymeric substances are transient media for microbial extracellular electron transfer. Sci Adv, 2017, 3: e1700623. DOI:10.1126/sciadv.1700623 |
| [40] |
Tang TC, An B, Huang Y, et al. Materials design by synthetic biology. Nat Rev Mater, 2020, 6: 332-50. DOI:10.1038/s41578-020-00265-w |
| [41] |
Wang H, Jing X, Feng K, et al. In situ tuning the structure of Geobacter biofilm for bioelectricity enhancement. Environ Sci Technol Lett, 2024, 11: 106-13. DOI:10.1021/acs.estlett.3c00783 |
| [42] |
Su L, Fukushima T, Prior A, et al. Modifying cytochrome c maturation can increase the bioelectronic performance of engineered Escherichia coli. ACS Synth Biol, 2020, 9: 115-24. DOI:10.1021/acssynbio.9b00379 |
| [43] |
Bretschger O, Obraztsova A, Sturm CA, et al. Current production and metal oxide reduction by Shewanella oneidensis MR-1 wild type and mutants. Appl Environ Microbiol, 2007, 73: 7003-12. DOI:10.1128/AEM.01087-07 |
| [44] |
Vellingiri A, Song YE, Munussami G, et al. Overexpression of c-type cytochrome, CymA in Shewanella oneidensis MR-1 for enhanced bioelectricity generation and cell growth in a microbial fuel cell. J Chem Technol Biotechnol, 2018, 94: 2115-22. |
| [45] |
Yin Y, Shungui Z, Xing L. Structure and function of microbial nanowires: controversy and progress. Acta Pedol Sin, 2011, 61: 297-307. |
| [46] |
Lovley DR, Holmes DE. Electromicrobiology: the ecophysiology of phylogenetically diverse electroactive microorganisms. Nat Rev Microbiol, 2022, 20: 5-19. DOI:10.1038/s41579-021-00597-6 |
| [47] |
Lovley DR, Holmes DE. Protein nanowires: the electrification of the microbial world and maybe our own. J Bacteriol, 2020, 202: e00331-20. |
| [48] |
Liu X, Shi L, Gu JD. Microbial electrocatalysis: redox mediators responsible for extracellular electron transfer. Biotechnol Adv, 2018, 36: 1815-27. DOI:10.1016/j.biotechadv.2018.07.001 |
| [49] |
Yong XY, Shi DY, Chen YL, et al. Enhancement of bioelectricity generation by manipulation of the electron shuttles synthesis pathway in microbial fuel cells. Bioresour Technol, 2014, 152: 220-4. DOI:10.1016/j.biortech.2013.10.086 |
| [50] |
You Z, Li J, Wang Y, et al. Advances in mechanisms and engineering of electroactive biofilms. Biotechnol Adv, 2023, 66: 108170. DOI:10.1016/j.biotechadv.2023.108170 |
| [51] |
Yong YC, Yu YY, Li CM, et al. Bioelectricity enhancement via overexpression of quorum sensing system in Pseudomonas aeruginosa-inoculated microbial fuel cells. Biosens Bioelectron, 2011, 30: 87-92. DOI:10.1016/j.bios.2011.08.032 |
| [52] |
Bareia T, Pollak S, Eldar A. Self-sensing in Bacillus subtilis quorum-sensing systems. Nat Microbiol, 2018, 3: 83-9. |
| [53] |
Potvin E, Sanschagrin F, Levesque RC. Sigma factors in Pseudomonas aeruginosa. FEMS Microbiol Rev, 2008, 32: 38-55. DOI:10.1111/j.1574-6976.2007.00092.x |
| [54] |
Wenk S, Claassens NJ, Lindner SN. Synthetic metabolism approaches: a valuable resource for systems biology. Curr Opin Syst Biol, 2022, 30: 100417. DOI:10.1016/j.coisb.2022.100417 |
| [55] |
Johns NI, Blazejewski T, Gomes AL, et al. Principles for designing synthetic microbial communities. Curr Opin Microbiol, 2016, 31: 146-53. DOI:10.1016/j.mib.2016.03.010 |
| [56] |
De Roy K, Marzorati M, Van den Abbeele P, et al. Synthetic microbial ecosystems: an exciting tool to understand and apply microbial communities. Environ Microbiol, 2013, 16: 1472-81. |
| [57] |
Prevoteau A, Rabaey K. Electroactive biofilms for sensing: reflections and perspectives. ACS Sens, 2017, 2: 1072-85. DOI:10.1021/acssensors.7b00418 |
| [58] |
Rabaey K, Rodríguez J, Blackall LL, et al. Microbial ecology meets electrochemistry: electricity-driven and driving communities. ISME J, 2007, 1: 9-18. DOI:10.1038/ismej.2007.4 |
| [59] |
Lin T, Bai X, Hu Y, et al. Synthetic Saccharomyces cerevisiae-Shewanella oneidensis consortium enables glucose-fed high-performance microbial fuel cell. AIChE, 2016, 63: 1830-8. |
| [60] |
Liu Y, Ding MZ, Ling W, et al. A three-species microbial consortium for power generation. Energy Environ Sci, 2017, 10: 1600-9. DOI:10.1039/C6EE03705D |
| [61] |
Prokhorova A, Sturm-Richter K, Doetsch A, et al. Resilience, dynamics, and interactions within a model multispecies exoelectrogenic-biofilm community. Appl Environ Microbiol, 2017, 83: 03033-16. |
| [62] |
Liu X, Ye Y, Yang N, et al. Nonelectroactive Clostridium obtains extracellular electron transfer-capability after forming chimera with Geobacter. ISME Commun, 2024, 4: ycae058. DOI:10.1093/ismeco/ycae058 |
| [63] |
Foster KR, Bell T. Competition, not cooperation, dominates interactions among culturable microbial species. Curr Biol, 2012, 22: 1845-50. DOI:10.1016/j.cub.2012.08.005 |
| [64] |
Ghoul M, Mitri S. The ecology and evolution of microbial competition. Trends Microbiol, 2016, 24: 833-45. DOI:10.1016/j.tim.2016.06.011 |
| [65] |
Islam MA, Woon CW, Ethiraj B, et al. Ultrasound driven biofilm removal for stable power generation in microbial fuel cell. Energy Fuels, 2016, 31: 968-76. |
| [66] |
Islam MA, Ehiraj B, Cheng CK, et al. Biofilm re-vitalization using hydrodynamic shear stress for stable power generation in microbial fuel cell. J Electroanal Chem, 2019, 844: 14-22. DOI:10.1016/j.jelechem.2019.05.013 |
| [67] |
Zhang X, Luther AK, Rabaey K, et al. Periodic polarization duty cycle tunes performance and adhesion of anodic electroactive biofilms. Bioelectrochemistry, 2024, 155: 108581. DOI:10.1016/j.bioelechem.2023.108581 |
| [68] |
Bond DR, Strycharz-Glaven SM, Tender LM, et al. On electron transport through Geobacter biofilms. ChemSusChem, 2012, 5: 1099-105. DOI:10.1002/cssc.201100748 |
| [69] |
Torres CI, Kato Marcus A, Rittmann BE. Proton transport inside the biofilm limits electrical current generation by anode-respiring bacteria. Biotechnol Bioeng, 2008, 100: 872-81. DOI:10.1002/bit.21821 |
| [70] |
Babauta JT, Nguyen HD, Harrington TD, et al. pH, redox potential and local biofilm potential microenvironments within Geobacter sulfurreducens biofilms and their roles in electron transfer. Biotechnol Bioeng, 2012, 109: 2651-62. DOI:10.1002/bit.24538 |
| [71] |
Franks AE, Nevin KP, Jia H, et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energ Environ Sci, 2009, 2: 113-9. DOI:10.1039/B816445B |
| [72] |
Chadwick GL, Jimenez Otero F, Gralnick JA, et al. NanoSIMS imaging reveals metabolic stratification within current-producing biofilms. Proc Natl Acad Sci U S A, 2019, 116: 20716-24. DOI:10.1073/pnas.1912498116 |
| [73] |
Steidl RJ, Lampa-Pastirk S, Reguera G. Mechanistic stratification in electroactive biofilms of Geobacter sulfurreducens mediated by pilus nanowires. Nat Commun, 2016, 7: 12217. DOI:10.1038/ncomms12217 |
| [74] |
Sun D, Cheng S, Wang A, et al. Temporal-spatial changes in viabilities and electrochemical properties of anode biofilms. Environ Sci Technol, 2015, 49: 5227-35. DOI:10.1021/acs.est.5b00175 |
| [75] |
Reguera G, Nevin KP, Nicoll JS, et al. Biofilm and nanowire production leads to increased current in Geobacter sulfurreducens fuel cells. Appl Environ Microbiol, 2006, 72: 7345-8. DOI:10.1128/AEM.01444-06 |
| [76] |
Franks AE, Glaven RH, Lovley DR. Real-time spatial gene expression analysis within current-producing biofilms. ChemSusChem, 2012, 5: 1092-8. DOI:10.1002/cssc.201100714 |
| [77] |
Liu X, Ye Y, Zhang Z, et al. Prophage induction causes Geobacter electroactive biofilm decay. Environ Sci Technol, 2023, 57: 6196-204. DOI:10.1021/acs.est.2c08443 |
| [78] |
Maurice CF, Bouvier C, de Wit R, et al. Linking the lytic and lysogenic bacteriophage cycles to environmental conditions, host physiology and their variability in coastal lagoons. Environ Microbiol, 2013, 15: 2463-75. DOI:10.1111/1462-2920.12120 |
| [79] |
Maurice CF, Bouvier T, Comte J, et al. Seasonal variations of phage life strategies and bacterial physiological states in three northern temperate lakes. Environ Microbiol, 2010, 12: 628-41. DOI:10.1111/j.1462-2920.2009.02103.x |
| [80] |
Howard-Varona C, Hargreaves KR, Abedon ST, et al. Lysogeny in nature: mechanisms, impact and ecology of temperate phages. ISME J, 2017, 11: 1511-20. DOI:10.1038/ismej.2017.16 |
| [81] |
Abdulrahman Ashy R, Agusti S. Low host abundance and high temperature determine switching from lytic to lysogenic cycles in planktonic microbial communities in a tropical sea (red sea). Viruses, 2020, 12: 761. DOI:10.3390/v12070761 |
| [82] |
Wait DA, Sobsey MD. Comparative survival of enteric viruses and bacteria in Atlantic Ocean seawater. Water Sci Technol, 2001, 43: 139-42. |
| [83] |
Shkoporov AN, Turkington CJ, Hill C. Mutualistic interplay between bacteriophages and bacteria in the human gut. Nat Rev Microbiol, 2022, 20: 737-49. DOI:10.1038/s41579-022-00755-4 |
| [84] |
Danovaro R, Corinaldesi C, Dell'anno A, et al. Marine viruses and global climate change. FEMS Microbiol Rev, 2011, 35: 993-1034. DOI:10.1111/j.1574-6976.2010.00258.x |
| [85] |
Ye Y, Zhang L, Hong X, et al. Interspecies ecological competition rejuvenates decayed Geobacter electroactive biofilm. ISME J, 2024, 18: wrae118. DOI:10.1093/ismejo/wrae118 |
 2025, Vol. 37
2025, Vol. 37 

 刘星,教授,博士生导师,国家优青、福建省杰青获得者。主要从事土壤微生物胞外呼吸机制及其驱动的固碳固氮效应研究。先后主持承担国家自然科学基金面上、青年项目,国家重点研发课题,福建省攻青、面上等项目10余项。获中国土壤学会优秀青年学者、福建省运盛青年科技奖、福建省自然科学一等奖等荣誉。近年来以第一或通讯作者在Science Advances、ISME J、Environmental Science & Technology、mBio、Environmental Microbiology、Molecular Microbiology等学术期刊上发表论文20余篇。以第一发明人获授权专利10件。担任Frontiers in Microbiology副主编,Fundamental Research、mLife期刊青年编委
刘星,教授,博士生导师,国家优青、福建省杰青获得者。主要从事土壤微生物胞外呼吸机制及其驱动的固碳固氮效应研究。先后主持承担国家自然科学基金面上、青年项目,国家重点研发课题,福建省攻青、面上等项目10余项。获中国土壤学会优秀青年学者、福建省运盛青年科技奖、福建省自然科学一等奖等荣誉。近年来以第一或通讯作者在Science Advances、ISME J、Environmental Science & Technology、mBio、Environmental Microbiology、Molecular Microbiology等学术期刊上发表论文20余篇。以第一发明人获授权专利10件。担任Frontiers in Microbiology副主编,Fundamental Research、mLife期刊青年编委