(2 北京大学环境科学与工程学院,北京 100871)
(3 广东省科学院生态环境与土壤研究所,广州 510650)
(4 中国科学院深圳先进技术研究院,深圳 518055)
(2 The Key Laboratory of Water and Sediment Sciences, College of Environmental Sciences and Engineering, Peking University, Beijing 100871, China)
(3 National-Regional Joint Engineering Research Center for Soil Pollution Control and Remediation in South China, Guangdong Key Laboratory of Integrated Agro- environmental Pollution Control and Management, Institute of Eco-environmental and Soil Sciences, Guangdong Academy of Sciences, Guangzhou 510650, China)
(4 CAS Key Laboratory of Quantitative Engineering Biology, Shenzhen Institute of Synthetic Biology, Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, China)
太阳能是地表无处不在的一种重要自然能量形式。在自然界中,无论是土壤还是水环境,都广泛存在能够吸收和转化太阳能的天然矿物。这些矿物通过光催化反应产生光电子能量,为地球上的生命活动提供了重要的能量来源。这些天然矿物光电子能量不仅在陆地生态系统中发挥着重要作用,还在水圈透光层中驱动着一系列重要的生物地球化学过程。以下将分别介绍陆地和水圈透光层中的天然光催化系统。
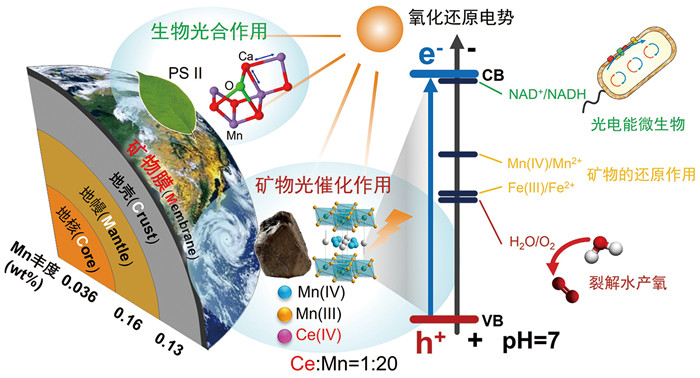
1.1 地表“矿物膜”光电效应与光电能微生物直接暴露于太阳光下的岩石和土壤表面广泛分布着一层厚度约为几十纳米到数百微米的薄“矿物膜”。研究发现“矿物膜”主要由黏土矿物(伊利石、绿泥石等)、纳米颗粒铁锰钛氧化物(赤铁矿、水钠锰矿、锐钛矿等)及被铁锰钛氧化物所圈闭的长石、石英、有机质等物质组成[1-3]。已有研究表明,在我国南方红壤(表层疏松)、西南喀斯特(潮湿)和西北戈壁(干旱)等典型陆地生境中,矿物岩石表面普遍分布着朝太阳光发育的天然铁锰钛氧化物“矿物膜”[4-8]。这些地球陆地表面的“矿物膜”与太阳光有着直接的响应关系。原位测试证实“矿物膜”响应太阳光辐射作用产生原位、灵敏、稳定的光电流与光电转化效应,产生了地表继太阳光子和元素价电子之后第三种能量形式—光电子能量[6]。因此,地表“矿物膜”构成了地球上分布最广的天然“太阳能薄膜”,具有转化利用太阳能的重要功能(图 1,图 2A)。
|
图 1 陆地地表“矿物膜”转化太阳能作用[6] |
|
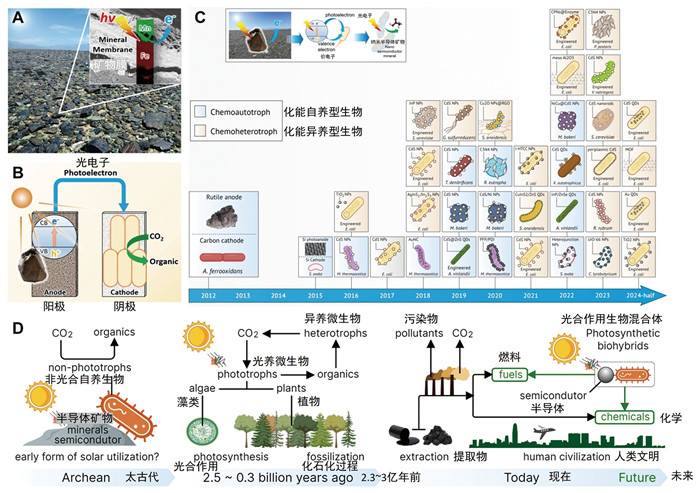
A:地球表面丰富的半导体矿物吸收转化太阳能之后可产生光电子能量;B:在阳光下,阳极表面的矿物产生光电子,然后光电子被传递到阴极,阴极上微生物使用光电子后可固定二氧化碳合成有机质;C:近年来利用光电子进行能量代谢的非光合微生物发生光合作用的代表性研究的时间线;D:研究非光合微生物的光合作用在科学探索与促进人类社会可持续发展方面具有重要意义[14] 图 2 光电能营养类型微生物的系列研究成果总结 |
“矿物膜”受太阳光辐射作用产生的光电子能量,可促进非光合微生物的生长代谢,直接影响生境中微生物群落构成、胞外电子传递过程及效率与代谢活性等,深刻地影响着地球“关键带”一系列重要的地表生物地球化学进程[9-12]。鲁安怀等早在2012年就首次在国际上报道了可见光照射下天然半导体矿物如金红石(TiO2)、针铁矿(Goethite)和闪锌矿(ZnS)产生的光电子能量,能够显著增强氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)和粪产碱杆菌(Alcaligenes faecalis)的生物量,增长幅度可达1~3个数量级[10]。目前光电能微生物能量代谢理论已被国际同行广泛接受,并在国际上产生了重要学术影响。这也是我国科学家提出的原创性成果,在国际微生物相关研究领域起到了重要引领作用[13]。2024年,Wang等[14]对国际上微生物光电能营养新类型自发现以来的十二年陆续取得的系列研究成果进行了系统总结,展示了该研究方向在国际上蓬勃发展的新动向,在理论和应用上均显示出强劲的研究态势(图 2D)。
1.2 海洋透光层天然光催化系统值得注意的是,受太阳光辐射影响的地球表面,除了陆地之外,还有水圈透光层。地球水圈透光层中太阳光-矿物-微生物-有机质构成的天然光催化系统,能够吸收太阳光并利用光能进行化学反应,如光合作用、光催化分解水产生氧气和氢气等。此外,水圈透光层天然光催化系统对驱动关键地球化学元素循环同样产生不可忽视的影响。
海洋透光层是水体中直接接收有效光合辐射的浅海水体部分,其范围的严格定义是从海水表面到有效光合辐射降至表面的1%处[15],我国海洋透光层深度约为5~110 m[16]。在透光层中,有充足的阳光进行光合作用,使得透光层内的生物资源非常丰富。研究发现河口及近海透光层中存在大量陆源与次生悬浮颗粒物(图 3),其中包括多种具有优异光催化活性的半导体矿物,如针铁矿、赤铁矿、磁黄铁矿、水钠锰矿、金红石、锐钛矿和板钛矿等[17-21]。铁锰钛氧化物半导体矿物有独特的光催化活性,其能够捕获和转化太阳光,它们在海洋透光层中大量存在,可产生高活性矿物光电子,促进透光层中微生物生长代谢。因此,太阳能为水圈透光层中的氧化还原化学反应和生命活动提供持续而强大的能量驱动力。
|
图 3 海洋透光层区域示意图[22] |
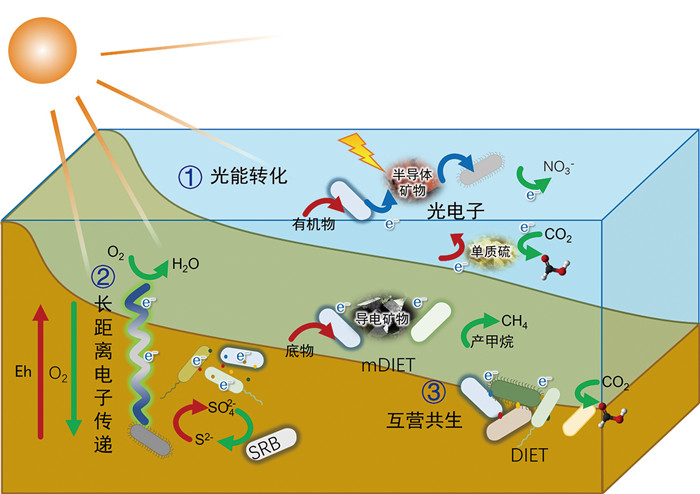
此前,我们研究了海洋透光层中微生物如何通过获取外部能量、提高能量转化效率和种群间共生来适应这种低能量环境,揭示了微生物能量来源和电子传递方式的多样性,并探讨了这些因素如何驱动碳氮硫循环。我们还提出了三种新的能量获取途径:半导体矿物介导的太阳能捕获、种间电子传递和能量代谢新机制、长程电子传递。这些发现有助于构建微生物能量代谢的新模型,深化对海洋透光层微生物能量利用机制的理解,并为保护和利用微生物在碳氮硫循环中的生态功能提供科学依据[22]。
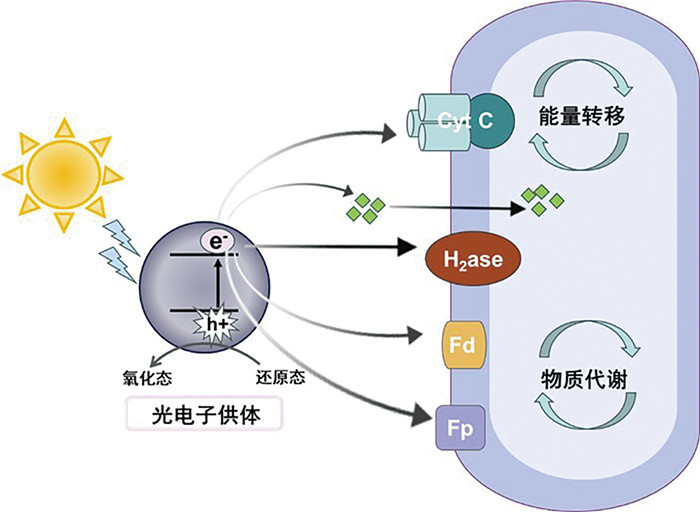
2 半导体矿物—微生物胞外电子传递作用海洋透光层中的半导体矿物,在光照条件下产生活跃的光电子和光空穴,能够与其周围环境中的介质包括各种有机物、变价金属元素和电活性微生物等进行活跃的氧化还原反应,共同影响海洋环境中物质的迁移转化和元素地球循环。此外,半导体矿物产生的还原性光电子还可以作为微生物重要的电子/能量来源,这种代谢方式称为微生物光电能代谢[10]。微生物进行光电能代谢的基础依赖于光电子从胞外向胞内核心代谢过程的传递,目前发现微生物利用光电子的方式包括利用外膜细胞色素等氧化还原活性蛋白或导电菌毛直接摄取光电子以及通过变价金属、有机物、活性氧(reactive oxygen species, ROS)等方式间接摄取光电子[23-26]。
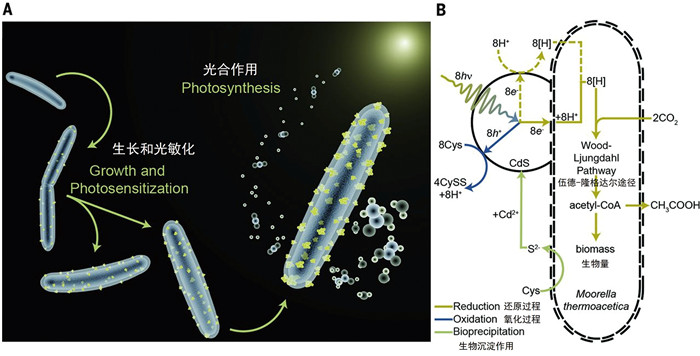
2.1 微生物直接摄取光电子微生物的细胞膜(磷脂双分子层)不具有导电特性,所以微生物需要通过膜表面具有电子传递能力的相关蛋白和分泌氧化还原性的物质介导胞外光电子的摄取(图 4)。通过实验室体系构建人工半导体材料-微生物杂合系统,研究发现自养微生物如热醋穆式菌(Moorella thermoacetica)可以利用半导体矿物硫化镉产生的光电子进行光电能代谢固定二氧化碳产生乙酸[27]。通过瞬态吸收(TA)光谱和时间分辨红外(TRIR)光谱发现了热醋穆式菌在短时间内(3 h)利用膜表面的细胞色素摄取光电子,而在长时间范围内(24 h)可能更多依赖于氢化酶介导产生氢气为胞内代谢提供还原力[23]。Ye等[28]构建了产甲烷菌Methanosarcina barkeri和硫化镉(CdS)的生物杂交体系,发现膜结合蛋白在介导光电子转移中的关键作用,并通过qPCR证明了膜结合的细胞色素c (VhtC和HdrE)以及氢化酶可以介导光电子的跨膜转移和能量转换。多组学技术帮助我们从宏观角度去解析微生物利用光电子的跨膜途径。例如,转录组结合蛋白质组结果显示了M. thermoacetica-CdS杂交体系中CdS产生的光电子,可能通过Fe-S簇以及核黄素转运蛋白运输到微生物胞内[29]。另外,Zhang等[30]使用蛋白质组学和代谢组对M. thermoacetica-CdS在光捕获以及光电子利用中的蛋白质表达和代谢物变化进行了探究,发现黄素蛋白、铁氧化还原蛋白以及NADP脱氢酶在含有CdS的生物体系中显著上调,证明了这些蛋白在光电子转移中的关键作用。除此之外,随着单细胞电化学技术和荧光成像技术的发展,结合分子生物学手段对光电子跨膜转移的关键蛋白的可视化也变成了可能。例如,利用多通道荧光显微镜和光电流成像区分了岩石自养微生物Ralstonia eutropha的不同氢化酶在光电子转移中的作用,并通过改变外加电势限制氢气的产生,证明了氧化还原介质在介导光电子向氢化酶的转移中发挥了重要作用[31]。然而,目前关于微生物光电能代谢的跨膜电子传递机制的研究仍局限于已知的几种通路和蛋白上,半导体矿物光电子较高的能量和较负的氧化还原电势是否具有独特的电子传递途径以及微生物对其的适应性和调节性,及其对微生物胞内代谢的影响仍需要进一步探究。
|
图 4 微生物摄取光电子跨膜途径 |
微生物除了利用跨膜电子途径摄取光电子外,还可以通过氢气、有机物或者变价金属元素间接利用光电子(图 5)。光激发半导体产生的光电子可以还原水中的氢离子,产生的氢气[32]可作为微生物的电子供体。利用半导体电极光电子还原产生的氢气,产甲烷菌M. barkeri将二氧化碳还原为甲烷,并且在一周内都维持>86%的法拉第效率[33]。Liu等[34]在电化学系统中构建了无机-微生物杂交系统,发现该系统可以高效地将二氧化碳和氮气还原为固态生物质,并将其作为菌剂应用于蔬菜的培养。
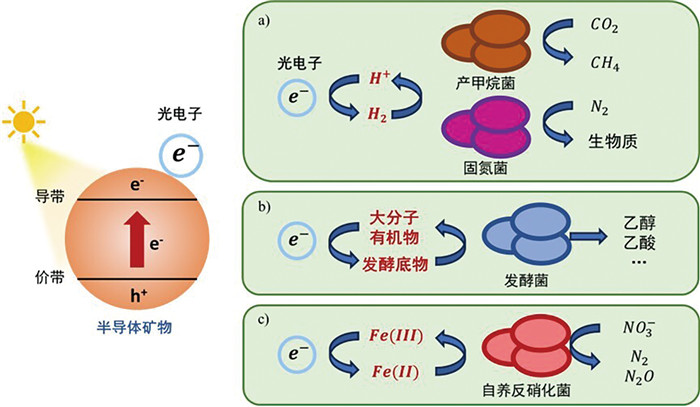
|
(a)微生物通过氢气间接利用光电子;(b)微生物通过有机物间接利用光电子;(c)微生物通过变价金属间接利用光电子 图 5 微生物间接利用光电子的方式 |
微生物也可以通过有机物间接摄取光电子。在光照条件下,半导体矿物(如单质硫[35]、二氧化钛[26]等)光电子可以还原二氧化碳产生有机物,包括甲烷、甲醇、甲醛、甲酸等。这些有机物能够被异养微生物摄取作为碳源和能源。人为添加的有机物也可以作为穿梭体为微生物提供光电子。甲基紫精具有良好的膜通透性和氧化还原活性,因此可以在胞外接受光电子转变为还原态,进一步跨膜进入胞内为希瓦式菌胞内的可逆氧化还原酶提供电子,完成产甲酸、产氢气和产富马酸的生理过程[36]。此外,半导体产生的光电子还可以介导形成ROS,因此半导体常用于促进大分子有机物的降解与矿化,如腐殖酸或木质素。向厌氧消化系统添加N掺杂的C量子点,光照下能够同时促进腐殖酸的降解和甲烷的生成。利用电化学、微生物组学、有机物荧光光谱等手段,研究人员指出,量子点可以通过半导体效应产生的ROS促进腐殖酸的降解,增加了产乙酸菌的发酵底物,导致产甲烷菌的碳源增多,从而提升甲烷的产量[25]。日光下木质素经过半导体矿物生成的降解产物,如己糖和戊糖,可作为发酵底物,在酿酒酵母的作用下转化为乙醇和二氧化碳[37],同时为微生物提供碳源与能量。此外,微生物还能通过变价金属元素间接利用光电子。例如,在日光照射下,土壤中的半导体矿物被光激发诱导生成微生物可利用的电子,增强土壤反硝化作用,相比黑暗提升了2.6~4.7倍。在这一过程中,光电子还原产生的Fe(Ⅱ)被自养反硝化菌利用,贡献了30.9%的电子来源[38]。
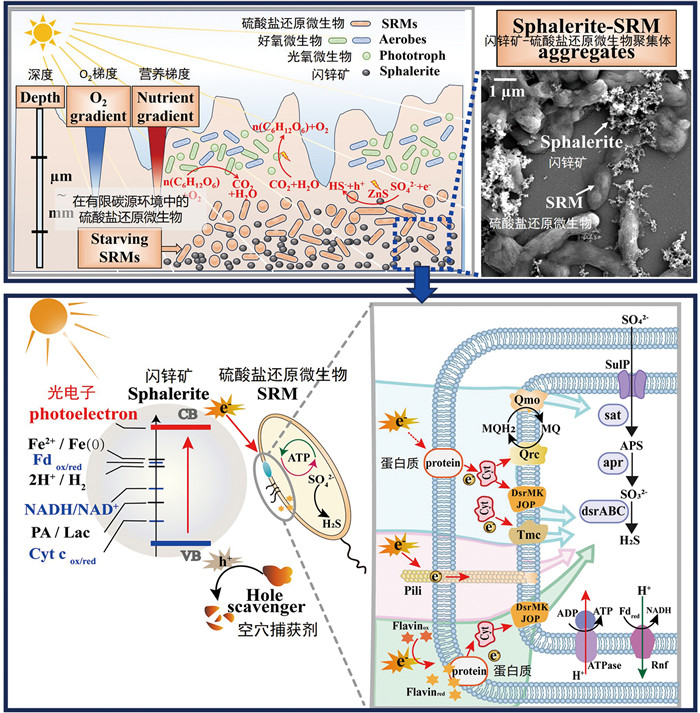
3 微生物光电能转移对胞内能量转换与代谢的影响 3.1 光电子参与的胞内能量转换光电子通过跨膜蛋白进入微生物胞内后会进一步影响微生物的代谢和能量合成。ATP和NAD(P)H是微生物介导能量转换的重要载体,NAD(P)H可以作为众多氧化还原反应的电子供体,而ATP可以为胞内代谢和生命活动提供能量。Chen等[39]研究发现外源光敏剂蒽醌-2-磺酸盐的加入可以促进微生物的光电转移并提升硝酸盐还原为N2O的效率,还发现了光暗循环中微生物胞内NADH/NAD+的动态变化过程,揭示了光电子输入促进了还原力NADH的形成。Guo等[40]通过将磷化铟纳米粒子组装到酿酒酵母(Saccharomyces cerevisiae)的表面形成无机-微生物杂合体,在光照条件下磷化铟半导体光激发产生的光电子可以进入酵母菌胞内参与NADP+向NADPH的还原过程,促进了代谢物莽草酸的节能生产,证明了胞内氧化还原物质的含量(NADP+/NADPH)会影响代谢产物的产量分配。Yu等[41]构建了聚合物点(PolymerDots)-细菌生物杂交系统,在光照条件下产生的光电子促进胞内还原力NADPH的产生,并且结合基因工程改造增强乙酸向乙酰辅酶A转化的效率,最终实现醋酸盐向脂肪醇的高效转化。研究沼泽红假单胞菌(Rhodopseudomonas palustris)与CdS构成的无机-生物杂交系统发现,在可见光的照射下,光电子输入可以促进胞内NADPH辅因子以及ATP的生产,从而提高卡尔文循环中中间体甘油醛-3-磷酸的生成,进一步提升了类胡萝卜素和PHB的产量[42]。在天然环境中,半导体矿物在光照条件下源源不断产生的光生电子空穴对也在影响着微生物的代谢和能量转化。研究发现,在电子供体缺乏的条件下,闪锌矿在光照条件下产生的光电子可以为异养的硫酸盐还原菌Desulfovibrio desulfuricans G20提供电子/能量来源,相比较于黑暗组(无电子供体)菌体在32 h内仍能保持活性。由于闪锌矿位于微生物菌体的胞外,而微生物的代谢活动和能量合成都在胞内发生,矿物并不能直接透过细胞膜进入微生物胞内。研究通过分子生物学、转录组和代谢组等手段发现,硫酸盐还原菌G20会利用多种跨膜途径包括外膜细胞色素c、纳米导线和电子穿梭体进行胞外光电子的摄取(图 6),而直接途径(包括外膜细胞色素c和纳米导线)介导了超过90%光电子的摄取。另外,研究进一步发现在能量受限环境中形成的“低能量生物膜”中,尽管微生物面临着能量供应的严重限制,但仍然能够通过利用替代的电子供体(如光电子)来维持其代谢活动和生存(图 6)。不仅如此,光电子进入微生物胞内后显著促进了胞内硫酸盐还原和ATP合成过程。胞内ATP浓度是对照组的2.4倍,说明光电子由胞外进入胞内后可以用于微生物胞内ATP的合成,从而为其各种生命活动提供动力[43]。
|
图 6 低能量生物膜中硫酸盐还原菌摄取闪锌矿光电子的机制[43] |
按照微生物生态功能,可将光电子参与的胞内合成代谢分为固碳、固氮、产氢和产甲烷等过程。
3.2.1 固碳作用固碳微生物分布广泛,种类繁多,在地球生态系统中扮演至关重要的角色,它们对于缓解全球气候变暖和达成碳中和目标发挥着关键作用。目前主要的固碳途径有6种:Calvin循环、Wood-Ljungdahl途径、还原性三羧酸循环(rTCA)、3-羟基丙酸双循环(3-HP)、3-羟基丙酸/4-羟基丁酸循环(3-HP/4-HB)和2-羧酸/4-羟基丁酸循环(DC/4- HB)[44, 45]。无一例外,这些固碳途径都需要充足的还原力NAD(P)H。自然生态特别是(半)透光环境中普遍存在天然半导体矿物,矿物光电子为微生物固碳提供了重要还原力。
2012年,鲁安怀团队[10, 46]首次开发出了光燃料电池,通过三种半导体矿物(金红石、针铁矿和纤铁矿)不断转化产生光电子,有效促进微生物生长(图 2B)。随后,杨培东团队[27]构建出了同型产乙酸菌M. thermoacetica自诱导组装CdS-微生物杂合体系,体系中M. thermoacetica利用CdS光照下产生的光电子通过Wood-Ljungdahl途径固碳产生乙酸(图 2C、7)。代谢组和蛋白质组学证实黄素蛋白、铁还原蛋白和NADP脱氢酶是M. thermoacetica接收光电子的重要蛋白,甲酸脱氢酶、一氧化碳脱氢酶、乙酰辅酶A合酶和磷酸转移酶则负责转化WL途径固碳产物和所需能量[23]。基于诱导矿物沉淀自组装理念,2019年Wang等[42]开发的R. palustris诱导CdS沉淀,自组装的杂合体系可以固碳并产生可降解生物塑料——聚3羟基丁酸酯PHB。除了微生物诱导矿物沉淀,Jin等[29]通过人工合成CdS,与同型产乙酸菌Clostridium autoethanogenum组装成杂合体系,体系中光电子的产生有效促进了C. autoethanogenum固碳效率和乙酸产量,转录组证据表明微生物通过膜结合蛋白转化光电子产氢,或自身分泌黄素为穿梭体介导电子跨膜进入胞内,促进还原力NAD(P)H的产生。
|
(A) CdS光电子加快M. thermoacetica产乙酸速率;(B) M. thermoacetica-CdS系统的通路图[27] 图 7 乙酸菌利用CdS光照下产生的光电子固碳产生乙酸 |
上述矿物-微生物杂合的半人工光合体系都是建立在微生物具备光能或化能自养代谢途径的基础上。近年发现的第七条天然固碳途径逆三羧酸循环(roTCA),拥有与三羧酸循环(TCA)完全相同的功能编码基因,不同之处在于roTCA途径中柠檬酸合成酶在胞内还原力和辅酶CoA充足的情况下可能发生逆转,从而推动TCA逆向固碳[47-49]。这一新途径的发现暗示着传统认识中的异养微生物可能在还原力和能量充足的贫营养环境中通过roTCA维持生物活性,矿物光电子可能为这些微生物提供了有利条件。
3.2.2 固氮作用生物固氮是地球生态系统中氮循环的关键环节,它通过特定的微生物,利用其固氮酶在常温常压的条件下,将大气中的氮气转化为氨,增强了生态系统中氮的有效性[50]。在自然界中,光合固氮微生物因光合色素的光吸收效率较低,导致光量子效率低下,限制了氮气转化为氨的固氮效率。黄绍福等[50]在研究中发现,Pseudomonas stutzeri-CdS非光合固氮微生物的半人工光合成系统能够将N2转化为NH3,这一过程的关键在于,当半导体材料与非光合固氮微生物结合后,半导体经过光照后能够提供光电子给微生物。这些光电子的注入激活了微生物细胞内的固氮酶和乙炔还原酶,导致其活性升高。进一步的研究表明,固氮酶活性的提高与固氮酶基因的表达密切相关。在这一系统中,nifA、nifD、nifH、nifK这四个固氮酶基因的相对表达丰度出现了显著性上调,光电子的输入激活了固氮酶相关基因的表达,从而增强了固氮酶的合成和活性。Wang等[51]利用R. palustris-CdS系统发现光电子传递到微生物的固氮酶中将N2还原为NH3,同时光电子也可以通过铁氧还蛋白传递给NADP+生成NADPH。
3.2.3 产氢产甲烷作用生物产氢产甲烷是指使用可再生资源生成氢气以及甲烷等清洁能源,有助于人们减少对化石燃料的依赖,实现能源的可持续发展[52]。Han等[53]将Shewanella oneidensis MR-1与CdS半导体构建了一个复合光合系统,在这个系统中产生的光电子通过S. oneidensis MR-1的胞外电子传递链传至细胞内。光电子被细菌内部的氢化酶接收,该酶催化质子(H+)还原为氢气(H2),同时相比对照组也显著增加了H2产量、ATP以及NADH/NAD+的比例,也表现出光电子可以增加细胞内还原力的潜力。Ye等[24]将M. barkeri产甲烷古菌与CdS半导体材料结合,在它们之间引入了镍铜(NiCu)合金。通过DFT模型计算出引入的NiCu合金会改善光电子的转移,增强光电流强度,降低电化学阻抗,延长衰减时间,实现了几乎100%的产甲烷选择性和12.41%的量子产率。
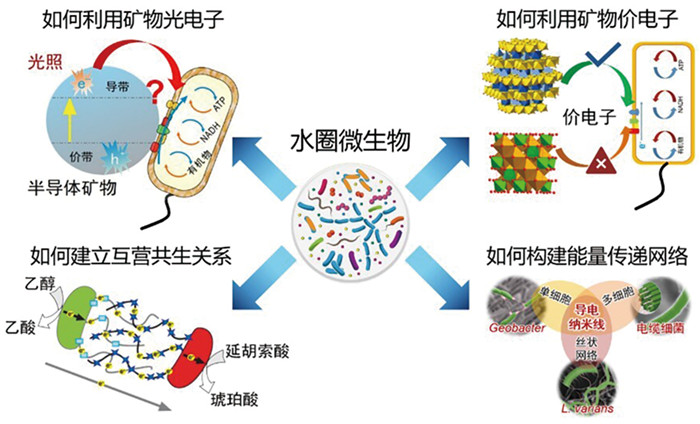
4 结论与展望半导体矿物产生的光电子和光空穴通过多种方式影响着微生物的生长和代谢。近年来的研究也将微生物光电能代谢广泛运用于合成生物学、人造光合系统、工业污染治理等多个领域。研究微生物如何利用矿物光电子和价电子能量,建立互营共生关系,构建能量传递网络,对提高光电能量转化效率十分重要。特别是在寡营养、低能量的环境下(如海洋透光层),微生物可能形成独特的能量获取和代谢方式(图 8)。随着基因工程技术手段的不断发展,人们利用基因编辑技术,如CRISPR/Cas9技术可以精准地修改微生物的基因组,从而增强其光合作用能力和电能转换效率,如通过改造与光合途径、电子传递链和代谢产物合成等相关的基因,来优化微生物的光电能代谢效率[54, 55]。另一个有效的策略是使用人工辅因子,以提高能量转换效率。通过酶工程,可以设计目标酶使其高效利用由正交人工辅因子传递的能量,从而绕过细胞内的通用能量系统[30, 56, 57]。
|
图 8 寡营养水圈微生物能量转化与代谢的关键科学问题 |
近年来,众多新型导电聚合物和纳米材料的出现,也极大地提升了微生物能量转化的性能。通过构建适合微生物生长的电极材料,可以实现更高的电子转移效率和更好的生物相容性[58]。但是光电能转化效率低下限制了半导体-微生物杂合系统的大规模运用:一方面,微生物光电能代谢本身存在较多能量耗散过程,例如光捕获[59]、电子传递[60]和化学能转化等过程;另一方面,材料的成分和反应条件都会显著影响微生物的光电转化效率,材料的光电响应能力[61]和生物兼容性[62],及对微生物生理状态的研究都有助于提升微生物的光电转化效率。目前对微生物光电能代谢机制的了解微乎其微,只涉及少数具有已知胞外电子传递的微生物[63],并且无法确定具有胞外电子传递的微生物能否同时具备光电能代谢功能。此外,光电能代谢过程中涉及多种跨膜蛋白、电子传递链及相关的代谢途径,研究其机制需要借助基因组学、蛋白质组学及代谢组学等生物信息方法,需要做到深入的学科交叉。
微生物光电代谢过程也被广泛运用于废水处理和土壤污染治理,通过光电化学-微生物系统降解有机污染物和去除重金属。此外,微生物光电代谢系统能够实现二氧化碳的捕集与转化,有助于减缓全球变暖和气候变化[64]。目前的研究大多关注于实验室人造系统,通过多种手段提高光电转化能力,但对在天然环境中微生物光电能代谢过程的分子机理和特定的基因、蛋白等知之甚少。因此,微生物光电能代谢对于微生物群落结构的影响及其代谢过程如何影响元素循环,改变土壤和水体的化学特性,进而影响到有机物的形成、转化和重金属的迁移和归趋仍有待进一步研究。
综上所述,未来可以在矿物晶胞(Cell)-微生物细胞(Cell)的层次上,探索半导体矿物光电子与微生物细胞外膜关键蛋白作用的精细途径以及半导体矿物光电子与微生物胞外电子间能量转移、转化的途径和机理等(图 2D)[14]。微生物光电能代谢新途径与能量转化新体系的发现为可再生能源的开发和环境治理提供了重要机遇。基于基因工程和合成生物学的进步、材料科学的发展,以及对生态系统的深入理解,我们能够更好地利用微生物光电代谢的潜力,推动可持续发展。不仅如此,对于微生物光电能代谢相关基因、蛋白的深入研究有助于我们对该过程的理解并拓宽现有的微生物基因资源库。微生物胞外电子传递能力从早期太古宙就进化而来[65],而光电能代谢是基于微生物具有胞外电子传递的能力。因此,微生物光电能代谢可能在早期地球系统中就对地表环境产生影响,并且在现代地球系统中发挥着重要的作用,而微生物光电能代谢的过程如何影响地质环境和地表环境的演化仍需要我们进一步探究。
| [1] |
Potter RM, Rossman GR. Desert varnish: the importance of clay minerals. Science, 1977, 196: 1446-8. DOI:10.1126/science.196.4297.1446 |
| [2] |
Dorn RI, Oberlander TM. Rock varnish. Prog Phys Geog, 1982, 6: 317-67. DOI:10.1177/030913338200600301 |
| [3] |
Mancinelli RL, Bishop JL, De S. Magnetite in desert varnish and applications to rock varnish on Mars[C]. Lunar Planetary Sci Con, 2002
|
| [4] |
Li Y, Li Y, Ding HR, et al. Mineralogical characteristics of Fe-Mn cutans in yellow brown earth of Wuhan, China. J Nanosci Nanotechnol, 2017, 17: 6873-80. DOI:10.1166/jnn.2017.14447 |
| [5] |
Xu XM, Ding HR, Li Y, et al. Mineralogical characteristics of Mn coatings from different weathering environments in China: clues on their formation. Miner Petrol, 2018, 112: 671-83. DOI:10.1007/s00710-018-0564-0 |
| [6] |
鲁安怀, 李艳, 丁竑瑞, 等. 地表"矿物膜": 地球"新圈层". 岩石学报, 2019, 35: 119-28. |
| [7] |
Xu XM, Li Y, Li YZ, et al. Characteristics of desert varnish from nanometer to micrometer scale: a photo-oxidation model on its formation. Chem Geol, 2019, 522: 55-70. DOI:10.1016/j.chemgeo.2019.05.016 |
| [8] |
Xu XM, Ding HR, Li Y, et al. The micro-scaled characterization of natural terrestrial ferromanganese coatings and their semiconducting properties. Coatings, 2020, 10: 666. DOI:10.3390/coatings10070666 |
| [9] |
Lu AH, Li Y, Ding HR, et al. Photoelectric conversion on Earth's surface via widespread Fe- and Mn-mineral coatings. Proc Natl Acad Sci USA, 2019, 116: 9741-6. DOI:10.1073/pnas.1902473116 |
| [10] |
Lu AH, Li Y, Jin S, et al. Growth of non-phototrophic microorganisms using solar energy through mineral photocatalysis. Nat Commun, 2012, 3: 768. DOI:10.1038/ncomms1768 |
| [11] |
Lu AH, Li Y, Wang CQ, et al. Interactions between semiconducting minerals and microbes [M]//Introduction to Environmental Mineralogy. Singapore: Springer Nature Singapore, 2023: 171-214
|
| [12] |
Lu AH, Li Y, Wang X, et al. Photoelectrons from minerals and microbial world: a perspective on life evolution in the early Earth. Precambrian Res, 2013, 231: 401-8. DOI:10.1016/j.precamres.2013.04.004 |
| [13] |
Igarashi K, Kato S. Extracellular electron transfer in acetogenic bacteria and its application for conversion of carbon dioxide into organic compounds. Appl Microbiol Biotechnol, 2017, 101: 6301-7. DOI:10.1007/s00253-017-8421-3 |
| [14] |
Wang B, Shi L, Lu AH. Photosynthesis by non-photosynthetic microorganisms via semiconductor photocatalysis. mLife, 2024, 3: 532-6. DOI:10.1002/mlf2.12156 |
| [15] |
Kirk JTO. Light and photosynthesis in aquatic ecosystems: New York, USA: Cambridge University Press, 2011: 3-27.
|
| [16] |
Shang SL, Lee ZP, Wei GM. Characterization of MODIS-derived euphotic zone depth: results for the China sea. Remote Sens Environ, 2011, 115: 180-6. DOI:10.1016/j.rse.2010.08.016 |
| [17] |
Sun Y, Ren GP, Liu YW, et al. Mineral composition and photochemical reactivity of suspended particulate matters in the euphotic zones of China's nearshore and estuarine regions. Minerals (Basel), 2023, 13: 552. |
| [18] |
Liu J, Sun Y, Lu AH, et al. Extracellular electron transfer of electrochemically active bacteria community promoted by semiconducting minerals with photo-response in marine euphotic zone. Geomicrobiol J, 2021, 38: 329-39. DOI:10.1080/01490451.2020.1856979 |
| [19] |
Liu J, Liu X, Ding HR, et al. Enhanced mechanism of extracellular electron transfer between semiconducting minerals anatase and Pseudomonas aeruginosa PAO1 in euphotic zone. Bioelectrochemistry, 2021, 141: 107849. DOI:10.1016/j.bioelechem.2021.107849 |
| [20] |
Liu J, Ge X, Ding HR, et al. Effect of photoreduction of semiconducting iron mineral-goethite on microbial community in the marine euphotic zone. Front Microbiol, 2022, 13: 846441. DOI:10.3389/fmicb.2022.846441 |
| [21] |
范德江, 陈彬, 王亮, 等. 长江口外悬浮颗粒物中自生纤铁矿和胶黄铁矿. 地球科学(中国地质大学学报), 2014, 39: 1464-70. |
| [22] |
Lu AH, Liu J, Xu MY, et al. Novel energy utilization mechanisms of microorganisms in the hydrosphere. Fundam Res, 2024, 5: 1584-96. |
| [23] |
Kornienko N, Sakimoto KK, Herlihy DM, et al. Spectroscopic elucidation of energy transfer in hybrid inorganic-biological organisms for solar-to-chemical production. Proc Natl Acad Sci USA, 2016, 113: 11750-5. DOI:10.1073/pnas.1610554113 |
| [24] |
Ye J, Wang C, Gao C, et al. Solar-driven methanogenesis with ultrahigh selectivity by turning down H2 production at biotic-abiotic interface. Nat Commun, 2022, 13: 6612. DOI:10.1038/s41467-022-34423-1 |
| [25] |
Liu Q, Zhang HY, Chen S, et al. Optimizing humic acid breakdown and methane production via semiconductor-assisted photo-anaerobic digestion. Chem Eng J, 2024, 490: 151929. DOI:10.1016/j.cej.2024.151929 |
| [26] |
Liu C, Tang J, Chen HM, et al. A fully integrated nanosystem of semiconductor nanowires for direct solar water splitting. Nano Lett, 2013, 13: 2989-92. DOI:10.1021/nl401615t |
| [27] |
Sakimoto KK, Wong AB, Yang PD. Self-photosensitization of nonphotosynthetic bacteria for solar-to-chemical production. Science, 2016, 351: 74-7. DOI:10.1126/science.aad3317 |
| [28] |
Ye J, Yu J, Zhang YY, et al. Light-driven carbon dioxide reduction to methane by Methanosarcina barkeri-CdS biohybrid. Appl Catal B Environ, 2019, 257: 117916. DOI:10.1016/j.apcatb.2019.117916 |
| [29] |
Jin S, Jeon Y, Jeon MS, et al. Acetogenic bacteria utilize light-driven electrons as an energy source for autotrophic growth. Proc Natl Acad Sci USA, 2021, 118: e2020-552118. |
| [30] |
Zhang RT, He Y, Yi J, et al. Proteomic and metabolic elucidation of solar-powered biomanufacturing by bio-abiotic hybrid system. Chem, 2020, 6: 234-49. DOI:10.1016/j.chempr.2019.11.002 |
| [31] |
Fu B, Mao X, Park Y, et al. Single-cell multimodal imaging uncovers energy conversion pathways in biohybrids. Nat Chem, 2023, 15: 1400-7. DOI:10.1038/s41557-023-01285-z |
| [32] |
谢英鹏, 王国胜, 张恩磊, 等. 半导体光解水制氢研究: 现状、挑战及展望. 无机化学学报, 2017, 33: 177-209. |
| [33] |
Nichols EM, Gallagher JJ, Liu C, et al. Hybrid bioinorganic approach to solar-to-chemical conversion. Proc Natl Acad Sci USA, 2015, 112: 11461-6. DOI:10.1073/pnas.1508075112 |
| [34] |
Liu C, Sakimoto KK, Colon BC, et al. Ambient nitrogen reduction cycle using a hybrid inorganic-biological system. Proc Natl Acad Sci USA, 2017, 114: 6450-5. DOI:10.1073/pnas.1706371114 |
| [35] |
Li YZ, Li Y, Liu Y, et al. Photoreduction of inorganic carbon(+Ⅳ) by elemental sulfur: implications for prebiotic synthesis in terrestrial hot springs. Sci Adv, 2020, 6: eabc3687. DOI:10.1126/sciadv.abc3687 |
| [36] |
Rowe SF, Le Gall G, Ainsworth EV, et al. Light-driven H2 evolution and C═C or C═O bond hydrogenation by Shewanella oneidensis: a versatile strategy for photocatalysis by nonphotosynthetic microorganisms. ACS Catalysis, 2017, 7: 7558-66. DOI:10.1021/acscatal.7b02736 |
| [37] |
Yasuda M, Miura A, Yuki R, et al. The effect of TiO2-photocatalytic pretreatment on the biological production of ethanol from lignocelluloses. J Photochem Photobiol A Chem, 2011, 220: 195-9. DOI:10.1016/j.jphotochem.2011.04.019 |
| [38] |
Huang SF, Chen KY, Chen XY, et al. Sunlight significantly enhances soil denitrification via an interfacial bio-photoelectrochemical pathway. Environ Sci Technol, 2023, 57: 7733-42. DOI:10.1021/acs.est.3c00236 |
| [39] |
Chen M, Cai QH, Chen XY, et al. Anthraquinone-2-sulfonate as a microbial photosensitizer and capacitor drives solar-to-N2O production with a quantum efficiency of almost unity. Environ Sci Technol, 2022, 56: 5161-9. DOI:10.1021/acs.est.1c08710 |
| [40] |
Guo J, Suastegui M, Sakimoto KK, et al. Light-driven fine chemical production in yeast biohybrids. Science, 2018, 362: 813-6. DOI:10.1126/science.aat9777 |
| [41] |
Yu W, Pavliuk MV, Liu AJ, et al. Photosynthetic polymer dots–bacteria biohybrid system based on transmembrane electron transport for fixing CO2 into poly-3-hydroxybutyrate. ACS Appl Mater Interfaces, 2023, 15: 2183-91. DOI:10.1021/acsami.2c18831 |
| [42] |
Wang B, Jiang ZF, Yu JC, et al. Enhanced CO2 reduction and valuable C2+ chemical production by a CdS-photosynthetic hybrid system. Nanoscale, 2019, 11: 9296-301. DOI:10.1039/C9NR02896J |
| [43] |
Zhong C, Ren YY, Guo YY, et al. Photoelectron-promoted sulfate reduction for heavy metal removal without organic carbon addition. Environ Sci Technol, 2024, 58: 21680-91. DOI:10.1021/acs.est.4c08073 |
| [44] |
Achenbach LA, Carey J, Madigan MT. Photosynthetic and phylogenetic primers for detection of anoxygenic phototrophs in natural environments. Appl Environ Microbiol, 2001, 67: 2922-6. DOI:10.1128/AEM.67.7.2922-2926.2001 |
| [45] |
Fuchs G. Alternative pathways of carbon dioxide fixation: insights into the early evolution of life?. Annu Rev Microbiol, 2011, 65: 631-58. DOI:10.1146/annurev-micro-090110-102801 |
| [46] |
Lu AH, Li Y. Light fuel cell (LFC): a novel device for interpretation of microorganisms-involved mineral photochemical process. Geomicrobiol J, 2012, 29: 236-43. DOI:10.1080/01490451.2011.575911 |
| [47] |
Mall A, Sobotta J, Huber C, et al. Reversibility of citrate synthase allows autotrophic growth of a thermophilic bacterium. Science, 2018, 359: 563-7. DOI:10.1126/science.aao2410 |
| [48] |
Nunoura T, Chikaraishi Y, Izaki R, et al. A primordial and reversible TCA cycle in a facultatively chemolithoautotrophic thermophile. Science, 2018, 359: 559-63. DOI:10.1126/science.aao3407 |
| [49] |
Zhang T, Shi XC, Ding R, et al. The hidden chemo-lithoautotrophic metabolism of Geobacter sulfurreducens uncovered by adaptation to formate. ISME J, 2020, 14: 2078-89. DOI:10.1038/s41396-020-0673-8 |
| [50] |
黄绍福, 靖宪月, 陈曼, 等. 光驱动Pseudomonas stutzeri-CdS半人工光合系统固氮产氨效果与机制. 中国科学: 技术科学, 2021, 51: 435-45. |
| [51] |
Wang B, Xiao KM, Jiang ZF, et al. Biohybrid photo-heterotrophic metabolism for significant enhancement of biological nitrogen fixation in pure microbial cultures. Energy Environ Sci, 2019, 12: 2185-91. DOI:10.1039/C9EE00705A |
| [52] |
Martins M, Toste C, Pereira IAC. Enhanced light-driven hydrogen production by self-photosensitized biohybrid systems. Angew Chem Int Ed Engl, 2021, 60: 9055-62. DOI:10.1002/anie.202016960 |
| [53] |
Han HX, Tian LJ, Liu DF, et al. Reversing electron transfer chain for light-driven hydrogen production in biotic-abiotic hybrid systems. J Am Chem Soc, 2022, 144: 6434-41. DOI:10.1021/jacs.2c00934 |
| [54] |
Li F, Yu H, Zhang BC, et al. Engineered cell elongation promotes extracellular electron transfer of Shewanella oneidensis. Adv Sci, 2024, 11: 2403067. DOI:10.1002/advs.202403067 |
| [55] |
Zhu GL, Yang Y, Liu J, et al. Enhanced photocurrent production by the synergy of hematite nanowire-arrayed photoanode and bioengineered Shewanella oneidensis MR-1. Biosens Bioelectron, 2017, 94: 227-34. DOI:10.1016/j.bios.2017.03.006 |
| [56] |
Berhanu S, Ueda T, Kuruma Y. Artificial photosynthetic cell producing energy for protein synthesis. Nat Commun, 2019, 10: 1325. DOI:10.1038/s41467-019-09147-4 |
| [57] |
Willett E, Banta S. Synthetic NAD(P)(H) cycle for ATP regeneration. ACS Synth Biol, 2023, 12: 2118-26. DOI:10.1021/acssynbio.3c00172 |
| [58] |
Cheng SA, Logan BE. Ammonia treatment of carbon cloth anodes to enhance power generation of microbial fuel cells. Electrochem Commun, 2007, 9: 492-6. DOI:10.1016/j.elecom.2006.10.023 |
| [59] |
Cong Y, Wang X, Bai H, et al. Intracellular gold nanocluster/organic semiconductor heterostructure for enhancing photosynthesis. Angew Chem Int Ed Engl, 2024, 63: e202406527. DOI:10.1002/anie.202406527 |
| [60] |
Agee A, Pace G, Yang V, et al. Mixed conducting polymers alter electron transfer thermodynamics to boost current generation from electroactive microbes. J Am Chem Soc, 2024, 146: 19728-36. DOI:10.1021/jacs.4c01288 |
| [61] |
Bassett S, Ding Y, Roy MK, et al. Light-driven metabolic pathways in non-photosynthetic biohybrid bacteria. Chembiochem, 2024, 25: e202300572. DOI:10.1002/cbic.202300572 |
| [62] |
Lou X, Zhang C, Xu Z, et al. Enhanced interfacial electron transfer in photocatalyst-natural enzyme coupled artificial photosynthesis system: tuning strategies and molecular simulations. Small, 2024, 20: e2404055. DOI:10.1002/smll.202404055 |
| [63] |
Shi L, Dong HL, Reguera G, et al. Extracellular electron transfer mechanisms between microorganisms and minerals. Nat Rev Microbiol, 2016, 14: 651-62. DOI:10.1038/nrmicro.2016.93 |
| [64] |
Li C, Liu Y, Luo MM, et al. Enhancing simultaneous electrosynthesis of CO2 and nitrogen removal in microbial fuel cell (MFC) cathode compartment by adding Fe–C/biochar compound substrates. J Power Sources, 2023, 560: 232707. DOI:10.1016/j.jpowsour.2023.232707 |
| [65] |
Vargas M, Kashefi K, Blunt-Harris EL, et al. Microbiological evidence for Fe(Ⅲ) reduction on early Earth. Nature, 1998, 395: 65-7. DOI:10.1038/25720 |
 2025, Vol. 37
2025, Vol. 37 

 鲁安怀,现任北京大学地球与空间科学学院教授、矿物环境功能北京市重点实验室主任。曾担任国际矿物学协会(IMA)主席,现任美国矿物学会Fellow,中国地质学会矿物学专业委员会主任,中国矿物岩石地球化学学会环境矿物学专业委员会主任等。曾主持两轮重大科学前沿领域973项目和1个国家重点研发计划项目及若干国家自然科学基金重点项目等。长期从事矿物学专业研究,在矿物演化、矿物功能材料、矿物环境属性、矿物与微生物交互作用及矿物光电子能量等研究方面取得了系统性创新成果,近年来在海洋生物矿物材料开发应用研究领域取得显著经济效益
鲁安怀,现任北京大学地球与空间科学学院教授、矿物环境功能北京市重点实验室主任。曾担任国际矿物学协会(IMA)主席,现任美国矿物学会Fellow,中国地质学会矿物学专业委员会主任,中国矿物岩石地球化学学会环境矿物学专业委员会主任等。曾主持两轮重大科学前沿领域973项目和1个国家重点研发计划项目及若干国家自然科学基金重点项目等。长期从事矿物学专业研究,在矿物演化、矿物功能材料、矿物环境属性、矿物与微生物交互作用及矿物光电子能量等研究方面取得了系统性创新成果,近年来在海洋生物矿物材料开发应用研究领域取得显著经济效益