人造细胞是指基于合成生物学原理,采用“自下而上”的构建方式,利用磷脂、蛋白质及核酸等生物分子为组装单元构建的类细胞结构[1, 2],其能够模拟细胞部分或全部功能,例如物质合成[3, 4]、能量代谢[5-8]以及信号转导[9-11]等重要生命活动,为细胞结构和功能的深入研究提供简化的研究模型[12-15]。人造细胞通常基于磷脂囊泡、聚合物囊泡及凝聚体等构建而成。磷脂囊泡由磷脂双分子层构建,具有良好的生物相容性,能有效封装并保护内部物质[16-19]。聚合物囊泡是由嵌段共聚物自组装而成的中空球体结构,其化学及机械性能稳定,使之成为递送药物的优选模型[20, 21]。凝聚体则是利用液-液分离原理构建的无膜结构,能够有效负载酶等带电性物质,常被用作药物递送载体[22, 23]。
人造细胞结构简单可控,且具有良好的生物相容性,在生物医学领域展现出双重应用潜力及优势[19, 24-26]。一方面,它们能够作为功能障碍的天然细胞的替代品,发挥生理功能[19];另一方面,通过与天然细胞间的相互作用,人造细胞能够调节细胞生命活动,在疾病治疗等方面发挥作用[17]。作为一个独立的系统,人造细胞通过内部封装药物、无细胞表达系统等物质,实现药物的靶向递送以及生物物质合成等多种功能[16, 27],为疾病的治疗开辟新途径。
鉴于人造细胞在疾病治疗领域所展现的显著潜力及应用价值,以及当前关于人造细胞在医学领域的综述相对匮乏,本综述系统性总结并分析了人造细胞在多个生理系统(包括内分泌系统、循环系统、免疫系统以及其他系统)疾病治疗中的最新研究成果,深入探讨了人造细胞在特定疾病治疗中的具体应用策略,阐述了其精准靶向和药物释放等机制,对其目前在疾病治疗中存在的问题进行了总结,并对其未来发展方向进行了展望。
1 人造细胞在内分泌系统中的应用 1.1 糖尿病糖尿病作为一种常见的内分泌系统疾病,主要是胰岛β细胞功能障碍导致胰岛素分泌减少,从而诱导血糖水平异常升高[28, 29]。当前,糖尿病的治疗方式主要为皮下注射外源性胰岛素,但胰岛素过量常常会导致低血糖,严重时导致癫痫发作、晕厥甚至死亡[30, 31]。近年来,研究人员通过合成生物学设计并构建可模拟胰岛β细胞功能的人造细胞,旨在开发可以感知葡萄糖水平变化,动态调节胰岛素分泌的人造胰岛β细胞,以实现血糖水平的精准控制,降低胰岛素过量引发的低血糖风险。葡萄糖氧化酶(glucose oxidase, GOx)因其能通过与葡萄糖反应生成过氧化氢及葡萄糖酸从而导致局部pH值降低的特性,在人造胰岛β细胞构建中被广泛应用[32-34]。
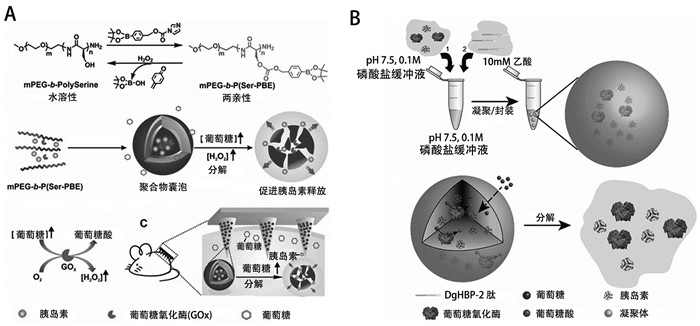
构建能够对过氧化氢敏感的聚合物囊泡是模拟胰岛β细胞功能的一种有效途径[35, 36]。过氧化氢能够导致对其敏感的聚合物构象发生改变,从而诱导聚合物囊泡破裂,快速释放内部封装的胰岛素。在血糖浓度升高时,葡萄糖分子进入聚合物囊泡与GOx反应,生成过氧化氢,诱导囊泡破裂,快速释放内部封装的胰岛素。当血糖恢复至正常水平时,胰岛素释放速度减缓,可显著降低低血糖发生的风险。利用苯硼酯易于被过氧化氢降解的原理[37],Hu等[35]设计了由聚乙二醇和苯硼酯聚结合的巨丝氨酸(mPEG-b-P(Ser-PBE))自组装的聚合物囊泡,将其与透明质酸经皮微针阵列贴片结合,构建了具有良好生物相容性及过氧化氢敏感的胰岛素递送贴片(图 1A)。通过1型糖尿病小鼠模型证实该贴片可有效调节血糖水平,治疗组小鼠的血糖在1 h内降至正常水平,并可维持治疗效果长达5 h。利用过氧化氢敏感的含硫键聚合物,Wang等[36]成功制备了可通过小肠上皮运输靶向肝脏的聚合物囊泡(Pep-polymersomes, Pep-PMS),通过在囊泡表面修饰小肠上皮神经节苷酯-单唾液酸(ganglioside-monosialic acid, GM1)受体靶向肽,使其可通过小肠上皮运输靶向肝脏。在其内部包封GOx及胰岛素,Pep-PMS可感知葡萄糖水平,动态分泌胰岛素,能够有效控制血糖。体内实验证实,该人造细胞通过口服摄入体内后,具有靶向肝脏的能力,同时还可有效改善肝脏的葡萄糖代谢通路,促进肝脏对葡萄糖的摄取并刺激糖原合成,从而提高治疗效果。
构建pH响应释放胰岛素的人造细胞,是构建模拟胰岛β细胞的另一种有效方式。Chen等[33]设计制备了具有多室结构、对pH敏感的磷脂囊泡,其可以感知葡萄糖水平并通过肽介导的膜融合从而释放胰岛素。胰岛素被包封在小囊泡中,大囊泡封装葡萄糖代谢系统。当外部葡萄糖浓度升高,人造胰岛β细胞通过囊泡膜上的葡萄糖转运蛋白摄取葡萄糖,葡萄糖进一步与囊泡内的GOx反应产生氢离子,导致pH降低,从而介导肽结合,触发小囊泡与大囊泡融合,将胰岛素释放到细胞外。通过将该人造胰岛β细胞注射到1型糖尿病小鼠模型中,1 h后小鼠血糖降至正常水平,并可维持治疗效果长达5 d,在动物水平证实了该人造细胞可有效调节体内血糖水平。凝聚体通过负载GOx及胰岛素可用于模拟胰岛β细胞。如图 1B所示,Lim等[38]利用pH敏感的富含组氨酸的喙蛋白(histidine-rich beak proteins, DgHBPs)自组装构建凝聚体,通过在其内部封装GOx及胰岛素,使其可通过感知外界葡萄糖浓度的变化,动态释放胰岛素,有望用于糖尿病的治疗。
1.2 高尿酸血症高尿酸血症是另一种常见的内分泌系统疾病,是指血液中的尿酸水平异常,超过正常范围,通常是由尿酸生成增加或者排泄减少造成的,常会导致痛风、代谢综合征以及肾结石等多种并发症[39-42]。目前,高尿酸血症的治疗方式主要为药物治疗,但容易造成肝肾负担。人造细胞可影响体内代谢途径,改善尿酸的排泄及代谢,进而达到治疗的目的。Zhuang等[43]设计构建了装载尿酸酶(uricase, Uri)的凝聚体,可有效降解尿酸,显著降低血清中尿酸的浓度。然而,尿酸酶在降解尿酸的同时,容易产生过量的过氧化氢,可诱发高铁血红蛋白血症及溶血反应,危及生命[44, 45]。针对此问题,Hu等[46]创新性地合成聚赖氨酸-核苷酸复合物凝聚体,其表面包裹PEG化磷脂膜,内部整合Uri及过氧化氢酶(catalase, CAT),最终构建出Uri/Cat@ArtPC人造细胞。该人造细胞能够有效降解尿酸,同时清除产生的过氧化氢。体内外实验均显示,该人造细胞具有良好的生物相容性,可高效地将尿酸调节至生理水平,同时清除过氧化氢,具有治疗高尿酸血症的能力,并能有效预防潜在的肾损伤。
目前人造细胞在糖尿病和高尿酸血症疾病治疗中,主要通过胰岛素的递送以及外源性酶的整合来发挥作用(表 1),其内部封装的胰岛素及酶有限,存在无法长期应用持续治疗的问题,因此,构建能自编码合成胰岛素等治疗性蛋白质的人造细胞是合成生物学在内分泌系统疾病治疗领域的挑战。
| 表 1 人造细胞在各生理系统疾病治疗中的应用 |
高血压是一种最常见的循环系统疾病,其特征是血液对血管壁的压力持续高于正常水平,常会导致心脏、大脑以及肾脏等重要器官血管结构受损,显著增加冠心病、脑卒中以及肾功能衰竭等疾病风险[70-73]。一氧化氮(nitric oxide, NO)作为一种强效的抗炎物质,具有抗氧化应激、抑制血小板聚集、促进血管舒张以及维持血管系统的稳态等作用,其在预防和治疗高血压方面具有重要的作用[74-76]。
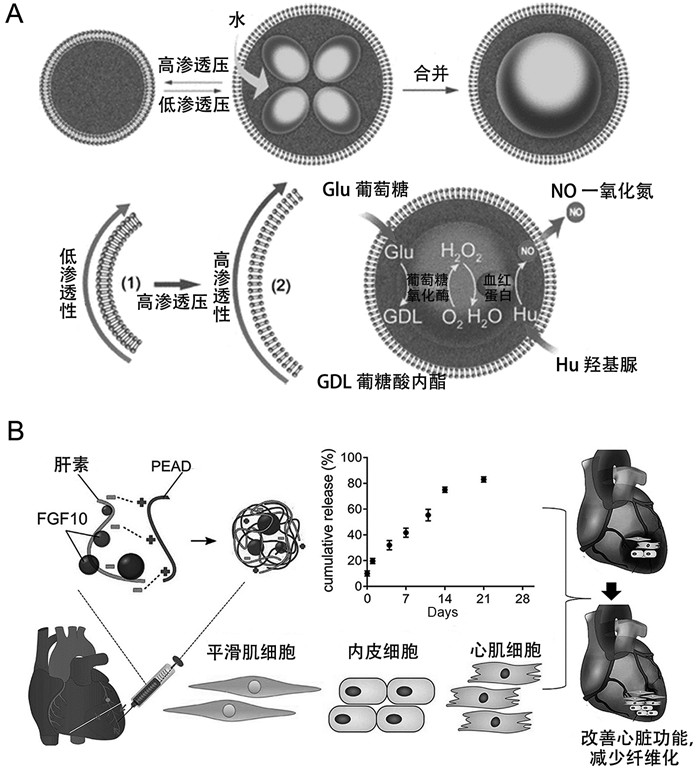
目前,研究人员利用合成生物学原理,致力于开发能够合成NO的人造细胞,旨在探索其在高血压治疗领域的应用[77]。Liu等[47]设计构建了基于葡聚糖及核苷酸凝聚体的人造细胞,在其内部封装GOx以及外部包裹红细胞膜。该人造细胞能够利用葡萄糖及羟基脲作为反应底物,通过GOx以及红细胞膜上的血红蛋白(hemoglobin, Hb)介导的空间酶级联反应高效合成NO,进而诱导血管扩张。红细胞膜赋予了人造细胞良好的生物相容性,同时延长了血液循环时间,使其可应用于高血压及动脉粥样硬化等疾病的治疗。Zhang等[48]使用磷脂双层膜包裹凝聚体构建了具有自我调节能力的人造细胞,其能够响应渗透压变化释放NO。如图 2A所示,通过响应渗透压的变化,该人造细胞的膜通透性发生改变,促进葡萄糖和羟基脲的跨膜转运,通过GOx/Hb酶级联反应生成NO,从而调节血管张力。通过介导NO的产生,人造细胞在调节血管张力方面展现出显著的治疗潜力,为心血管疾病的治疗开辟了新的途径。
2.2 冠心病冠心病作为一种常见的循环系统疾病,常常由于冠状动脉粥样硬化导致心脏血液供应减少,引发心肌组织缺血坏死,严重时可导致死亡[78-81]。成纤维细胞生长因子(fibroblast growth factor, FGF)以及血管内皮生长因子(vascular endothelial growth factor, VEGF)已被成功用于治疗心肌梗死[79, 82],这两种生长因子在心肌再生过程中发挥重要作用[83],能够促进心肌祖细胞分化及增殖,促进血管生成[84-87],增强心肌梗死后心脏结构及功能的重塑。然而,游离态的生长因子在体内半衰期短且生物活性受限,限制了其在临床治疗中的应用。肝素作为一种硫酸多糖,对FGF家族等多种生长因子展现出高亲和力[88-90],常被应用于生长因子的递送。
利用肝素构建的凝聚体可作为递送系统用于心肌梗死疾病的治疗。研究人员开发了一系列可注射的基于肝素的人造细胞,分别将FGF-1[49]、2[51-53]、10[50]以及VEGF封装在肝素和阳离子形成的凝聚体中,凝聚体能够防止生长因子被降解。实验结果表明,这些人造细胞可提高封装在内的生长因子的生物活性,具有促进血管生成的能力。除此之外,该系列人造细胞能够抑制心肌组织炎症及纤维化瘢痕组织形成,有效减轻心肌梗死所导致的缺血性损伤(如图 2B)。由此可见,基于肝素构建的凝聚体在心肌梗死治疗中是一种具有应用前景的递送系统,其可结合单一或多种生长因子,从而扩展其在不同疾病中的应用。
研究人员通过在人造细胞内部模拟天然细胞的蛋白质合成机制,使其能够产生具有治疗功能的蛋白质[91],通过作用于其他细胞或调节细胞微环境,达到治疗疾病的目的[92]。Chen等[54]通过在巨型磷脂囊泡中封装无细胞蛋白合成(cell-free protein synthesis, CFPS)系统,成功构建了能够合成FGF的人造细胞。体外实验证实其可促进血管生成相关的信号转导分子的表达,促进血管内皮细胞增殖及血管的形成。局部注射该人造细胞到小鼠缺血心肌组织,可有效促进血管生成及组织再生,且无免疫原性。以上体内外实验均证实了该人造细胞可自主合成FGF,并有效促进血管生成,在未来有望应用于心肌梗死的治疗。
目前关于人造细胞治疗高血压和冠心病的研究,大多停留在体外水平,动物水平以及临床前研究较少。因此,进一步评估人造细胞在疾病治疗中的有效性,对于其在循环系统疾病治疗应用中具有重要意义。
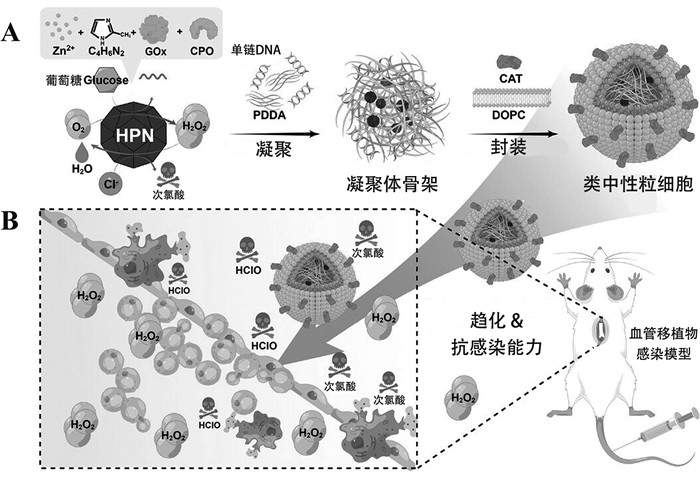
3 人造细胞在免疫系统中的应用 3.1 感染性疾病免疫系统功能紊乱,常会导致感染风险增加,炎症反应加剧,严重时危及生命。中性粒细胞作为免疫系统的重要组成部分,在固有免疫中发挥重要作用,具有抗感染等功能[93]。中性粒细胞功能障碍或数量减少,常会导致感染风险增加。通过构建类中性粒细胞,能够替代中性粒细胞发挥抗感染作用。Zhang等[55]利用热敏性的二嵌段共聚物构建了具有抗菌性能的阳离子聚合物囊泡,其表面带正电。体外抗菌实验表明其对革兰氏阳性菌和革兰氏阴性菌都具有较好的抗菌性能,有望用于感染性疾病的治疗。但该聚合物囊泡仅模拟了中性粒细胞的抗菌性能,缺乏炎症靶向性。Jiang等[56]进一步构建了具有炎症趋化能力以及抗菌性能的类中性粒细胞(图 3)。该类中性粒细胞具有“核壳”结构,其中外层由载有CAT的磷脂双分子层构成,内部“核”是载有GOx及氯过氧化物酶(chloroperoxidase, CPO)的凝聚体。磷脂膜上的CAT具有过氧化氢趋化能力,使其能够向具有高浓度过氧化氢的炎症感染部位趋化。该人造细胞能够催化葡萄糖产生次氯酸,从而发挥杀菌作用。体外及体内实验验证了该人造细胞具有良好的生物相容性,血管移植感染模型验证了其可有效迁移至炎症感染部位从而发挥杀菌抗感染作用,因此有望应用于感染性疾病的治疗。
|
类中性粒细胞的构建及其治疗感染示意图[56]。 图 3 人造细胞在感染性疾病治疗中的应用 |
化疗是治疗癌症最常用的方法之一,但其容易造成肝肾功能损害及骨髓抑制等严重的副作用,限制该方法的应用[94, 95]。利用人造细胞递送化疗药物及基因,可用于癌症的治疗[96, 97]。Liang等[57]利用生物正交化学方法,成功构建了基于组蛋白的凝聚体,该凝聚体负载阿霉素实现药物的缓释,显著增强了对耐药肿瘤小鼠的抗肿瘤效果。由于凝聚体具有良好的流动性,其能够被天然细胞摄入,已被应用于疾病治疗中[58, 59]。Zhang等[58]利用葡聚糖及聚丙烯酸钠构建了负载一氧化氮合酶(nitric oxide synthase, NOS)质粒的凝聚体。该凝聚体作为基因递送载体,能够被肝癌细胞摄取,实现NOS基因转染,使得细胞内NOS表达水平升高从而产生大量的NO,诱导线粒体损伤,进而促进肝癌细胞凋亡,有望应用于肝癌的治疗。
在人造细胞内部合成具有治疗效果的物质,也可用来治疗癌症[98]。Zhang等[59]设计合成了载有GOx的凝聚体,其可被肝癌细胞摄取,通过消耗葡萄糖产生过氧化氢,造成肝癌细胞活性氧损伤,抑制肝癌细胞活性。Krinsky等[60]通过在巨型磷脂囊泡中预装DNA模板以及转录翻译所需的分子等,成功构建了能够合成假单胞菌外毒素A的人造细胞。通过局部注射该人造细胞至小鼠肿瘤部位,该人造细胞能够在肿瘤部位合成具有生物活性的抗癌蛋白,促进肿瘤细胞凋亡,且实验结果显示肿瘤细胞活性被明显抑制。
目前人造细胞在免疫系统疾病治疗中的应用,主要聚焦于药物递送及单一治疗性物质的合成,且仅对部分功能进行模拟,与具有复杂功能的免疫细胞仍存在较大差距。因此,开发同时具备多种生理功能的人造细胞,对免疫系统疾病治疗具有关键作用。
4 其他系统疾病治疗 4.1 神经系统疾病神经系统疾病通常是指因神经元退化或受损导致的中枢及周围神经系统疾病,包括神经退行性疾病以及脊髓损伤等疾病[99-101]。利用肝素构建的凝聚体递送系统,因具有良好的生物相容性和缓释生长因子的能力,可作为递送系统用于神经系统疾病的治疗。Li等[61]设计构建了封装神经生长因子(nerve growth factor, NGF)的凝聚体,并通过坐骨神经损伤的大鼠模型评估了其治疗效果。结果表明,负载NGF的凝聚体能够明显促进大鼠髓鞘轴突的再生,有效改善大鼠的运动功能。Gottipati等[62]报道了负载白介素4 (interleukin-4, IL-4)的凝聚体,该人造细胞能够抑制巨噬细胞介导的炎症反应,抑制神经毒性星形胶质细胞的激活,显著改善小鼠的后肢运动能力,对脊髓损伤具有良好的治疗效果。在人造细胞内部合成生长因子,可用于治疗神经系统疾病。Toparlak等[63]设计构建了一种可以自主合成编码脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)的人造细胞。通过在磷脂囊泡内部封装CFPS系统以及BDNF、膜孔和中介蛋白的DNA模板,使该人造细胞能够在特定条件下合成膜孔蛋白,从而释放BDNF,促进神经干细胞的分化。该研究为利用人造细胞治疗神经系统疾病提供了新的思路,有望用于治疗脊髓损伤等疾病。
4.2 消化系统疾病消化系统疾病是指胃、肠道、肝脏、胆囊以及胰腺等消化器官疾病,目前主要通过药物治疗[102]。然而,药物靶向性的缺乏严重降低了药物的生物利用度,影响治疗效果。研究人员设计构建了具有靶向递送功能的人造细胞,提高了药物的生物利用度。利用巨噬细胞对磷脂酰丝氨酸(phosphatidylserine, PS)的高亲和力,Yin等[64]制备了能够靶向肝巨噬细胞的人造细胞。首先,制备了包封衣康酸的硬脂胺(stearylamine, SA)囊泡,进一步通过静电相互作用将带负电荷的小粒径的PS脂质体吸附到SA囊泡表面,得到表面含有PS的人造细胞。该人造细胞能够将衣康酸靶向递送到肝巨噬细胞,通过抑制巨噬细胞炎症小体的启动及白介素1β (interleukin-1β, IL-1β)的成熟,有效抑制肝脏炎症,调控免疫微环境,维护肝脏稳态,可以用来治疗急性肝衰竭以及慢性肝炎等疾病。因此,人造细胞作为递送系统,可用于慢性炎症性疾病的治疗。Tian等[65]利用葡聚糖及聚苯磺酸钠设计合成了负载大黄素的凝聚体。通过在其表面负载响应pH的EUS100材料,使其具有靶向结肠的能力。体内外实验显示,该人造细胞具有抗炎、抗氧化应激以及修复结肠上皮屏障等功能,可有效治疗溃疡性结肠炎。
4.3 运动系统疾病运动系统又称为骨骼肌肉系统,主要包括骨、关节、肌肉以及皮肤,是人体的重要组成部分。目前人造细胞在运动系统中的应用主要聚焦于组织再生等领域,特别是骨再生与伤口愈合等。Li等[66]构建了负载骨形态发生蛋白2 (bone morphogenetic proteins-2, BMP2)的凝聚体,通过体外实验证明该凝聚体能够促进肌源性干细胞的成骨向分化,且体内实验进一步证实了该凝聚体具有诱导异位骨形成的能力。Gao等[67]利用凝聚体平台,通过体外成骨分化诱导实验以及颅骨缺损模型愈合实验,系统比较了BMP2、4、6、7、9在促进骨缺损愈合中的作用。研究结果表明,BMP2和BMP7通过凝聚体递送系统可明显促进新骨形成,为骨组织再生修复治疗提供了新的思路。Park等[68]成功构建了具有双重递送功能的凝聚体,该凝聚体能有效释放转化生长因子β (transforming growth factor β, TGF-β)以及白介素10 (interleukin-10, IL-10),促进成纤维细胞的增殖与迁移以及血管生成。研究发现,该递送系统能有效促进皮肤伤口愈合,减少增生性瘢痕组织的形成,为无瘢痕伤口愈合治疗开辟了新途径。针对糖尿病患者伤口所处的高血糖微环境,Wang等[69]制备了负载GOx及铜纳米粒子的凝聚体,该凝聚体具有良好的生物相容性及抗菌性能,能够促进糖尿病小鼠的伤口愈合。综上所述,基于凝聚体的人造细胞可作为良好的药物递送载体,有望应用于临床组织再生修复治疗。
在治疗其他系统相关疾病的应用研究中,人造细胞可在其内部合成治疗性物质发挥作用,但其存在产率低、无法持续合成等问题。因此,提高反应产率以及构建自供能的人造细胞对于其在生物医学领域的应用具有关键作用。
5 总结与展望人造细胞结构简单可控且具有良好的生物相容性,在生物医学领域被广泛应用于疾病治疗。本综述主要对人造细胞在内分泌系统疾病(如糖尿病及高尿酸血症)、循环系统疾病(高血压及冠心病)以及免疫系统疾病(如感染性疾病及癌症)治疗中的应用现状进行总结。人造细胞可作为药物递送系统,为药物、生长因子等物质提供稳定的环境,可以通过多种机制实现药物的靶向递送及可控释放,提高药物治疗效果;其次,在人造细胞内部封装酶及CFPS系统等物质,可实现治疗性物质的体内自主合成进而治疗疾病,为人造细胞在疾病治疗中的应用开辟了新的途径。尽管人造细胞在生物医学领域应用前景广阔,但目前的研究仍存在一定的局限性。(1)疾病治疗所用的人造细胞类型较为单一,主要基于磷脂囊泡和凝聚体构建,难以满足体内多种复杂生理环境。利用不同的功能材料开发多样化的人造细胞是本领域的发展方向之一。(2)用于治疗疾病的人造细胞设计趋于简化、功能较为单一,与复杂且多功能的天然细胞仍存在较大的差距。开发同时具备多种生理功能的人造细胞,对疾病治疗具有关键作用。(3)利用人造细胞治疗疾病目前仍停留在细胞以及动物水平,尚缺乏临床前研究来评估其安全性、有效性和可行性,推进人造细胞在临床领域的应用研究,对于人造细胞在疾病治疗领域的发展至关重要。
| [1] |
Jiang W, Wu Z, Gao Z, et al. Artificial cells: past, present and future. ACS Nano, 2022, 16: 15705-33. |
| [2] |
Xu Q, Zhang Z, Lui PPY, et al. Preparation and biomedical applications of artificial cells. Mater Today Bio, 2023, 23: 100877. |
| [3] |
Van Nies P, Westerlaken I, Blanken D, et al. Self-replication of DNA by its encoded proteins in liposome-based synthetic cells. Nat Commun, 2018, 9: 1583. |
| [4] |
Kurihara K, Tamura M, Shohda KI, et al. Self-reproduction of supramolecular giant vesicles combined with the amplification of encapsulated DNA. Nat Chem, 2011, 3: 775-81. |
| [5] |
Yang B, Li S, Mu W, et al. Light-harvesting artificial cells containing cyanobacteria for CO2 fixation and further metabolism mimicking. Small, 2023, 19: 2201305. |
| [6] |
Berhanu S, Ueda T, Kuruma Y. Artificial photosynthetic cell producing energy for protein synthesis. Nat Commun, 2019, 10: 1325. |
| [7] |
Li S, Zhao Y, Wu S, et al. Regulation of species metabolism in synthetic community systems by environmental pH oscillations. Nat Commun, 2023, 14: 7507. |
| [8] |
Zhao J, Zhang Y, Zhang X, et al. Mimicking cellular metabolism in artificial cells: universal molecule transport across the membrane through vesicle fusion. Anal Chem, 2022, 94: 3811-8. |
| [9] |
Wang X, Tian L, Ren Y, et al. Chemical information exchange in organized protocells and natural cell assemblies with controllable spatial positions. Small, 2020, 16: 1906394. |
| [10] |
Li Q, Li S, Zhang X, et al. Programmed magnetic manipulation of vesicles into spatially coded prototissue architectures arrays. Nat Commun, 2020, 11: 232. |
| [11] |
Li S, Wang X, Mu W, et al. Chemical signal communication between two protoorganelles in a lipid-based artificial cell. Anal Chem, 2019, 91: 6859-64. |
| [12] |
Yang B, Li C, Ren Y, et al. Construction of the glycolysis metabolic pathway inside an artificial cell for the synthesis of amino acid and its reversible deformation. J Am Chem Soc, 2024, 146: 21847-58. |
| [13] |
Seo H, Lee H. Programmable enzymatic reaction network in artificial cell-like polymersomes. Adv Sci, 2024, 11: 2305760. |
| [14] |
Ishii Y, Fukunaga K, Cooney A, et al. Switchable and orthogonal gene expression control inside artificial cells by synthetic riboswitches. Chem Commun, 2024, 60: 5972-5. |
| [15] |
Zhu C, Li Q, Dong M, et al. Giant unilamellar vesicle microarrays for cell function study. Anal Chem, 2018, 90: 14363-7. |
| [16] |
Zong W, Shao X, Li J, et al. Synthetic intracellular environments: from basic science to applications. Anal Chem, 2023, 95: 535-49. |
| [17] |
Ngocho K, Yang X, Wang Z, et al. Synthetic cells from droplet-based microfluidics for biosensing and biomedical applications. Small, 2024, 20: 2400086. |
| [18] |
Naeini SBM, Dadashzadeh S, Haeri A, et al. Multivesicular liposomes as a potential drug delivery platform for cancer therapy: a systematic review. J Drug Deliv Sci Technol, 2021, 66: 102842. |
| [19] |
Li C, Zhang X, Yang B, et al. Reversible deformation of artificial cell colonies triggered by actin polymerization for muscle behavior mimicry. Adv Mater, 2022, 34: 2204039. |
| [20] |
Zhu Y, Yang B, Chen S, et al. Polymer vesicles: mechanism, preparation, application, and responsive behavior. Prog Polym Sci, 2017, 64: 1-22. |
| [21] |
Hu X, Zhang Y, Xie Z, et al. Stimuli-responsive polymersomes for biomedical applications. Biomacromolecules, 2017, 18: 649-73. |
| [22] |
Wang Z, Zhang M, Zhou Y, et al. Coacervate microdroplets as synthetic protocells for cell mimicking and signaling communications. Small Methods, 2023, 7: 2300042. |
| [23] |
Gao N, Mann S. Membranized coacervate microdroplets: from versatile protocell models to cytomimetic materials. Acc Chem Res, 2023, 56: 297-307. |
| [24] |
Zhang X, Li C, Yang B, et al. Functional prototissues using artificial cells as building blocks and their biomedical applications. Adv Funct Mater, 2024, 34: 2405823. |
| [25] |
Zhang W, Wang X, Han X. Multilayer giant unilamellar vesicles as a model of artificial tissue for drug screen. Chem Phys Lett, 2019, 717: 34-7. |
| [26] |
Zong W, Thingholm B, Itel F, et al. Phospholipid-block copolymer hybrid vesicles with lysosomal escape ability. Langmuir, 2018, 34: 6874-86. |
| [27] |
Liu Z, Zhou W, Qi C, et al. Interface engineering in multiphase systems toward synthetic cells and organelles: from soft matter fundamentals to biomedical applications. Adv Mater, 2020, 32: 2002932. |
| [28] |
Bielka W, Przezak A, Molęda P, et al. Double diabetes--when type 1 diabetes meets type 2 diabetes: definition, pathogenesis and recognition. Cardiovasc Diabetol, 2024, 23: 62. |
| [29] |
Antar SA, Ashour NA, Sharaky M, et al. Diabetes mellitus: classification, mediators, and complications; A gate to identify potential targets for the development of new effective treatments. Biomed Pharmacother, 2023, 168: 115734. |
| [30] |
Committee ADAPP. 9. Pharmacologic approaches to glycemic treatment: standards of care in diabetes-2024. Diabetes Care, 2023, 47: S158-S78. |
| [31] |
Hoeg-Jensen T, Kruse T, Brand CL, et al. Glucose-sensitive insulin with attenuation of hypoglycaemia. Nature, 2024, 634: 944-51. DOI:10.1038/s41586-024-08042-3 |
| [32] |
Gu Z, Dang TT, Ma M, et al. Glucose-responsive microgels integrated with enzyme nanocapsules for closed-loop insulin delivery. ACS Nano, 2013, 7: 6758-66. |
| [33] |
Chen Z, Wang J, Sun W, et al. Synthetic beta cells for fusion-mediated dynamic insulin secretion. Nat Chem Biol, 2018, 14: 86-93. |
| [34] |
Yu J, Zhang Y, Ye Y, et al. Microneedle-array patches loaded with hypoxia-sensitive vesicles provide fast glucose-responsive insulin delivery. Proc Natl Acad Sci U S A, 2015, 112: 8260-5. |
| [35] |
Hu X, Yu J, Qian C, et al. H2O2-responsive vesicles integrated with transcutaneous patches for glucose-mediated insulin delivery. ACS Nano, 2017, 11: 613-20. |
| [36] |
Wang A, Fan W, Yang T, et al. Liver-target and glucose-responsive polymersomes toward mimicking endogenous insulin secretion with improved hepatic glucose utilization. Adv Funct Mater, 2020, 30: 1910168. |
| [37] |
de Gracia Lux C, Joshi-Barr S, Nguyen T, et al. Biocompatible polymeric nanoparticles degrade and release cargo in response to biologically relevant levels of hydrogen peroxide. J Am Chem Soc, 2012, 134: 15758-64. |
| [38] |
Lim ZW, Ping Y, Miserez A. Glucose-responsive peptide coacervates with high encapsulation efficiency for controlled release of insulin. Bioconjug Chem, 2018, 29: 2176-80. |
| [39] |
Li L, Zhang Y, Zeng C. Update on the epidemiology, genetics, and therapeutic options of hyperuricemia. Am J Transl Res, 2020, 12: 3167-81. |
| [40] |
Wang H, Zhang H, Sun L, et al. Roles of hyperuricemia in metabolic syndrome and cardiac-kidney-vascular system diseases. Am J Transl Res, 2018, 10: 2749-63. |
| [41] |
Li D, Yue X, Wang A, et al. Relieving urinary tract obstructions may increase the risk of gouty arthritis in patients with hyperuricemia and postrenal obstructions. Medicine, 2024, 103: e36911. |
| [42] |
Li Y, Lin Z, Wang Y, et al. Are hyperuricemia and gout different diseases?Comment on the guidelines for the diagnosis and management of hyperuricemia and gout with the healthcare professional perspectives in China. Int J Rheum Dis, 2023, 26: 1866-8. |
| [43] |
Zhuang M, Zhang Y, Zhou S, et al. Uricase-containing coacervate microdroplets as enzyme active membrane-free protocells for detoxification of uric acid in serum. Chem Commun, 2019, 55: 13880-3. |
| [44] |
Guttmann A, Krasnokutsky S, Pillinger MH, et al. Pegloticase in gout treatment-safety issues, latest evidence and clinical considerations. Ther Adv Drug Saf, 2017, 8: 379-88. |
| [45] |
Owens RE, Swanson H, Twilla JD. Hemolytic anemia induced by pegloticase infusion in a patient with G6PD deficiency. J Clin Rheumatol, 2016, 22: 97-8. |
| [46] |
Hu Q, Lan H, Tian Y, et al. Biofunctional coacervate-based artificial protocells with membrane-like and cytoplasm-like structures for the treatment of persistent hyperuricemia. J Control Release, 2024, 365: 176-92. |
| [47] |
Liu S, Zhang Y, Li M, et al. Enzyme-mediated nitric oxide production in vasoactive erythrocyte membrane-enclosed coacervate protocells. Nat Chem, 2020, 12: 1165-73. |
| [48] |
Zhang Y, Wang Z, Li M, et al. Osmotic-induced reconfiguration and activation in membranized coacervate-based protocells. J Am Chem Soc, 2023, 145: 10396-403. |
| [49] |
Wang Z, Long DW, Huang Y, et al. Fibroblast growth factor-1 released from a heparin coacervate improves cardiac function in a mouse myocardial infarction model. ACS Biomater Sci Eng, 2017, 3: 1988-99. |
| [50] |
Wang Z, Huang Y, He Y, et al. Myocardial protection by heparin-based coacervate of FGF10. Bioact Mater, 2021, 6: 1867-77. |
| [51] |
Chu H, Gao J, Chen CW, et al. Injectable fibroblast growth factor-2 coacervate for persistent angiogenesis. Proc Natl Acad Sci U S A, 2011, 108: 13444-9. |
| [52] |
Chu H, Chen C-W, Huard J, et al. The effect of a heparin-based coacervate of fibroblast growth factor-2 on scarring in the infarcted myocardium. Biomaterials, 2013, 34: 1747-56. |
| [53] |
Chen WCW, Lee BG, Park DW, et al. Controlled dual delivery of fibroblast growth factor-2 and Interleukin-10 by heparin-based coacervate synergistically enhances ischemic heart repair. Biomaterials, 2015, 72: 138-51. |
| [54] |
Chen G, Levin R, Landau S, et al. Implanted synthetic cells trigger tissue angiogenesis through de novo production of recombinant growth factors. Proc Natl Acad Sci U S A, 2022, 119: e2207525119. |
| [55] |
Zhang C, Zhu Y, Zhou C, et al. Antibacterial vesicles by direct dissolution of a block copolymer in water. Polym Chem, 2013, 4: 255-9. |
| [56] |
Jiang W, Xu H, Gao Z, et al. Artificial neutrophils against vascular graft infection. Adv Sci, 2024, 11: e2402768. |
| [57] |
Liang T, Dong Y, Cheng I, et al. In situ formation of biomolecular condensates as intracellular drug reservoirs for augmenting chemotherapy. Nat Biomed Eng, 2024, 8: 1469-82. |
| [58] |
Zhang Y, Yao Y, Liu S, et al. Coacervate microdroplet protocell-mediated gene transfection for nitric oxide production and induction of cell apoptosis. J Mater Chem B, 2021, 9: 9784-93. |
| [59] |
Zhang Y, Liu S, Yao Y, et al. Invasion and defense interactions between enzyme-active liquid coacervate protocells and living cells. Small, 2020, 16: 2002073. |
| [60] |
Krinsky N, Kaduri M, Zinger A, et al. Synthetic cells synthesize therapeutic proteins inside tumors. Adv Healthc Mater, 2018, 7: 1701163. |
| [61] |
Li R, Wu J, Lin Z, et al. Single injection of a novel nerve growth factor coacervate improves structural and functional regeneration after sciatic nerve injury in adult rats. Exp Neurol, 2017, 288: 1-10. |
| [62] |
Gottipati MK, D'Amato AR, Saksena J, et al. Delayed administration of interleukin-4 coacervate alleviates the neurotoxic phenotype of astrocytes and promotes functional recovery after a contusion spinal cord injury. J Neural Eng, 2024, 21: 046052. |
| [63] |
Toparlak ÖD, Zasso J, Bridi S, et al. Artificial cells drive neural differentiation. Sci Adv, 2020, 6: eabb4920. |
| [64] |
Yin N, Zhang W, Sun XX, et al. Artificial cells delivering itaconic acid induce anti-inflammatory memory-like macrophages to reverse acute liver failure and prevent reinjury. Cell Rep Med, 2023, 4: 101132. |
| [65] |
Tian Y, Hu Q, Sun Z, et al. Colon targeting pH-responsive coacervate microdroplets for treatment of ulcerative colitis. Small, 2024, 20: 2311890. |
| [66] |
Li H, Johnson NR, Usas A, et al. Sustained release of bone morphogenetic protein 2 via coacervate improves the osteogenic potential of muscle-derived stem cells. Stem Cells Transl Med, 2013, 2: 667-77. |
| [67] |
Gao X, Hwang MP, Wright N, et al. The use of heparin/polycation coacervate sustain release system to compare the bone regenerative potentials of 5 BMPs using a critical sized calvarial bone defect model. Biomaterials, 2022, 288: 121708. |
| [68] |
Park U, Lee MS, Jeon J, et al. Coacervate-mediated exogenous growth factor delivery for scarless skin regeneration. Acta Biomater, 2019, 90: 179-91. |
| [69] |
Wang C, Yang X, Wang Q, et al. Glucose responsive coacervate protocells from microfluidics for diabetic wound healing. Adv Sci, 2024, 11: 2400712. |
| [70] |
Pacholko A, Iadecola C. Hypertension, neurodegeneration, and cognitive decline. Hypertension, 2024, 81: 991-1007. |
| [71] |
McEvoy JW, McCarthy CP, Bruno RM, et al. 2024 ESC guidelines for the management of elevated blood pressure and hypertension: developed by the task force on the management of elevated blood pressure and hypertension of the European Society of Cardiology (ESC) and endorsed by the European Society of Endocrinology (ESE) and the European Stroke Organisation (ESO). Eur Heart J, 2024, 45: 3912-4018. |
| [72] |
Burnier M, Damianaki A. Hypertension as cardiovascular risk factor in chronic kidney disease. Circ Res, 2023, 132: 1050-63. |
| [73] |
Boehme AK, Esenwa C, Elkind MSV. Stroke risk factors, genetics, and prevention. Circ Res, 2017, 120: 472-95. |
| [74] |
Reis A, Rocha BS, Laranjinha J, et al. Dietary (poly) phenols as modulators of the biophysical properties in endothelial cell membranes: its impact on nitric oxide bioavailability in hypertension. FEBS Lett, 2024, 598: 2190-210. |
| [75] |
Griendling KK, Camargo LL, Rios FJ, et al. Oxidative stress and hypertension. Circ Res, 2021, 128: 993-1020. |
| [76] |
Leo F, Suvorava T, Heuser SK, et al. Red blood cell and endothelial eNOS independently regulate circulating nitric oxide metabolites and blood pressure. Circulation, 2021, 144: 870-89. |
| [77] |
Zhang X, Li C, Liu F, et al. High-throughput production of functional prototissues capable of producing NO for vasodilation. Nat Commun, 2022, 13: 2148. |
| [78] |
Onnis C, Virmani R, Kawai K, et al. Coronary artery calcification: current concepts and clinical implications. Circulation, 2024, 149: 251-66. |
| [79] |
Segers VFM, Lee RT. Protein therapeutics for cardiac regeneration after myocardial infarction. J Cardiovasc Transl Res, 2010, 3: 469-77. |
| [80] |
Orrego CM, Torre-Amione G. Is myocardial ischemia the cause of the progressive decrease in ejection fraction during acute decompensated heart failure?. J Card Fail, 2009, 15: S27. |
| [81] |
Liu Y, Li L, Wang Z, et al. Myocardial ischemia-reperfusion injury; Molecular mechanisms and prevention. Microvasc Res, 2023, 149: 104565. |
| [82] |
Chu H, Wang Y. Therapeutic angiogenesis: controlled delivery of angiogenic factors. Ther Deliv, 2012, 3: 693-714. |
| [83] |
Rochais F, Sturny R, Chao CM, et al. FGF10 promotes regional foetal cardiomyocyte proliferation and adult cardiomyocyte cell-cycle re-entry. Cardiovasc Res, 2014, 104: 432-42. |
| [84] |
Rubin N, Darehzereshki A, Bellusci S, et al. FGF10 signaling enhances epicardial cell expansion during neonatal mouse heart repair. J Cardiovasc Dis Diagn, 2013, 1: 101. |
| [85] |
Seghezzi G, Patel S, Ren CJ, et al. Fibroblast growth factor-2(FGF-2) induces vascular endothelial growth factor (VEGF) expression in the endothelial cells of forming capillaries: an autocrine mechanism contributing to angiogenesis. J Cell Biol, 1998, 141: 1659-73. |
| [86] |
Rosenblatt-Velin N, Lepore MG, Cartoni C, et al. FGF-2 controls the differentiation of resident cardiac precursors into functional cardiomyocytes. J Clin Invest, 2005, 115: 1724-33. |
| [87] |
Buehler A, Martire A, Strohm C, et al. Angiogenesis-independent cardioprotection in FGF-1 transgenic mice. Cardiovasc Res, 2002, 55: 768-77. |
| [88] |
Xu D, Esko JD. Demystifying heparan sulfate-protein interactions. Annu Rev Biochem, 2014, 83: 129-57. |
| [89] |
Smith RAA, Luo X, Lu X, et al. Enhancing BMP-2-mediated osteogenesis with a synthetic heparan sulfate mimetic. Biomater Adv, 2023, 155: 213671. |
| [90] |
Ravikumar M, Smith RAA, Nurcombe V, et al. Heparan sulfate proteoglycans: key mediators of stem cell function. Front Cell Dev Biol, 2020, 8: 581213. |
| [91] |
Wang X, Du H, Wang Z, et al. Versatile phospholipid assemblies for functional synthetic cells and artificial tissues. Adv Mater, 2021, 33: 2002635. |
| [92] |
Wei X, Wang Y, Liu Y, et al. Biomimetic design strategies for biomedical applications. Matter, 2024, 7: 826-54. |
| [93] |
Liew PX, Kubes P. The neutrophil's role during health and disease. Physiol Rev, 2019, 99: 1223-48. |
| [94] |
Bajracharya R, Song JG, Patil BR, et al. Functional ligands for improving anticancer drug therapy: current status and applications to drug delivery systems. Drug Deliv, 2022, 29: 1959-70. |
| [95] |
Pacheco C, Baião A, Ding T, et al. Recent advances in long-acting drug delivery systems for anticancer drug. Adv Drug Deliv Rev, 2023, 194: 114724. |
| [96] |
Zhang X, Zong W, Bi H, et al. Hierarchical drug release of pH-sensitive liposomes encapsulating aqueous two phase system. Eur J Pharm Biopharm, 2018, 127: 177-82. |
| [97] |
Zhang X, Zong W, Wang J, et al. Multicompartmentalized vesosomes containing DOX loaded liposomes and 5FU loaded liposomes for synergistic tumor treatment. New J Chem, 2019, 43: 4895-9. |
| [98] |
Li M, Cui X, Li C, et al. Neutrophil membrane camouflaged hybrid nanozymes for enhanced starvation/photothermal tumor therapy. New J Chem, 2022, 46: 17456-68. |
| [99] |
Shen W, Li C, Liu Q, et al. Celastrol inhibits oligodendrocyte and neuron ferroptosis to promote spinal cord injury recovery. Phytomedicine, 2024, 128: 155380. |
| [100] |
Rezaee D, Saadatpour F, Akbari N, et al. The role of microRNAs in the pathophysiology of human central nervous system: a focus on neurodegenerative diseases. Ageing Res Rev, 2023, 92: 102090. |
| [101] |
Heiman A, Pallottie A, Heary RF, et al. Toll-like receptors in central nervous system injury and disease: a focus on the spinal cord. Brain Behav Immun, 2014, 42: 232-45. |
| [102] |
Goluba K, Kunrade L, Riekstina U, et al. Schwann cells in digestive system disorders. Cells, 2022, 11: 832. |
 2025, Vol. 37
2025, Vol. 37 

 韩晓军,国家级高层次人才,英国皇家化学会会士,哈尔滨工业大学长聘教授/系主任。1998年毕业于吉林大学,获学士学位;2003年毕业于中国科学院长春应用化学研究所,获博士学位;2003—2009年,在英国利兹大学和瑞士保罗谢勒研究所从事博士后研究工作;2009年10月起任哈尔滨工业大学教授。主要开展生物和化学交叉方向研究,迄今在Nature Communications等刊物上发表论文230多篇,获黑龙江省科学技术奖2项(排名第一位)
韩晓军,国家级高层次人才,英国皇家化学会会士,哈尔滨工业大学长聘教授/系主任。1998年毕业于吉林大学,获学士学位;2003年毕业于中国科学院长春应用化学研究所,获博士学位;2003—2009年,在英国利兹大学和瑞士保罗谢勒研究所从事博士后研究工作;2009年10月起任哈尔滨工业大学教授。主要开展生物和化学交叉方向研究,迄今在Nature Communications等刊物上发表论文230多篇,获黑龙江省科学技术奖2项(排名第一位)