(2 首都医科大学附属北京佑安医院超声科,北京 100069)
(3 国家纳米科学中心,北京 100190)
(4 中国科学院大学,北京 100049)
(2 Department of Ultrasound, Beijing You 'an Hospital, Capital Medical University, Beijing 100069, China)
(3 National Center for Nanoscience and Technology of China, Beijing 100190, China)
(4 University of Chinese Academy of Sciences, Beijing 100049, China)
肺癌目前是全球范围内发病率、死亡率都位居前列的癌种之一[1]。根据我国癌症数据报告,2022年,肺癌新发病例为106.06万例,发病率为75.13/10万,平均每天新增肺癌诊断病例超过2900例;肺癌死亡病例为73.33万例,占所有部位癌症死亡率总和的28.5%,平均每天有2 000多人死于肺癌[2],对社会经济和健康造成了巨大负担。早期肺癌患者优选的治疗手段是手术[3];对于局部晚期和转移性癌症,则建议使用化疗和放疗,包括新辅助和(或)辅助治疗,但对总体生存期的改善有限,且常会造成较严重的毒副作用[4, 5]。靶向治疗联合化疗也已经成为具有驱动基因改变的非小细胞肺癌患者的标准疗法,较化疗而言,其毒副作用较小,在某些情况下可提高无进展生存期和总体生存期[6],但是,该治疗策略并不是对所有患者都适用,大多数患者后期会因为耐药对治疗失去反应[7, 8]。尽管手术、化疗、放疗和靶向药物等多种抗癌策略被用于肺癌治疗,但总体来看,肺癌患者的五年生存率仅为36.9%,晚期肺癌患者的五年生存率更低[9]。因此,仍迫切需要更为有效的治疗策略。
免疫治疗具有安全性较高、免疫记忆能够带来持续的免疫应答从而有效控制肺癌,以及对晚期肺癌患者治疗有效等特征,正在深刻改变肺癌的治疗[10, 11]。免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)目前已经被广泛应用于肺癌的治疗[12, 13]。但是,这类针对特定抗原的单克隆抗体治疗效果常依赖于肿瘤的突变负荷,有很大一部分患者并不能从治疗中获益[14]。
免疫细胞是免疫系统非常重要的组成部分,最近的研究完善了我们对过继性免疫细胞治疗对肺癌的影响以及如何增强它的理解,显著拓宽了肺癌免疫治疗的可能[15, 16]。CAR-T疗法,即嵌合抗原受体(chimeric antigen receptor, CAR)-T细胞免疫疗法,是过继免疫细胞疗法的经典组成部分,医学技术人员通过基因工程技术,将T细胞激活,并装上“定位导航装置”——肿瘤嵌合抗原受体,形成CAR-T细胞。CAR可专门识别体内肿瘤细胞,并通过免疫作用释放大量的多种效应因子,高效地杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的[17]。在这一过程中,基因工程技术发挥了十分重要的作用,它是一种在分子水平上对基因进行操作的复杂技术,是合成生物学重要的分支[18, 19]。合成生物学是一个新兴的,利用分子生物学技术和工具对细胞的行为进行设计和操纵的研究领域,通过合成生物学方法能够设计和生成具有特定功能的活细胞,已被应用于疫苗开发、再生医学和细胞治疗等,癌症的细胞治疗是其重要组成部分,基于合成生物学技术的免疫细胞改造,有望创造出更为智能的免疫细胞应用于肺癌的治疗[20]
本文将从先天性免疫和适应性免疫两个方面,重点综述合成生物学技术改造免疫细胞膜及其外泌体用于肺癌治疗的基础研究和临床应用,并探讨该治疗策略面临的挑战及未来发展方向。
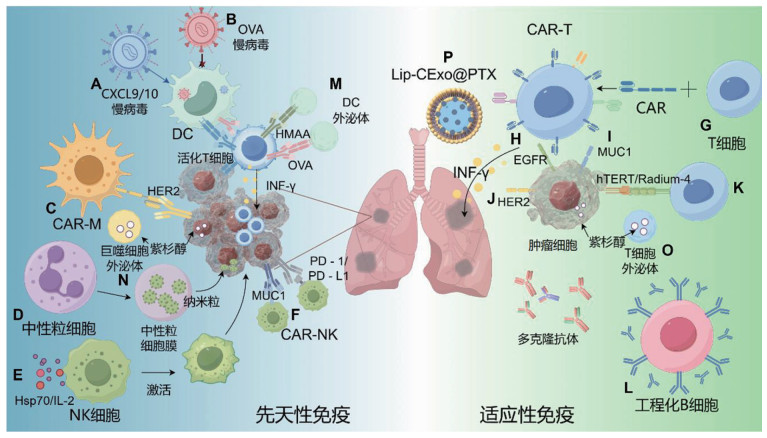
1 免疫细胞膜工程化改造 1.1 树突状细胞树突状细胞(dendritic cell, DC)作为抗原递呈细胞,在肿瘤抗原的呈递过程中发挥重要作用[21]。趋化因子是促进T细胞在肿瘤微环境中募集的重要介质,C-X-C基序趋化因子配体9 (C-X-C motif chemokine ligand 9, CXCL9)和CXCL10是干扰素γ (interferon gamma, IFN-γ)诱导的趋化因子,主要由驻留在肿瘤中的CD103+ DC和肿瘤相关巨噬细胞分泌[22, 23]。CXCL9/10通过C-X-C基序趋化因子受体3 (C-X-C motif chemokine receptor 3, CXCR3)发出信号,促进CXCR3效应T细胞在肿瘤中浸润。使用编码CXCL9/10的慢病毒转染DC,生成工程化CXCL9/10- DC,瘤内注射,可以克服ICIs耐药,促进宿主免疫激活,建立全身性肿瘤特异性免疫,增强ICIs用于非小细胞肺癌(non-small cell lung cancer, NSCLC)治疗的疗效(图 1A)[24]。使用编码淋巴细胞分化簇(cluster of differentiation, CD)40配体、CD70和组成型活性Toll样受体4的mRNA进行电穿孔可以更高效、快速地促进DC成熟,成熟后的DC可以搭载肿瘤抗原,进而激活T细胞,发挥肿瘤疫苗作用[25]。DC还可以靶向特定的肿瘤相关抗原(tumor associated antigen, TAA),使用由癌胚抗原(carcino-embryonic antigen, CEA)的人类白细胞抗原(human leukocyte antigen, HLA)- A24特异性肽衍生的肽脉冲刺激的DC,治疗血清CEA升高的转移性或复发性NSCLC或结直肠癌可观察到部分患者病情长期稳定或血清CEA水平显著下降[26, 27]。黏蛋白1 (mucin 1, MUC1)是一种与癌细胞黏附转移相关的跨膜蛋白[28],MUC1脉冲刺激的DC在治疗MUC1阳性的NSCLC患者时,也得到了类似的结果[29]。将表达人类表皮生长因子受体2 (human epidermal growth factor receptor 2, HER2)细胞外和跨膜结构域的腺病毒载体转导进入DC,用于治疗HER2阳性的转移性肿瘤患者,显示出良好的免疫原性和初步的临床获益,并且具有良好的安全性(表 1)[30]。通过向DC转入编码TAA-卵清蛋白(ovalbumin, OVA)基因的慢病毒载体质粒来修饰DC,并在体外、体内测试其抗肿瘤作用,发现用TAA生物工程改造的DC可以促进T细胞增殖,促进幼稚的T细胞向细胞毒性T细胞转化,增强抗肿瘤作用(图 1B)[31]。糖皮质激素诱导的肿瘤坏死因子受体及其配体(glucocorticoid-induced tumor necrosis factor receptor and ligand, GITRL)在免疫反应的调节中起关键作用。向骨髓来源的树突状细胞(bone marrow derived dendritic cells, BMDC)转染表达GITRL的重组腺病毒用于Lewis肺癌治疗,明显增强了CD8+ T细胞增殖,促进了IFNγ的产生,消除了对Treg细胞的抑制,延缓了肿瘤生长[32]。以上的结果都说明DC在肿瘤抗原呈递和T细胞募集中起关键作用,对DC进行工程化改造能够增强抗肿瘤免疫反应,对肺癌等肿瘤患者的治疗具有重要意义。
|
图 1 合成生物学技术对免疫细胞的改造用于肺癌的治疗(本图由Figdraw绘制) |
| 表 1 已取得结论的临床试验 |
一般认为,巨噬细胞按照激活状态和功能可以分为三种表型,M0型巨噬细胞为无活性型,M1型巨噬细胞是抗肿瘤表型,而M2型巨噬细胞是促肿瘤表型[33, 34]。CAR-T细胞疗法在血液系统恶性肿瘤展现良好疗效,这为其他免疫细胞CAR改造提供了理论基础和实践依据。鉴于巨噬细胞独特的效应功能及其穿透肿瘤的能力,用CAR对人巨噬细胞进行基因工程改造,产生CAR-M细胞,可使其具有持续的M1表型。原代人抗HER2 CAR-M显示出对HER2阳性肿瘤细胞的抗原特异性吞噬作用(图 1C),促进炎性细胞因子和趋化因子产生,将M2型巨噬细胞向M1型转化,促进抗原递呈,募集抗原并将其呈递给T细胞,增强T细胞抗肿瘤活性,对卵巢癌的肺转移具有治疗作用[35]。CAR-M还可通过诱导相关肿瘤细胞上主要组织相容性复合体(major histocompatibility complex, MHC) Ⅰ/Ⅱ表达的上调,调节肿瘤微环境,进而促进肿瘤相关抗原向T细胞递呈[36]。目前CAR-M主要应用于卵巢癌、乳腺癌、胰腺癌等,应用于肺癌的治疗仍需要进一步探索[37-39]。
1.3 粒细胞中性粒细胞相关的炎症微环境有助于肿瘤细胞在肺部转移定植,促进肿瘤肺转移的发生[40],但是,目前通过对粒细胞的改造应用于肺癌治疗的研究较少。有研究使用中性粒细胞膜作为纳米颗粒的载体,以增强肿瘤靶向性,减少免疫系统对纳米颗粒的清除。使用中性粒细胞膜包覆伪装负载地西他滨、抗‐CD11b和IR820偶联抗体及牛血清白蛋白纳米粒。由于中性粒细胞对肿瘤的生物嗜性,可以实现纳米颗粒的高效肿瘤递送(图 1D),在肿瘤部位释放的地西他滨,上调gasdermin E蛋白,通过激光照射激活caspase-3,从而诱导细胞焦亡,调节免疫抑制微环境以进行有效的肿瘤免疫治疗,并诱导持久而强大的免疫记忆以防止肺转移发生[41]。
1.4 自然杀伤细胞自然杀伤(natural killer, NK)细胞可以产生细胞因子促进辅助性T细胞极化和T细胞活化,还可以刺激DC细胞及B细胞成熟,架起了协调先天免疫和适应性免疫的桥梁[42, 43]。热激蛋白70 (heat shock protein 70, Hsp70)在包括肺癌在内的多种实体癌细胞膜上高表达,使用Hsp70肽和白介素(interleukin, IL)-2共激活的NK细胞可以特异性地识别膜形式的Hsp70,将Hsp70肽和IL-2共激活的自体NK细胞回输患者体内,对于肺癌和脑肿瘤具有显著的疗效(图 1E)[44]。将Hsp70肽和IL-2共激活的自体NK细胞与程序性死亡受体1 (programmed cell death protein 1, PD-1)免疫检查点抑制剂联用,增加肿瘤部位CD8+ T细胞和NK细胞浸润,可以实现肿瘤的长期控制[45]。使用IL-15和氢化可的松共刺激NK细胞,静脉输注可以延长患者无进展生存期(表 1)[46]。CAR-NK是一种通过在NK细胞表面表达特定抗原识别结构域来增强其靶向性和杀伤力的技术。CAR-NK细胞相对于CAR-T细胞具有不依赖MHC、不发生移植物抗宿主反应和相对较短的寿命等优势。针对PD-1/PD-L1、NKG2D配体、MUC1和HER2的CAR-NK细胞系在转移性、耐药性实体瘤患者临床应用中的安全性、有效性正在研究当中(图 1F)[47-49],目前多应用于肉瘤、神经母细胞瘤、乳腺癌等,在肺癌中的应用还需要进一步探索。
1.5 T淋巴细胞CAR-T细胞疗法是一种基于肿瘤表面抗原靶向的工程化免疫细胞治疗技术,通过精密设计的嵌合抗原受体重塑T细胞的功能,从而实现特异性杀伤肿瘤细胞[50]。CAR是一种由抗原结合域和T细胞激活域组成的人工受体,能够绕过传统的肽-MHC途径,直接激活T细胞。该疗法通常通过提取患者的T细胞,在体外利用基因工程技术改造使其表达特定的CAR,随后将工程化细胞回输到患者体内,从而实现对表达目标抗原(包括细胞表面蛋白、糖类及糖脂)的肿瘤细胞的高效清除[51]。
在合成生物学的推动下,CAR-T细胞的设计与优化取得了快速进展,展现了从受体结构到信号机制的高度可编程性。CAR的模块化结构通常包括细胞外抗原识别域、铰链区、跨膜区和细胞内信号转导域。第一代CAR仅包含CD3ζ胞内信号域,因其激活信号单一,T细胞反应较为有限;第二代CAR通过整合单个共刺激信号域(如CD28或4-1BB)显著提升了抗肿瘤效果;第三代CAR进一步加入多个共刺激信号域以增强T细胞的增殖和持久性。在此基础上,第四代CAR引入了基因回路设计,使其能够分泌治疗性细胞因子或利用细胞因子受体信号域增强其功能,为免疫调节提供了更多可能性。而第五代CAR通过整合IL-2受体β片段,试图利用Janus激酶(Janus kinase, JAK)和信号转导及转录激活因子(signal transducer and activator of transcription, STAT)信号通路进一步优化抗肿瘤活性,但其在安全性和有效性方面仍需大量研究验证(图 1G)[51-53]。合成生物学的核心思想赋予了CAR-T细胞高度的工程化和功能化能力。从定制化的抗原识别域设计到信号转导模块的组合优化,以及外源性基因回路的引入,这些技术极大地拓展了CAR-T细胞的应用潜力,不仅能够用于复杂肿瘤的靶向治疗,还为免疫细胞膜的功能化和多样化提供了重要工具。
将CAR-T细胞技术应用于肺癌治疗的关键在于精准选择TAA。理想的TAA应在肿瘤细胞膜上高表达,而在正常组织中低表达或完全不表达。然而,针对实体瘤的TAA筛选常面临挑战,这也限制了CAR-T细胞在实体瘤中的应用。表皮生长因子受体(epidermal growth factor receptor, EGFR)是一个在多种实体瘤中显著高表达的重要靶点,它不仅驱动肿瘤血管生成、转移及复发,还在NSCLC原发肿瘤及脑转移组织中表现出显著上调的表达特征,因而被广泛认为是NSCLC治疗中的潜在理想靶点[54-57]。抗EGFR CAR-T细胞在改善EGFR阳性复发/难治性NSCLC患者预后方面展现出显著疗效,并且在保持较低毒副作用的同时实现了更高的治疗特异性(图 1H)。这种CAR-T细胞通过识别并结合EGFR高表达的肿瘤细胞膜,触发细胞毒性反应并释放IFN-γ和肿瘤坏死因子α (tumor necrosis factor α, TNF-α)等效应分子,从而有效抑制肿瘤生长并清除肿瘤细胞[58, 59]。
PD-1/PD-L1免疫检查点抑制剂是肺癌免疫治疗的重要组成部分,已在多项研究中表现出良好的安全性和有效性。基于合成生物学的设计理念,针对PD-L1的CAR-T细胞疗法成为研究的热点之一。然而,一项针对晚期肺癌患者的抗PD-L1 CAR-T细胞免疫治疗I期临床试验因严重不良反应事件而遗憾终止[60, 61]。除PD-L1外,MUC1是小细胞肺癌治疗的另一个重要靶点,已被证明在肿瘤细胞中异常高表达。敲低MUC1的表达能够显著抑制肺癌细胞增殖并诱导肿瘤细胞凋亡。目前,针对MUC1的CAR-T细胞疗法已进入临床试验阶段(图 1I)[62]。一项正在进行的Ⅱ期临床试验正在评估抗MUC1 CAR-T细胞联合PD-1基因敲除的双重改造策略在晚期NSCLC中的安全性和有效性[63],这种多重工程化设计展示了合成生物学在免疫疗法优化中的潜力。此外,HER2在部分肺癌患者中高表达,针对HER2的CAR-T细胞也正在进行临床研究(图 1J)。然而,目前尚缺乏其在安全性和疗效方面的详细报道。另一类潜在的CAR-T靶点包括失活的酪氨酸蛋白激酶样孤儿受体1 (tyrosine kinase-like orphan receptor 1, ROR1)和CEA,这些靶点的选择进一步拓宽了CAR-T细胞治疗的适应证范围[64, 65]。同时应用两种或两种以上靶标的CAR-T细胞也在开发当中,研究者们期望可以通过多靶点的联用提高治疗效率及安全性,减少对正常细胞及其他系统的影响。
针对肺癌治疗的CAR-T细胞疗法,目前仍处于早期探索阶段,临床研究进展较为缓慢,疗效亦有限。与血液系统疾病治疗相比,CAR-T细胞在实体瘤如肺癌中的应用面临诸多独特挑战,包括须克服肿瘤特异性靶点与非肿瘤组织的交叉反应导致的靶内/肿瘤外毒性、免疫抑制性肿瘤微环境、TAAs的异质性,以及可能引发的神经毒性和细胞因子释放综合征等问题[64]。
除了CAR-T细胞,通过合成生物学手段改造T细胞以表达高亲和性受体也是一种重要策略。Radium-4是一种能够识别MHC Ⅱ分子呈递的肿瘤相关抗原人类端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)的高亲和性T细胞受体(T cell receptor, TCR)。hTERT在大多数癌症中高表达,作为一种理想的肿瘤相关抗原,Radium-4与hTERT的特异性结合为肺癌治疗提供了一个潜在靶点(图 1K)。在一项Ⅰ/Ⅱ期研究中,研究者通过电穿孔技术将Radium-4 mRNA转入自体T细胞中,再将工程化T细胞回输至患者体内,以评估其在治疗转移性NSCLC时的安全性和有效性。然而,遗憾的是,该临床试验尚未得出明确结果[66]。此外,KRAS作为最常见的驱动癌基因之一,与多种癌症的发生密切相关。基于KRAS的高亲和性TCR开发,能够赋予T细胞选择性识别并杀伤高表达KRAS突变体的癌细胞能力[67],为肺癌治疗提供了新的思路。
1.6 B淋巴细胞工程化的B淋巴细胞通过嵌合构象的B细胞表位肽实现了细胞膜功能的重新设计,使其能够激活更持久的免疫反应。这些表位肽设计优化了与PD-1靶点的结合能力,从而诱导生成具有高亲和力的多克隆抗体,其功能效价与传统PD-1单克隆抗体相当(图 1L)。目前,该类工程化B细胞的应用已在NSCLC患者中进入Ⅰ期临床试验阶段[68]。尽管抗肿瘤免疫研究通常聚焦于T细胞介导的免疫反应,但通过合成生物学方法对体液免疫进行功能性增强的研究表明,B细胞改造在肿瘤免疫治疗中同样具有重要潜力。
2 免疫细胞来源外泌体工程化改造外泌体(exosomes)是由多种活细胞分泌的,直径30~150 nm的细胞外囊泡,具备稳定性高、低免疫原性和天然靶向性等特性,在肿瘤治疗中具有显著优势[69]。合成生物学为外泌体的工程化改造提供了新方法,包括载药(如化疗药物、核酸分子)和靶向修饰(如表面连接特异性配体或抗体),从而增强递送效率和靶向性[70]。相比传统药物递送系统,外泌体可高效穿越生物屏障(如血脑屏障),实现抗肿瘤因子的精准递送,同时降低副作用[71]。外泌体的多功能性和高效性使其成为肿瘤治疗研究的重要方向,为免疫细胞外泌体改造的临床转化奠定了基础。
2.1 树突状细胞来源外泌体DC衍生的外泌体(Dex)是直径为50~150 nm的分泌型细胞外囊泡,可以通过直接暴露MHC和共刺激分子来调节免疫应答(表 1)[72, 73],也可以通过将内部组分间接传送到周围细胞来调节免疫应答,能够维持DC的关键功能,呈递TAA和激活TAA特异性免疫反应,触发NK细胞反应[74]。使用载有人黑色素瘤相关抗原(human melanoma-associated antigen, HMAA)的自体Dex治疗9例晚期NSCLC患者,所有患者均具有良好的耐受性,虽然仅检测到肽特异性T细胞活性的微小增加,但NK细胞裂解活性上调,并且在部分患者上观察到了疾病的长期稳定控制[75]。使用INF-γ调节DC以诱导Dex上CD40、CD80、CD86和CD54的表达,可以使其在体外和体内具有直接和有效的CD8+ T细胞激活作用,将诱导后的Dex用于不能手术的非小细胞肺癌患者,观察到至少50%的患者在化疗停止后达到4个月无进展生存期(表 1)[76]。使用OVA蛋白脉冲刺激Dex可以在体内更有效地诱导初始OVA特异性CD8+ T细胞增殖并分化为细胞毒性T淋巴细胞,产生有效的抗肿瘤免疫(图 1M)[77, 78]。Dex具有调节免疫应答、呈递TAA和激活特异性免疫反应等功能,在晚期NSCLC患者的治疗中显示出良好的耐受性和潜在的抗肿瘤效果,通过调节或刺激Dex可以增强其免疫激活作用。
2.2 巨噬细胞来源外泌体巨噬细胞来源外泌体常与亲代有相似的功能。使用LPS将提取的原代小鼠巨噬细胞极化为M1表型,并采用“抗原喂养”的方式制备携带OVA抗原的工程巨噬细胞外泌体疫苗,可改善免疫抑制微环境,增强对肿瘤生长和转移的抑制作用[79]。向巨噬细胞来源外泌体中掺入氨基乙基茴香酰胺-聚乙二醇载体,可以靶向肺癌细胞过表达的sigma受体,作为紫杉醇药物载体,显著提高了药物在癌细胞中累积,改善治疗效果(图 1N)[80]。通过工程化改造巨噬细胞来源的外泌体制备携带抗原的疫苗可以改善免疫抑制微环境并增强对肿瘤的抑制作用,也可将其作为药物载体靶向肿瘤细胞以提高治疗效果。
2.3 NK细胞来源外泌体除了NK细胞外,来自NK细胞的外泌体也表现出抗肿瘤特性,高灵敏度和特异度的外泌体分离技术可以在未来实现个性化的NK细胞外泌体介导的肿瘤治疗。一种基于微流控系统的NK-氧化石墨烯芯片能够从非小细胞肺癌患者体内分离出具有循环肿瘤细胞杀伤功能的NK细胞外泌体,为后续患者特异性NK细胞免疫疗法打下基础[81]。
2.4 T细胞来源外泌体在CAR-T细胞疗法处于肺癌治疗探索阶段的背景下,研究者们将关注点也投向了通过合成生物学技术改造CAR-T细胞衍生外泌体。表达抗间皮素(mesothelin, MSLN)CAR的CAR-T细胞,其分泌的外泌体被设计为紫杉醇(PTX)的药物载体(图 1O)。通过吸入负载紫杉醇的CAR-T细胞外泌体,不仅可以增强肿瘤部位CD8+ T细胞的浸润,还能显著提高IFN-γ和TNF-α的分泌水平,从而有效缩小MSLN阳性肺癌肿瘤体积,降低药物毒性并延长患者生存期[82]。进一步的工程化策略结合了合成生物学与纳米技术,通过将靶向MSLN和PD-L1的双特异性CAR-T细胞衍生外泌体与肺靶向脂质体融合,开发出名为Lip-CExo@PTX的杂交纳米囊泡,用于肺癌的免疫化疗(图 1P)。该系统可实现药物向MSLN阳性肿瘤的高效递送,降低药物的全身毒性,同时通过其携带的抗PD-L1单链抗体可变区基因片段(single-chain antibody variable region gene fragment, scFv)阻断PD-L1的功能,避免T细胞耗竭,并通过增强PTX诱导的免疫原性细胞死亡(immunogenic cell death, ICD),显著提升抗肿瘤疗效[83]。
除对CAR-T细胞外泌体的工程化改造外,合成生物学技术还被用于对其他免疫细胞进行基因重编程。例如,对人原代CD8+ T细胞进行基因编辑,使其分泌表面携带白介素-2 (IL-2)和抗EGFR单克隆抗体(西妥昔单抗)的外泌体。该外泌体对A549人肺癌细胞表现出直接的细胞毒性,并显著增强了癌细胞对人外周血单核细胞介导细胞毒性的易感性。此外,该工程化外泌体能够以EGFR依赖性方式高效靶向肺癌细胞,从而实现精准治疗[84]。这一系列研究表明,通过合成生物学策略改造免疫细胞来源的外泌体不仅可以实现更高效的药物递送,还能激发更强的抗肿瘤免疫反应,为肺癌治疗提供了新的前景。
3 讨论与展望合成生物学技术的快速发展为根据患者特异性肿瘤特征设计个性化免疫细胞膜改造策略提供了新的可能。这些策略通过重新编程免疫细胞的膜蛋白组和功能模块,实现了增强靶向性和抗肿瘤效能的目标,从而显著提升治疗的精准性和效果[85]。然而,对于肺癌等实体瘤而言,选择合适的靶点仍然是CAR细胞疗法等免疫疗法亟待解决的主要挑战之一[86, 87]。理想的肿瘤抗原应在肿瘤细胞中高表达而在正常组织中低表达或不表达,但肺癌细胞的抗原异质性显著,不仅不同患者之间存在抗原表达模式的差异,即便同一患者体内的肿瘤细胞也可能呈现多样化的抗原谱。这种异质性限制了单一靶点CAR细胞疗法在实体瘤中的疗效[88-90]。同时,肺癌的肿瘤微环境复杂且具有免疫抑制性,往往削弱了免疫疗法的有效性。因此,开发多靶点联合CAR细胞疗法,通过同时靶向多个TAA提升疗效,并减少脱靶效应[91]。
与此同时,免疫细胞来源的外泌体作为一种天然的生物递送平台,因其稳定的结构、生物相容性以及可工程化的特性,正在成为肿瘤治疗领域的关键工具,在肺癌治疗中具有广阔的应用前景。通过合成生物学方法改造外泌体,可以增强其在肿瘤部位的靶向性,减少毒副作用,并显著提高药物在肿瘤局部的积累[92]。此外,进一步地,将外泌体与ICIs或CAR细胞疗法结合,有望显著提高肺癌等恶性肿瘤的治疗效果[93]。
在TME中,抑制性免疫细胞如调节性T细胞和髓系抑制性细胞的大量存在对T细胞和NK细胞的抗肿瘤活性形成显著抑制。此外,肿瘤细胞分泌的促炎性细胞因子和趋化因子可重新编程免疫细胞,使其向促肿瘤表型(如M2型巨噬细胞)转变,进一步加剧肿瘤生长和转移[94, 95]。通过合成生物学技术改造DC、巨噬细胞以及NK细胞,以增强其抗肿瘤免疫应答是解决这一挑战的重要策略。
尽管这一领域取得了显著进展,工程化免疫细胞在从基础研究到临床转化的过程中仍面临诸多挑战。潜在的安全性问题、脱靶效应以及肿瘤异质性带来的治疗难度仍然突出[96, 97]。肿瘤细胞可能通过下调表面抗原或激活免疫逃逸机制规避改造免疫细胞的攻击,导致疗效降低。此外,免疫细胞膜修饰可能意外靶向正常组织,诱发严重副作用,导致“靶内毒性”,如在治疗急性淋巴细胞白血病的过程中,患者因CAR-T细胞脱靶攻击导致严重的正常B细胞耗竭和免疫缺陷[98]。此外,CAR-T细胞的快速激活可能引发细胞因子风暴,表现为全身炎症反应综合征(cytokine release syndrome, CRS),可危及生命。在临床试验中,使用CD19 CAR-T细胞治疗B细胞急性淋巴细胞白血病和非霍奇金B细胞淋巴瘤的患者中,超过70%出现了CRS,其中发生5级CRS的患者高达3.8%[99]。通过设计双靶点CAR-T细胞,仅在同时识别两个肿瘤特异性抗原时激活,从而提高特异性,降低脱靶效应,或结合药物调控的CAR技术控制细胞活性,并联合使用IL-6拮抗剂可缓解CRS风险[100]。虽然CAR-NK细胞疗法的脱靶效应较轻,但其也可能引发细胞因子风暴,导致全身性炎症反应,严重时可能危及生命[101]。
外泌体在递送过程中易受酶降解和网状内皮系统清除,导致稳定性不足和疗效降低。例如,研究表明未修饰的外泌体在血液中循环时间短,难以有效到达肿瘤部位[71]。因此,可通过表面修饰(如PEG修饰)提升稳定性,优化递送路径(如局部注射或靶向修饰)以增强肿瘤聚集效率,也可通过开发仿生外泌体载体(如以细胞膜为基础的纳米颗粒),以提高其稳定性和递送效率[102]。外泌体与ICIs联合使用也可作为未来发展的方向。外泌体可作为载体递送ICIs(如抗PD-1/PD-L1抗体),直接作用于肿瘤微环境,增强免疫抑制解除效果[69]。此外,多靶点联合疗法通过将不同功能的外泌体和ICIs联合使用,或可针对复杂的肿瘤微环境实现精准治疗。在联合外泌体递送IL-2或IL-12等免疫增强因子的同时,使用ICIs抑制肿瘤逃逸机制,有望提高治疗效果[103]。
近年来,CRISPR-Cas9基因编辑技术和人工智能(artificial intelligence, AI)的快速发展,为免疫细胞及外泌体改造领域带来了前所未有的技术潜力[104]。CRISPR-Cas9可精确编辑外泌体来源细胞的基因组,优化外泌体的抗原特异性和药物递送能力。通过CRISPR介导的肿瘤特异性配体插入,可实现高效靶向肿瘤细胞[105]。AI则可用于细胞膜和外泌体设计与靶点优化,通过深度学习算法预测肿瘤特异性靶点和优化递送路径,提高疗效并降低副作用[106]。通过持续的基础研究和技术创新,合成生物学技术将不断优化免疫细胞膜改造策略,有望为肺癌治疗提供更安全、高效和个性化的临床解决方案。
同时,工程化细胞因其基因改造特性,还存在潜在的长期生物安全性问题,如基因组不稳定性或免疫系统紊乱[89, 107, 108]。因此,合成生物学的临床转化需要解决生产工艺的标准化及严格的监管要求,确保改造后的免疫细胞在临床应用中的一致性、安全性和效力。
| [1] |
Siegel RL, Miller KD, Wagle NS, et al. Cancer statistics, 2023. CA Cancer J Clin, 2023, 73: 17-48. |
| [2] |
Han B, Zheng R, Zeng H, et al. Cancer incidence and mortality in china, 2022. J Natl Cancer Cent, 2024, 4: 47-53. |
| [3] |
Lovly CM. Expanding horizons for treatment of early-stage lung cancer. N Engl J Med, 2022, 386: 2050-1. |
| [4] |
Brody H. Lung cancer. Nature, 2020, 587: S7. |
| [5] |
Liao W, Coupland CAC, Burchardt J, et al. Predicting the future risk of lung cancer: development, and internal and external validation of the CanPredict (lung) model in 19.67 million people and evaluation of model performance against seven other risk prediction models. Lancet Respir Med, 2023, 11: 685-97. |
| [6] |
Yin X, Liao H, Yun H, et al. Artificial intelligence-based prediction of clinical outcome in immunotherapy and targeted therapy of lung cancer. Semin Cancer Biol, 2022, 86: 146-59. |
| [7] |
Arcaro A. Targeted therapies for small cell lung cancer: where do we stand?. Crit Rev Oncol Hematol, 2015, 95: 154-64. |
| [8] |
Rolfo C, Caglevic C, Santarpia M, et al. Immunotherapy in NSCLC: a promising and revolutionary weapon. Adv Exp Med Biol, 2017, 995: 97-125. |
| [9] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015. CA Cancer J Clin, 2016, 66: 115-32. |
| [10] |
Lahiri A, Maji A, Potdar PD, et al. Lung cancer immunotherapy: progress, pitfalls, and promises. Mol Cancer, 2023, 22: 40. |
| [11] |
Li Y, Yan B, He S. Advances and challenges in the treatment of lung cancer. Biomed Pharmacother, 2023, 169: 115891. |
| [12] |
Mino-Kenudson M, Schalper K, Cooper W, et al. Predictive biomarkers for immunotherapy in lung cancer: perspective from the international association for the study of lung cancer pathology committee. J Thorac Oncol, 2022, 17: 1335-54. |
| [13] |
Pavan A, Attili I, Pasello G, et al. Immunotherapy in small-cell lung cancer: from molecular promises to clinical challenges. J Immunother Cancer, 2019, 7: 205. |
| [14] |
Wang M, Herbst RS, Boshoff C. Toward personalized treatment approaches for non-small-cell lung cancer. Nat Med, 2021, 27: 1345-56. |
| [15] |
Zhao Z, Chen Y, Francisco NM, et al. The application of CAR-T cell therapy in hematological malignancies: advantages and challenges. Acta Pharm Sin B, 2018, 8: 539-51. |
| [16] |
Zhang C, Liu J, Zhong JF, et al. Engineering CAR-T cells. Biomark Res, 2017, 5: 22. |
| [17] |
Chen R, Chen L, Wang C, et al. CAR-T treatment for cancer: prospects and challenges. Front Oncol, 2023, 13: 1288383. |
| [18] |
Yan X, Liu X, Zhao C, et al. Applications of synthetic biology in medical and pharmaceutical fields. Signal Transduct Target Ther, 2023, 8: 199. |
| [19] |
Cameron DE, Bashor CJ, Collins JJ. A brief history of synthetic biology. Nat Rev Microbiol, 2014, 12: 381-90. |
| [20] |
Zhu B, Yin H, Zhang D, et al. Synthetic biology approaches for improving the specificity and efficacy of cancer immunotherapy. Cell Mol Immunol, 2024, 21: 436-47. |
| [21] |
Galati D, Zanotta S. Dendritic cell and cancer therapy. Int J Mol Sci, 2023, 24: 4253. |
| [22] |
Tiberio L, Del Prete A, Schioppa T, et al. Chemokine and chemotactic signals in dendritic cell migration. Cell Mol Immunol, 2018, 15: 346-52. |
| [23] |
Constantino J, Gomes C, Falcão A, et al. Dendritic cell-based immunotherapy: a basic review and recent advances. Immunol Res, 2017, 65: 798-810. |
| [24] |
Lim RJ, Salehi-Rad R, Tran LM, et al. Cxcl9/10-engineered dendritic cells promote T cell activation and enhance immune checkpoint blockade for lung cancer. Cell Rep Med, 2024, 5: 101479. |
| [25] |
Bonehill A, Van Nuffel AM, Corthals J, et al. Single-step antigen loading and activation of dendritic cells by mRNA electroporation for the purpose of therapeutic vaccination in melanoma patients. Clin Cancer Res, 2009, 15: 3366-75. |
| [26] |
Itoh T, Ueda Y, Kawashima I, et al. Immunotherapy of solid cancer using dendritic cells pulsed with the HLA-A24-restricted peptide of carcinoembryonic antigen. Cancer Immunol Immunother, 2002, 51: 99-106. |
| [27] |
Ueda Y, Itoh T, Nukaya I, et al. Dendritic cell-based immunotherapy of cancer with carcinoembryonic antigen-derived, HLA-A24-restricted CTL epitope: clinical outcomes of 18 patients with metastatic gastrointestinal or lung adenocarcinomas. Int J Oncol, 2004, 24: 909-17. |
| [28] |
Chen W, Zhang Z, Zhang S, et al. Muc1: structure, function, and clinic application in epithelial cancers. Int J Mol Sci, 2021, 22: 6567. |
| [29] |
Kontani K, Taguchi O, Ozaki Y, et al. Dendritic cell vaccine immunotherapy of cancer targeting muc1 mucin. Int J Mol Med, 2003, 12: 493-502. |
| [30] |
Maeng HM, Moore BN, Bagheri H, et al. Phase Ⅰ clinical trial of an autologous dendritic cell vaccine against HER2 shows safety and preliminary clinical efficacy. Front Oncol, 2021, 11: 789078. |
| [31] |
Jiang T, Chen X, Zhou W, et al. Immunotherapy with dendritic cells modified with tumor-associated antigen gene demonstrates enhanced antitumor effect against lung cancer. Transl Oncol, 2017, 10: 132-41. |
| [32] |
Ma J, Wang S, Ma B, et al. Dendritic cells engineered to express GITRL enhance therapeutic immunity in murine lewis lung carcinoma. Cancer Lett, 2011, 301: 142-50. |
| [33] |
Locati M, Curtale G, Mantovani A. Diversity, mechanisms, and significance of macrophage plasticity. Annu Rev Pathol, 2020, 15: 123-47. |
| [34] |
Li M, Yang Y, Xiong L, et al. Metabolism, metabolites, and macrophages in cancer. J Hematol Oncol, 2023, 16: 80. |
| [35] |
Klichinsky M, Ruella M, Shestova O, et al. Human chimeric antigen receptor macrophages for cancer immunotherapy. Nat Biotechnol, 2020, 38: 947-53. |
| [36] |
Pierini S, Gabbasov R, Oliveira-Nunes MC, et al. Chimeric antigen receptor macrophages (CAR-M) sensitize HER2+ solid tumors to PD1 blockade in pre - clinical models. Nat Commun, 2025, 16: 706. |
| [37] |
Escobar G, Gentner B, Naldini L, et al. Engineered tumor-infiltrating macrophages as gene delivery vehicles for interferon-α activates immunity and inhibits breast cancer progression. Oncoimmunology, 2014, 3: e28696. |
| [38] |
Zhang W, Liu L, Su H, et al. Chimeric antigen receptor macrophage therapy for breast tumours mediated by targeting the tumour extracellular matrix. Br J Cancer, 2019, 121: 837-45. |
| [39] |
Brempelis KJ, Cowan CM, Kreuser SA, et al. Genetically engineered macrophages persist in solid tumors and locally deliver therapeutic proteins to activate immune responses. J Immunother Cancer, 2020, 8: e001356. |
| [40] |
Xiao Y, Cong M, Li J, et al. Cathepsin c promotes breast cancer lung metastasis by modulating neutrophil infiltration and neutrophil extracellular trap formation. Cancer Cell, 2021, 39: 423-37.e7. |
| [41] |
Yu X, Xing G, Sheng S, et al. Neutrophil camouflaged stealth nanovehicle for photothermal-induced tumor immunotherapy by triggering pyroptosis. Adv Sci (Weinh), 2023, 10: e2207456. |
| [42] |
Vivier E, Rebuffet L, Narni-Mancinelli E, et al. Natural killer cell therapies. Nature, 2024, 626: 727-36. |
| [43] |
Liu S, Galat V, Galat Y, et al. NK cell-based cancer immunotherapy: from basic biology to clinical development. J Hematol Oncol, 2021, 14: 7. |
| [44] |
Shevtsov M, Pitkin E, Ischenko A, et al. Ex vivo HSP70-activated NK cells in combination with PD-1 inhibition significantly increase overall survival in preclinical models of glioblastoma and lung cancer. Front Immunol, 2019, 10: 454. |
| [45] |
Kokowski K, Stangl S, Seier S, et al. Radiochemotherapy combined with NK cell transfer followed by second-line PD-1 inhibition in a patient with NSCLC stage Ⅲb inducing long-term tumor control: a case study. Strahlenther Onkol, 2019, 195: 352-61. |
| [46] |
Iliopoulou EG, Kountourakis P, Karamouzis MV, et al. A phase Ⅰ trial of adoptive transfer of allogeneic natural killer cells in patients with advanced non-small cell lung cancer. Cancer Immunol Immunother, 2010, 59: 1781-9. |
| [47] |
Liu WN, So WY, Harden SL, et al. Successful targeting of PD-1/PD-L1 with chimeric antigen receptor-natural killer cells and nivolumab in a humanized mouse cancer model. Sci Adv, 2022, 8: eadd1187. |
| [48] |
Handgretinger R, Anderson K, Lang P, et al. A phase Ⅰ study of human/mouse chimeric antiganglioside GD2 antibody ch14.18 in patients with neuroblastoma. Eur J Cancer, 1995, 31: 261-7. |
| [49] |
Altvater B, Landmeier S, Pscherer S, et al. 2b4 (CD244) signaling by recombinant antigen-specific chimeric receptors costimulates natural killer cell activation to leukemia and neuroblastoma cells. Clin Cancer Res, 2009, 15: 4857-66. |
| [50] |
Ma S, Li X, Wang X, et al. Current progress in CAR-T cell therapy for solid tumors. Int J Biol Sci, 2019, 15: 2548-60. |
| [51] |
Tang L, Pan S, Wei X, et al. Arming CAR-T cells with cytokines and more: innovations in the fourth-generation CAR-T development. Mol Ther, 2023, 31: 3146-62. |
| [52] |
Tomasik J, Jasiński M, Basak GW. Next generations of CAR-T cells - new therapeutic opportunities in hematology?. Front Immunol, 2022, 13: 1034707. |
| [53] |
Manier S, Ingegnere T, Escure G, et al. Current state and next-generation CAR-T cells in multiple myeloma. Blood Rev, 2022, 54: 100929. |
| [54] |
Scharpenseel H, Hanssen A, Loges S, et al. EGFR and HER3 expression in circulating tumor cells and tumor tissue from non-small cell lung cancer patients. Sci Rep, 2019, 9: 7406. |
| [55] |
Chinsuwan T, Hirabayashi K, Mishima S, et al. Ligand-based, piggybac-engineered CAR-T cells targeting EGFR are safe and effective against non-small cell lung cancers. Mol Ther Oncolytics, 2023, 31: 100728. |
| [56] |
Nicholson RI, Gee JM, Harper ME. EGFR and cancer prognosis. Eur J Cancer, 2001, 37 Suppl 4: S9-15. |
| [57] |
Díaz-Serrano A, Gella P, Jiménez E, et al. Targeting EGFR in lung cancer: current standards and developments. Drugs, 2018, 78: 893-911. |
| [58] |
Uchibori K, Inase N, Araki M, et al. Brigatinib combined with anti-EGFR antibody overcomes osimertinib resistance in EGFR-mutated non-small-cell lung cancer. Nat Commun, 2017, 8: 14768. |
| [59] |
Zhang Z, Jiang J, Wu X, et al. Chimeric antigen receptor T cell targeting EGFRVⅢ for metastatic lung cancer therapy. Front Med, 2019, 13: 57-68. |
| [60] |
Liu M, Wang X, Li W, et al. Targeting PD-L1 in non-small cell lung cancer using CAR T cells. Oncogenesis, 2020, 9: 72. |
| [61] |
Golubovskaya V. CAR-T cells targeting immune checkpoint pathway players. Front Biosci (Landmark Ed), 2022, 27: 121. |
| [62] |
Lakshmanan I, Ponnusamy MP, Macha MA, et al. Mucins in lung cancer: diagnostic, prognostic, and therapeutic implications. J Thorac Oncol, 2015, 10: 19-27. |
| [63] |
Barr T, Ma S, Li Z, et al. Recent advances and remaining challenges in lung cancer therapy. Chin Med J (Engl), 2024, 137: 533-46. |
| [64] |
Chen L, Chen F, Li J, et al. Car-T cell therapy for lung cancer: potential and perspective. Thorac Cancer, 2022, 13: 889-99. |
| [65] |
Liu Y, An L, Huang R, et al. Strategies to enhance CAR-T persistence. Biomark Res, 2022, 10: 86. |
| [66] |
Maggadóttir SM, Kvalheim G, Wernhoff P, et al. A phase Ⅰ/Ⅱ escalation trial design T-RAD: treatment of metastatic lung cancer with mRNA-engineered T cells expressing a T cell receptor targeting human telomerase reverse transcriptase (hTERT). Front Oncol, 2022, 12: 1031232. |
| [67] |
Poole A, Karuppiah V, Hartt A, et al. Therapeutic high affinity T cell receptor targeting a kRASG12D cancer neoantigen. Nat Commun, 2022, 13: 5333. |
| [68] |
Guo L, Overholser J, Good AJ, et al. Preclinical studies of a novel human PD-1 B-cell peptide cancer vaccine PD1-VAXX from balb/c mice to beagle dogs and to non-human primates (Cynomolgus monkeys). Front Oncol, 2022, 12: 826566. |
| [69] |
Kalluri R, LeBleu VS. The biology, function, and biomedical applications of exosomes. Science, 2020, 367: eaau6977. |
| [70] |
Zhou Q, Wei S, Wang H, et al. T cell-derived exosomes in tumor immune modulation and immunotherapy. Front Immunol, 2023, 14: 1130033. |
| [71] |
Kamerkar S, LeBleu VS, Sugimoto H, et al. Exosomes facilitate therapeutic targeting of oncogenic kRAS in pancreatic cancer. Nature, 2017, 546: 498-503. |
| [72] |
Zitvogel L, Regnault A, Lozier A, et al. Eradication of established murine tumors using a novel cell-free vaccine: dendritic cell-derived exosomes. Nat Med, 1998, 4: 594-600. |
| [73] |
Théry C, Ostrowski M, Segura E. Membrane vesicles as conveyors of immune responses. Nat Rev Immunol, 2009, 9: 581-93. |
| [74] |
Théry C, Duban L, Segura E, et al. Indirect activation of naïve CD4+ T cells by dendritic cell-derived exosomes. Nat Immunol, 2002, 3: 1156-62. |
| [75] |
Morse MA, Garst J, Osada T, et al. A phase Ⅰ study of dexosome immunotherapy in patients with advanced non-small cell lung cancer. J Transl Med, 2005, 3: 9. |
| [76] |
Besse B, Charrier M, Lapierre V, et al. Dendritic cell-derived exosomes as maintenance immunotherapy after first line chemotherapy in NSCLC. Oncoimmunology, 2016, 5: e1071008. |
| [77] |
Hao S, Bai O, Yuan J, et al. Dendritic cell-derived exosomes stimulate stronger CD8+ CTL responses and antitumor immunity than tumor cell-derived exosomes. Cell Mol Immunol, 2006, 3: 205-11. |
| [78] |
Hao S, Bai O, Li F, et al. Mature dendritic cells pulsed with exosomes stimulate efficient cytotoxic T-lymphocyte responses and antitumour immunity. Immunology, 2007, 120: 90-102. |
| [79] |
Lv F, Liu H, Zhao G, et al. Therapeutic exosomal vaccine for enhanced cancer immunotherapy by mediating tumor microenvironment. iScience, 2022, 25: 103639. |
| [80] |
Kim MS, Haney MJ, Zhao Y, et al. Engineering macrophage-derived exosomes for targeted paclitaxel delivery to pulmonary metastases: in vitro and in vivo evaluations. Nanomedicine, 2018, 14: 195-204. |
| [81] |
Kang YT, Niu Z, Hadlock T, et al. On-chip biogenesis of circulating NK cell-derived exosomes in non-small cell lung cancer exhibits antitumoral activity. Adv Sci (Weinh), 2021, 8: 2003747. |
| [82] |
Zheng W, Zhu T, Tang L, et al. Inhalable CAR-T cell-derived exosomes as paclitaxel carriers for treating lung cancer. J Transl Med, 2023, 21: 383. |
| [83] |
Zhu T, Chen Z, Jiang G, et al. Sequential targeting hybrid nanovesicles composed of chimeric antigen receptor T-cell-derived exosomes and liposomes for enhanced cancer immunochemotherapy. ACS Nano, 2023, 17: 16770-86. |
| [84] |
Cho H, Jung I, Ju H, et al. Engineered CD8(+) T cell-derived extracellular vesicles induce enhanced anti-cancer efficacy and targeting to lung cancer cells. Cytokine, 2023, 169: 156249. |
| [85] |
Hoces D, Miguens Blanco J, Hernández-López RA. A synthetic biology approach to engineering circuits in immune cells. Immunol Rev, 2023, 320: 120-37. |
| [86] |
Verdun N, Marks P. Secondary cancers after chimeric antigen receptor T-cell therapy. N Engl J Med, 2024, 390: 584-6. |
| [87] |
Dai H, Zhu C, Huai Q, et al. Chimeric antigen receptor-modified macrophages ameliorate liver fibrosis in preclinical models. J Hepatol, 2024, 80: 913-27. |
| [88] |
Parikh RH, Lonial S. Chimeric antigen receptor T-cell therapy in multiple myeloma: a comprehensive review of current data and implications for clinical practice. CA Cancer J Clin, 2023, 73: 275-85. |
| [89] |
Lin C, Zhang J. Chimeric antigen receptor engineered innate immune cells in cancer immunotherapy. Sci China Life Sci, 2019, 62: 633-9. |
| [90] |
Chen J, Qiu S, Li W, et al. Tuning charge density of chimeric antigen receptor optimizes tonic signaling and CAR-T cell fitness. Cell Res, 2023, 33: 341-54. |
| [91] |
Martín-Antonio B, Blanco B, González-Murillo Á, et al. Newer generations of multi-target CAR and STAB-T immunotherapeutics: NEXT CART Consortium as a cooperative effort to overcome current limitations. Front Immunol, 2024, 15: 1386856. |
| [92] |
Barile L, Vassalli G. Exosomes: therapy delivery tools and biomarkers of diseases. Pharmacol Ther, 2017, 174: 63-78. |
| [93] |
Yue M, Hu S, Sun H, et al. Extracellular vesicles remodel tumor environment for cancer immunotherapy. Mol Cancer, 2023, 22: 203. |
| [94] |
Joshi S, Sharabi A. Targeting myeloid-derived suppressor cells to enhance natural killer cell-based immunotherapy. Pharmacol Ther, 2022, 235: 108114. |
| [95] |
Kumar V, Patel S, Tcyganov E, et al. The nature of myeloid-derived suppressor cells in the tumor microenvironment. Trends Immunol, 2016, 37: 208-20. |
| [96] |
Irvine DJ, Maus MV, Mooney DJ, et al. The future of engineered immune cell therapies. Science, 2022, 378: 853-8. |
| [97] |
Kershaw MH, Westwood JA, Darcy PK. Gene-engineered T cells for cancer therapy. Nat Rev Cancer, 2013, 13: 525-41. |
| [98] |
Neelapu SS, Tummala S, Kebriaei P, et al. Chimeric antigen receptor T-cell therapy - assessment and management of toxicities. Nat Rev Clin Oncol, 2018, 15: 47-62. |
| [99] |
Hay KA, Hanafi LA, Li D, et al. Kinetics and biomarkers of severe cytokine release syndrome after CD19 chimeric antigen receptor-modified T-cell therapy. Blood, 2017, 130: 2295-306. |
| [100] |
Maus MV, June CH. Making better chimeric antigen receptors for adoptive T-cell therapy. Clin Cancer Res, 2016, 22: 1875-84. |
| [101] |
Laskowski TJ, Biederstädt A, Rezvani K. Natural killer cells in antitumour adoptive cell immunotherapy. Nat Rev Cancer, 2022, 22: 557-75. |
| [102] |
Kooijmans SAA, Stremersch S, Braeckmans K, et al. Electroporation-induced siRNA precipitation obscures the efficiency of siRNA loading into extracellular vesicles. J Control Release, 2013, 172: 229-38. |
| [103] |
Vader P, Mol EA, Pasterkamp G, et al. Extracellular vesicles for drug delivery. Adv Drug Deliv Rev, 2016, 106: 148-56. |
| [104] |
Komor AC, Badran AH, Liu DR. CRISPR-based technologies for the manipulation of eukaryotic genomes. Cell, 2017, 168: 20-36. |
| [105] |
Xu X, Liu C, Wang Y, et al. Nanotechnology-based delivery of CRISPR/Cas9 for cancer treatment. Adv Drug Deliv Rev, 2021, 176: 113891. |
| [106] |
Sunami K, Naito Y, Saigusa Y, et al. A learning program for treatment recommendations by molecular tumor boards and artificial intelligence. JAMA Oncol, 2024, 10: 95-102. |
| [107] |
Lim WA. The emerging era of cell engineering: harnessing the modularity of cells to program complex biological function. Science, 2022, 378: 848-52. |
| [108] |
Longo DL. Engineering Car T cells for off-the-shelf use. N Engl J Med, 2023, 389: 953-7. |
 2025, Vol. 37
2025, Vol. 37 

 刘颖,国家纳米科学中心研究员、博士生导师。国家优秀青年科学基金获得者,研究领域为纳米生物效应与安全。针对肺癌的转移预防和治疗,形成了“临床发现溯源→效应机制解析→精准治疗体系设计构筑→临床应用研究”的闭环式研究范式。发现了肺癌转移变化规律,实现了高危肿瘤分子表型预警。最终通过高风险人群的精准分子标志谱筛选,基于细胞外基质和细胞内信号的时-空贯序调控,实现了临床产品研发全流程的创新整合,提高肺癌转移的预防和治疗效果。在Proc Natl Acad Sci USA、Nat Commun、Angew Chem Int Ed、JACS、Accounts Chem Res、Adv Mater等生物材料、药理与毒理学领域的国际知名期刊发表SCI论文150余篇,他引超过11910次,H-index 57。获国家自然科学奖二等奖(2/5)、中国科学院杰出科技成就奖和中国毒理学会优秀青年科技奖等
刘颖,国家纳米科学中心研究员、博士生导师。国家优秀青年科学基金获得者,研究领域为纳米生物效应与安全。针对肺癌的转移预防和治疗,形成了“临床发现溯源→效应机制解析→精准治疗体系设计构筑→临床应用研究”的闭环式研究范式。发现了肺癌转移变化规律,实现了高危肿瘤分子表型预警。最终通过高风险人群的精准分子标志谱筛选,基于细胞外基质和细胞内信号的时-空贯序调控,实现了临床产品研发全流程的创新整合,提高肺癌转移的预防和治疗效果。在Proc Natl Acad Sci USA、Nat Commun、Angew Chem Int Ed、JACS、Accounts Chem Res、Adv Mater等生物材料、药理与毒理学领域的国际知名期刊发表SCI论文150余篇,他引超过11910次,H-index 57。获国家自然科学奖二等奖(2/5)、中国科学院杰出科技成就奖和中国毒理学会优秀青年科技奖等