红外光波段通常可分为三个区域:近红外、中红外和远红外。近红外区(约14 000~4 000 cm-1)的能量可激发分子泛频振动;中红外区(约4 000~400 cm-1)涵盖了绝大部分有机官能团的基频振动;远红外区(约400~10 cm-1)能量最低,适用于分子转动的研究[1]。近十几年来,随着红外光源、光学元件与探测器的发展,FTIR技术与光学显微技术相结合,能够实现微米尺度的化学成分分析[2]。
同步辐射是带电粒子在磁场作用下改变运动方向时,沿运动轨道切线方向发射出的电磁辐射,其具有宽波段、高亮度、高准直性、高偏振与相干性等特性[3]。目前,绝大部分的同步辐射红外光束线站采用弯铁辐射和边缘辐射[4-6]。这通常需要在储存环内安装大尺寸平面镜作为引出镜,将红外光束以垂直或水平方向偏转出电子束轨道(图 1)。随后,通过聚焦和偏转光学元件将红外光束耦合至红外光谱仪和红外显微镜[5]。同步辐射红外光源比黑体辐射光源的亮度要高出2~3个数量级,且光谱范围覆盖了近红外区域至太赫兹区域[1]。相比于红外黑体光源、红外激光器光源等实验室普通光源,具有明显的性能优势(表 1)。基于此,同步辐射傅里叶变换红外光谱(synchrotron radiation Fourier transform infrared spectroscopy, SR-FTIR)技术已被广泛用于生命科学中生物分子结构和特征的研究[7]。
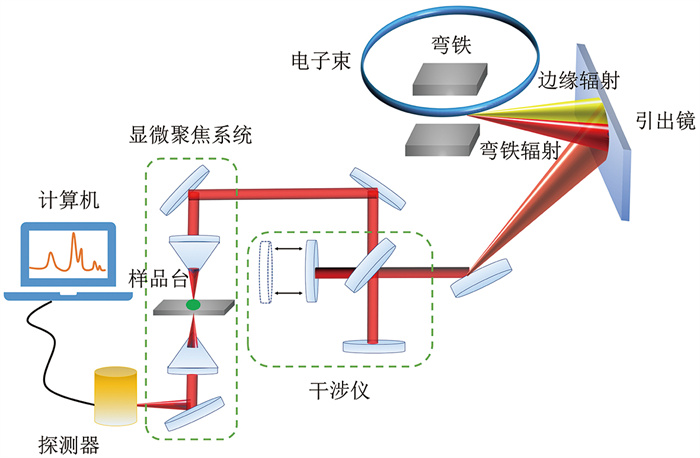
|
图 1 SR-FTIR技术原理图 |
| 表 1 同步辐射光源与实验室光源性能比较 |
SR-FTIR技术可提供丰富的生物分子指纹信息,用于生物组织的高分辨率化学成像,如研究蛋白质错误折叠导致的异常沉积等[8, 9],还能以单细胞的空间分辨率解析细胞中生物大分子的特异性,研究细胞与药物的相互作用[10]。结合衰减全反射(attenuated total reflection, ATR)成像和面阵列探测器(focal plane array, FPA)等技术,能进一步提高成像的空间分辨率,可在亚细胞尺度上研究蛋白质聚集体和脂质包涵体[11]。由于生物样本的多样性,SR-FTIR技术在数据处理方式上也由传统的单变量分析转变到多变量统计学分析。非监督类学习方法,如主成分分析(principal component analysis, PCA)、层次聚类分析(hierarchical clustering analysis, HCA),以及监督学习方法,如线性判别分析(linear discriminant analysis, LDA)、正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)等,已被广泛用于红外光谱的降维分析、特征提取及样本分类中。近年来,随着机器学习等算法的发展以及蛋白质红外光谱数据库的构建,人工神经网络(artificial neural network, ANN)等方法被用于鉴定和预测蛋白质的种类和构象[12, 13]。
1.3 技术互补性作为一种无损检测技术,SR-FTIR技术可解析生物样品固有的分子振动特征,无须依赖荧光标记或同位素修饰,从而避免了样品前处理可能引入的干扰 [14]。红外和拉曼光谱作为互补分子光谱技术,可分别检测分子偶极矩和极化率发生变化的振动[15],但拉曼光谱通常信号较弱且易受荧光信号干扰。核磁共振技术能以原子级分辨率解析蛋白质的三维结构及动态变化过程,但对大分子量蛋白质的灵敏度和分辨率较低[16, 17]。在结构生物学领域,X射线衍射技术同样能以原子分辨率解析蛋白质的结构信息,但其受限于样品须形成高质量的晶体[18]。SR-FTIR技术可在溶液环境中直接获取蛋白质的二级结构信息,且对蛋白质的分子量无特殊要求。
SR-FTIR技术虽有诸多优势,但仍存在局限性。首先,水在红外波段具有强吸收,超过10 μm甚至更小的光程就会导致水的饱和吸收[19]。通过ATR或者微流控技术,可有效降低红外光在水层中的穿透深度从而降低干扰[20]。此外,用D2O替代H2O可以有效避免水对酰胺Ⅰ谱带的干扰,但此时需充分考虑氢氘交换对蛋白质构象产生的影响[19]。其次,红外光谱技术无法提供生物体系中特定蛋白及其表达水平的详细信息,且对低丰度蛋白的检测能力有限[21]。为突破这些局限,将红外光谱技术与拉曼光谱技术[22]、X射线荧光光谱技术[23]、蛋白质组学[24]等技术联用,可多尺度地提供细胞内部分子结构变化至细胞群体表型变化的信息。
2 发展现状及趋势SR-FTIR显微光谱技术经过多年的发展已达到高度成熟的状态,为生命科学领域的研究提供了有力的技术支撑。如今,全球各同步辐射红外线站正将研究重点聚焦于原位装置及联用技术的开发,同时积极推动同步辐射纳米红外光谱技术以及远红外/太赫兹光谱技术的发展。
2.1 原位装置及联用技术活细胞生化反应的实时监测一直是生命科学领域的研究热点[25]。同步辐射红外光具有非电离特性,为活生物样本的原位研究提供了新的技术手段。微流控系统能在精确控制水层厚度的同时为活细胞的生长提供适宜的环境,从而实现数小时至数天的连续观测[25]。将SR-FTIR技术和微流控系统联用,可实时监测活细胞中蛋白质、脂质、碳水化合物及代谢化合物的分布和含量[25, 26]。另一种研究活细胞的方法是将细胞接种在ATR晶体板上,由于ATR模式中红外光在晶体与细胞界面处的有效穿透深度为0.5~5 μm,可有效避免水饱和吸收的干扰[20]。
在原位装置及联用技术的开发上,法国SOLEI光源、瑞士SLS光源及我国合肥光源等都开发了多种极端条件下(高低温、高压和磁场)用于SR-FTIR测试的原位装置[27-29]。除了发展先进的原位装置,也可通过独特的光束线设计将同步辐射红外光谱技术与同步辐射能量色散X射线吸收光谱技术进行联用,在同一样品处实现两种技术在毫秒时间分辨尺度上的动力学研究[30]。
2.2 纳米红外光谱技术尽管SR-FTIR显微光谱技术能够实现微米级的空间分辨率,但其仍受红外光衍射极限的限制[31]。过去几十年间,纳米级光热膨胀[32]、光诱导力显微镜[33]、散射型扫描近场光学显微技术(scattering-type scanning near-field optical microscopy, s-SNOM)[34, 35]等多种突破红外光衍射极限的纳米红外光谱技术得到了迅速的发展。这些技术结合了红外光谱的化学特异性与原子力显微镜等扫描探针系统的空间分辨率和灵敏度,将红外光谱的成像空间分辨率扩展到纳米级别。德国BESSY Ⅱ、英国Dimonnd及美国NSLS Ⅱ等光源的众多红外光束线站也都已经实现了同步辐射红外纳米光谱技术[5, 36, 37]。将同步辐射红外光源耦合到纳米红外光谱仪,可实现宽波段纳米级空间分辨的近场红外测量。
第四代同步辐射加速器在束流稳定性、亮度和相干性方面取得了显著提升[38, 39]。传统红外光束线通常需要大尺寸的光学引出元件来匹配长波长辐射的高发散特性。然而,第四代同步辐射光源紧凑的储存环布局给红外光束线的设计带来了极大的挑战。巴西光源的IMBUIA线站通过较小的提取角(即较短的光源深度)、单焦距光学系统和高质量的波前实现了同步辐射光源和s-SNOW高质量的耦合,为在四代同步辐射装置上发展纳米红外光谱技术奠定了基础[40]。
2.3 远红外/太赫兹技术远红外/太赫兹技术为研究生物分子构象及相互作用力提供了全新的技术手段[41]。同步辐射红外光束线站能够获得亮度远超传统热光源的远红外光源[42],通过相干同步辐射技术可进一步提升长波段的辐射强度[43]。全球多个同步辐射装置可实现相干同步辐射技术,并能为用户实验专门提供这种运行模式[41, 43]。同步辐射远红外/太赫兹光谱技术可探测生物分子的低频振动模式,用于分析蛋白质和脂质的结构特性,也可用于研究生物材料在太赫兹波段的介电性质和吸收特性[44, 45]。同步辐射远红外/太赫兹光源也可作为辐射源,用于研究细胞、细菌对该波段辐照的生理反应机制[46, 47]。
3 线站介绍及技术发展 3.1 线站介绍国家蛋白质科学研究(上海)设施的BL01B同步辐射红外线站位于上海同步辐射光源(SSRF),其红外光束来自弯铁辐射和边缘辐射,其详细设计、布局及性能可参考先前的研究报道[6, 48-50]。光束线布局如图 2所示,M1引出镜为中间开有2.6 mm宽槽的平面反射镜,距离光源点1 815 mm,与入射光呈45°,将光束水平反射至平面镜M2。M2与M1处于同一水平面,距离M1 650 mm,将光束垂直反射至环形聚焦镜T1。T1距离M2 1 000 mm,将光束引出至隧道防护墙外。CVD金刚石窗用于隔绝光束线的超高真空和下游的高真空,其呈楔形,能避免光束在经过窗口时多次反射引起干涉。在CVD窗之后的焦点处放置一个可变狭缝来阻挡上游光学元件的杂散光。T2为环形聚焦镜,距离CVD窗口750 mm。T2将光束以平行光模式90°偏转,使其垂直向下入射到M3平面镜。而后,通过BS1、BS2分束镜及M4至M7等系列平面镜将光束水平偏转至实验站。当M5在光路中时,红外光束被引至时间分辨红外光谱实验站;其移出光路时,红外光束则被引至红外显微谱学与成像实验站。
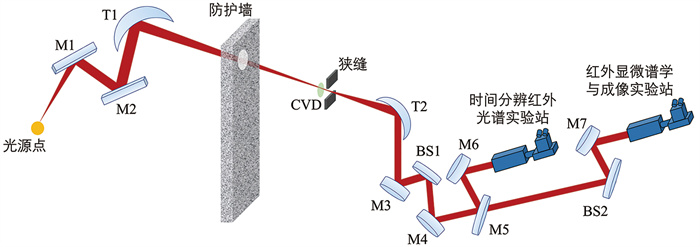
|
M1~M7为平面反射镜;T1、T2为环形聚焦镜;BS1和BS2为分束镜。 图 2 BL01B线站光束线布局示意图 |
红外显微谱学与成像实验站主要用于显微红外谱学的研究,目前配置有赛默飞Nicolet 6700红外光谱仪和Nicolet Continuμm红外显微镜。该实验站性能如下(表 2):光谱范围10 000~650 cm-1,最佳光谱分辨率0.1 cm-1,谱仪入口处光通量为1.9×1013 (phs/sec/0.1%B.W.) @ 1 μm @ 300 mA。显微镜样品台处的聚焦光斑直径为18 μm (32倍物镜,数值孔径为0.65),分辨率接近理论衍射极限[6, 48]。当光阑尺寸小于50×50 μm2时,探测器能探测到的同步辐射光源信号优于Globar光源;尤其当光阑尺寸达到5×5 μm2时,同步辐射红外光源的光谱噪声远低于Globar光源(图 3)。
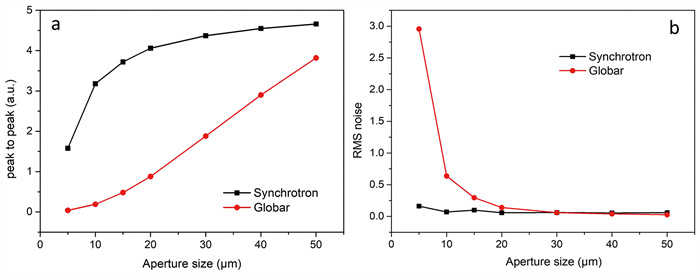
|
储存环束流强度200 mA,显微镜采样模式为反射模式时:(a)不同光阑尺寸下,MCT探测器的峰-峰值;(b)不同光阑尺寸下,100%反射率线在2 600~2 500 cm-1处的噪声值(分辨率4 cm-1,扫描次数64次)。 图 3 同步辐射红外光源与Globar光源的性能对比 |
此外,线站还配备一套Nicolet 8700红外光谱仪及Nicolet Continuμm红外显微镜离线使用。Nicolet 8700相比于Nicolet 6700光谱仪,增配了纳秒级时间分辨模块和高速响应MCT探测器。采用步进扫描(step-scan)采样模式,其最高时间分辨能力能够达到10 ns。近年来,BL01B线站在远红外/太赫兹波段的实验能力也有所提升。Nicolet 8700红外光谱仪配置有液氦制冷的硅热辐射计(Si bolometer),其可探测的长波段红外范围为370~10 cm-1。时间分辨红外光谱实验站的光谱设备升级为布鲁克全真空型光谱仪Vertex 70 V及Hyperion Ⅱ红外显微镜,同时配置了汞灯作为远红外光源,增强设备在低波数处的光源强度。线站可实现透射、透反射、衰减全反射及漫反射等各类实验模式。
3.2 线站技术发展BL01B线站自运行开放以来发展了多种原位及联用技术,可实现多种生物样品的原位红外光谱测试。
红外微流控活细胞测试系统。红外微流控系统包含了红外微流控芯片、温度控制模块及流体控制模块。线站自主研发了两种红外微流控芯片的设计方式:(1)通过框架结构设计、窗片镶嵌及流道构建的方式[51];(2)通过紫外光刻微加工的方式[52]。红外微流控技术能精确控制液体厚度,可有效避免水的强烈吸收对红外光谱的影响。同时,能够控制营养液的循环,确保细胞48 h以上的存活时间,为长时间的动态研究提供可能。红外微流控系统已被成功应用于中红外神经刺激的研究[53]。中红外光刺激作为一种新型的神经调控策略,可调节神经元的信号发生、动作电位波形以及动物行为,且这种调控作用具有非热、可逆、长距离的特点。红外微流控系统支持完成了该研究中关键的生理液体环境SR-FTIR光谱的精细测量,为精准定位神经调控频率窗口提供了重要技术支持。
蛋白质在高压溶液环境中的构象动态变化分析系统。高压作为一种外界扰动因素可以引起维持生物大分子构象的弱相互作用发生变化,进而导致蛋白质去折叠过程的发生[54]。在高压下去折叠后可聚集形成微米尺寸的蛋白颗粒,而SR-FTIR技术对该尺度的蛋白颗粒构象分析有独特优势。将高压对顶砧作为蛋白质溶液高压产生装置,用水作为传压介质,以硫酸钡作为标压物质。将SR-FTIR技术与高压对顶砧技术联用,可研究压力作用下蛋白质构象变化的动态过程[55]。再生丝素蛋白作为一种从蚕丝中提取的天然高分子纤维蛋白,具有良好的生物相容性、力学性能及可降解性能,被广泛用于蛋白质结构-性能的研究中。将再生丝素蛋白以4 wt%的浓度溶于重水中,在升压过程中酰胺Ⅰ主峰由1 649 cm-1向1 637 cm-1波数移动,表明压力作用下蛋白质构象发生了变化(图 4a)。进一步,从二阶导数光谱中可以看出,随着体系压力值的升高,1 630 cm-1处的峰增强,而1 641 cm-1、1 649 cm-1处的峰减弱,表明再生丝素蛋白在压力作用下由无规构象向β折叠构象发生转变(图 4b)。
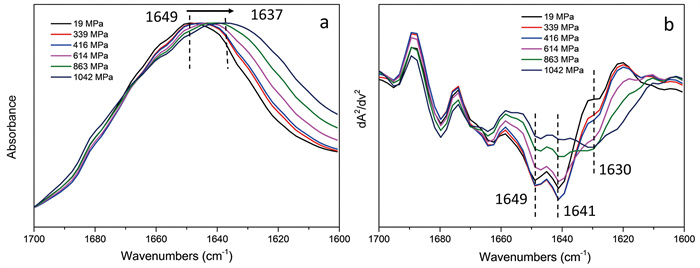
|
(a)升压过程中酰胺Ⅰ带的红外光谱图(归一化处理);(b)升压过程中酰胺Ⅰ带的二阶导数光谱。 图 4 压力作用下再生丝素蛋白溶液的红外光谱图 |
停流光谱技术是一种用来研究快速反应动力学的实验技术,与快速扫描红外光谱技术相结合可在毫秒的时间尺度上探究光谱信号的变化[56]。BL01B线站发展了停流光谱与快速扫描时间分辨红外光谱联用技术,可实现两路液体大于200 ms快速混合的时间分辨红外光谱测试。该技术可用于研究pH变化、溶剂诱导等多种外加因素作用下蛋白质构象变化的动力学过程。将60 mg/mL的再生丝素蛋白溶液与乙醇通过停流仪快速混合后触发红外光谱仪进行快速时间分辨扫描,发现混合后蛋白溶液在高浓度乙醇诱导下,其构象由无规卷曲迅速向β折叠(1 628 cm-1处肩峰出现)转变(图 5)。
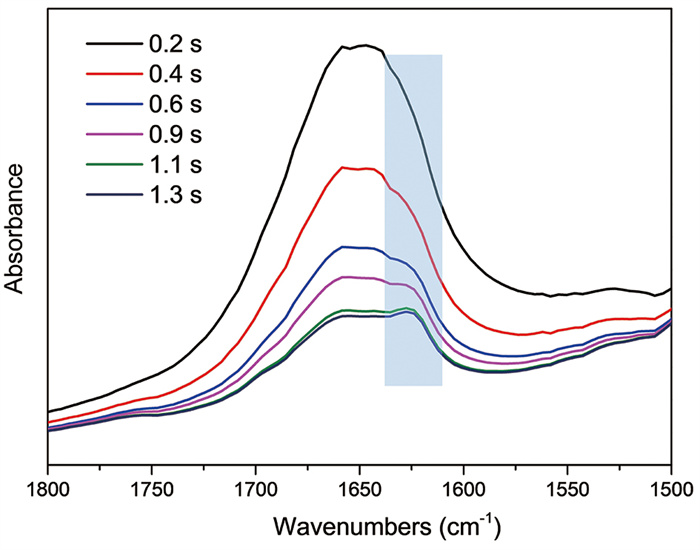
|
图 5 再生丝素蛋白溶液在乙醇诱导下混合液的时间分辨红外光谱 |
在外力场作用下(如温度、应力),蛋白质基生物材料的分子链结构和取向的变化直接影响了蛋白质材料的性能,其结构-性能之间有着密切的关系[57]。商用温控拉伸装置体积庞大,并不适用于在红外显微镜上进行原位检测。针对这个问题,BL01B线站开发了适用于同步辐射红外线站的显微温控拉伸系统。该系统集成了拉伸模块、温控模块于体积小巧的测试盒体中,适配Continuμm红外显微镜15倍物镜11 mm的工作距离,在对样品进行单轴双向拉伸的同时,能实时监测样品所受拉力、温度的变化以及进行原位红外光谱成像[58]。
4 线站应用及成果产出BL01B线站支撑产出的用户成果涵盖了生命科学、环境科学、材料科学及能源催化等多个领域。先前已有多篇文献对线站用户成果进行了综述[49, 50],本文将主要综述最近几年在生命科学领域的用户成果产出。
4.1 在细胞研究中的应用单个细胞的红外光谱和成像图相比于传统的多个细胞的平均红外光谱更能够揭示细胞与周围环境相互作用后的微小生物化学变化。单个细胞的尺寸通常在10~20 μm之间,SR-FTIR技术在单个细胞空间尺度上的红外光谱表征具有独特优势。吕军鸿和王亚迪团队[59, 60]开发了基于SR-FTIR数据计算细胞间距离相似性的方法,并提出了单细胞红外表型组学的概念。基于SR-FTIR技术,结合多变量的统计学方法,能够以单细胞的空间分辨率分析细胞的表型特征,为理解细胞异质性、细胞衰老过程、药物与细胞作用机制等复杂生物学过程提供全新的技术手段。
SR-FTIR技术在药物与细胞相互作用的研究中得到了广泛应用,为理解药物的细胞毒性机制提供了新的视角。多柔比星和长春新碱对WRL68 (人正常胚胎肝细胞)都表现出了剂量依赖性的抗增殖效应[10, 61]。通过SR-FTIR技术结合单变量分析及PCA、OPLS-DA等统计学分析,证实多柔比星和长春新碱处理均导致WRL68细胞中脂质和蛋白质的结构发生了变化:多柔比星导致了细胞生物分子中脂质酰基链的有序性发生了变化,且蛋白质α螺旋结构减少;长春新碱则会导致细胞中长链脂肪酸含量增加,蛋白质α螺旋结构相比β折叠结构减少,核酸含量相对脂质和蛋白质含量有所减少。
4.2 在组织研究中的应用SR-FTIR技术在动物组织研究中的应用主要体现在能够对组织的微观结构和成分进行高分辨率的无损化学成像。王化斌团队[62]利用SR-FTIR显微成像技术研究了创伤性脑损伤小鼠脑组织,发现损伤区域的蛋白质和核酸含量明显低于正常区域。BL01B线站团队与上海市第一妇婴保健院研究团队[63, 64]利用SR-FTIR技术研究了妊娠期患糖尿病(gestational diabetes mellitus, GDM)和妊娠期患肝内胆汁淤积症(intrahepatic cholestasis of pregnancy, ICP)产妇胎盘组织的病理学特征。通过分析GDM和ICP产妇胎盘组织的红外光谱,研究了胎盘组织中的生物分子变化,为揭示这些疾病对胎盘结构和功能的影响及机制提供了依据。
SR-FTIR显微成像技术结合机器学习等算法被用于疾病的诊断。SR-FTIR结合ANN能以无损方式检测神经胶质瘤组织,并进行快速诊断分级[65]。SR-FTIR技术结合同步辐射X射线相衬层析成像(synchrotron-based X-ray phase-sensitive microtomography, SR-XPCT)则能够多维度地研究肺癌、乳腺癌等多种疾病的病变组织[66, 67]:SR-XPCT能提供肺癌组织的三维微结构特征;SR-FTIR则能够提供正常组织和肿瘤组织间的生物分子组成和分布的区别。
SR-FTIR技术在组织工程等领域主要被用于生物材料结构的表征以及植入再生过程中生物相容性的评估。胡建中、吕红斌团队[68-71]研制了多种用于运动损伤修复的新型仿生支架。通过对SR-FTIR成像图中酰胺Ⅰ (1 720~1 590 cm-1)和碳水化合物(1 140~ 985 cm-1)谱带强度进行分析,研究去细胞化后书状骨腱交接支架中胶原蛋白和多糖的含量及分布[69]。
4.3 在药物研究中的应用SR-FTIR技术能够在微米尺度上研究药物/辅料的分布和结构变化。张继稳团队[72]基于SR-FTIR技术,在单个微球的水平上表征了聚乳酸-羟基乙酸共聚物微球中蛋白质/肽类药物(exenatide)的分布和定位。在渗透泵片剂的研究中,SR-FTIR显微成像技术被用于研究水合诱导的材料转移过程[73]:通过分析醋酸纤维素和聚乙二醇复合膜微区化学信号分布,评估渗透泵系统的药物释放机制。SR-FTIR技术也被广泛用于药物载体的结构表征[74, 75]。在研究基于硼酸化环糊精框架(boronated cyclodextrin framework, BCF)的纳米载体时,通过特定波数的吸收峰确认BCF中酯键的存在,以此来评估BCF的交联程度[75]。
5 总结与展望SR-FTIR技术的光谱范围覆盖了近红外至太赫兹区域,具有接近红外光衍射极限的空间分辨率。基于这些优势,SR-FTIR技术适用于微米尺度结构的化学表征,尤其可对细胞、组织等进行高空间分辨率的化学成像。同步辐射红外显微谱学技术经过几十年的发展已达到高度成熟的状态,目前趋向于各类原位和联用技术的开发、同步辐射纳米红外光谱学技术的发展及远红外/太赫兹技术的发展。国家蛋白质科学研究(上海)设施BL01B同步辐射红外线站自开放运行十年以来,发展了红外微流控活细胞测试系统、蛋白质溶液高压环境下构象分析系统及时间分辨停流红外光谱技术,并开发了多种外场条件下原位研究生物样品的装置。这些原位技术及实验方法学为动态研究活细胞的生化反应、蛋白质构象变化动力学提供了有利的技术支撑,并促进了众多研究成果的产出。展望未来,SR-FTIR技术将以多尺度空间和时间分辨率对生物大分子开展动态研究,揭示其结构与功能的关系。此外,其在疾病早期诊断、治疗效果评估等中的应用也将不断拓展,为生命科学研究和医学发展提供技术支撑。
| [1] |
Dumas P, Martin MC, Carr GL. IR spectroscopy and spectromicroscopy with synchrotron radiation[M]//Jaeschke EJ, Khan S, Schneider JR, et al. Synchrotron light sources and free-electron lasers: accelerator physics, instrumentation and science applications. Cham: Springer, 2020: 2059-113
|
| [2] |
Odularu AT. Worthwhile relevance of infrared spectroscopy in characterization of samples and concept of infrared spectroscopy-based synchrotron radiation. J Spectro, 2020, 2020: 8869713. |
| [3] |
Hwu Y, Margaritondo G. Synchrotron radiation and sensors: a history of synergies. IEEE Sens J, 2021, 21: 12764-73. |
| [4] |
Ji T, Zhu H, Peng W, et al. Infrared microspectroscopy beamline BL06B at SSRF. Nucl Sci Tech, 2023, 35: 2. |
| [5] |
Veber A, Puskar L, Kneipp J, et al. New status of the brilliant infrared beamline at the electron storage ring BESSY Ⅱ[C]//2024 49th international conference on infrared, millimeter, and terahertz waves (IRMMW-THz), 2024: 1
|
| [6] |
Zhang Z, Chen M, Tong Y, et al. Performance of the infrared microspectroscopy station at SSRF. Infrared Phys Techn, 2014, 67: 521-5. |
| [7] |
Qian J, Gao X, Wang Y, et al. Synchrotron infrared microspectroscopy for stem cell research. Int J Mol Sci, 2022, 23: 9878
|
| [8] |
Ahmed GAR, El Hotaby W, Abbas L, et al. Synchrotron Fourier transform infrared microspectroscopy (sFTIRM) analysis of Al-induced Alzheimer's disease in rat brain cortical tissue. Spectrochim Acta A, 2020, 239: 118421. |
| [9] |
Surowka AD, Pilling M, Henderson A, et al. FTIR imaging of the molecular burden around Aβ deposits in an early-stage 3-TG-APP-PSP1-TAU mouse model of Alzheimer's disease. Analyst, 2017, 142: 156-68. |
| [10] |
Zhou X, Zhong J, Yu W, et al. Synchrotron radiation-based Fourier transform infrared microspectroscopy investigation of WRL68 cells treated with doxorubicin. Spectrochim Acta A, 2022, 283: 121773. |
| [11] |
Hartnell D, Hollings A, Ranieri AM, et al. Mapping sub-cellular protein aggregates and lipid inclusions using synchrotron ATR-FTIR microspectroscopy. Analyst, 2021, 146: 3516-25. |
| [12] |
Sandt C. Identification and classification of proteins by FTIR microspectroscopy. A proof of concept. BBA-Gen Subjects, 2024, 1868: 130688. |
| [13] |
De Meutter J, Goormaghtigh E. FTIR imaging of protein microarrays for high throughput secondary structure determination. Anal Chem, 2021, 93: 3733-41. |
| [14] |
Marcelli A, Cricenti A, Kwiatek WM, et al. Biological applications of synchrotron radiation infrared spectromicroscopy. Biotechnol Adv, 2012, 30: 1390-404. |
| [15] |
Jurowski K, Noga M, Kobylarz D, et al. Multimodal imaging using Raman spectroscopy and FTIR in a single analytical instrument with a microscope (infrared Raman microscopy AIRsight, Shimadzu): opportunities and applications. Int J Mol Sci, 2024, 25: 6884. |
| [16] |
Karunanithy G, Shukla VK, Hansen DF. Solution-state methyl NMR spectroscopy of large non-deuterated proteins enabled by deep neural networks. Nat Commun, 2024, 15: 5073. |
| [17] |
Danmaliki GI, Hwang PM. Solution NMR spectroscopy of membrane proteins. Biochim Biophys Acta, 2020, 1862: 183356. |
| [18] |
Chayen NE, Saridakis E. Protein crystallization: from purified protein to diffraction-quality crystal. Nat Methods, 2008, 5: 147-53. |
| [19] |
Yang H, Yang S, Kong J, et al. Obtaining information about protein secondary structures in aqueous solution using Fourier transform IR spectroscopy. Nat Protoc, 2015, 10: 382-96. |
| [20] |
Andrew Chan KL, Kazarian SG. Attenuated total reflection Fourier-transform infrared (ATR-FTIR) imaging of tissues and live cells. Chem Soc Rev, 2016, 45: 1850-64. |
| [21] |
López-Lorente Á I, Mizaikoff B. Mid-infrared spectroscopy for protein analysis: potential and challenges. Anal Bioanal Chem, 2016, 408: 2875-89. |
| [22] |
Ravera F, Efeoglu E, Byrne HJ. Vibrational spectroscopy for in vitro monitoring stem cell differentiation. Molecules, 2020, 25: 5554. |
| [23] |
Deng G, Carlene N, Yu P. Combined molecular spectroscopic techniques (SR-FTIR, XRF, ATR-FTIR) to study physiochemical and nutrient profiles of Avena sativa grain and nutrition and structure interactive association properties. Crit Rev Food Sci Nutr, 2023, 63: 7225-37. |
| [24] |
Wanaragthai P, Yingchutrakul Y, Panichayupakaranant P, et al. Integrated synchrotron radiation-based Fourier transform infrared (SR-FTIR) microscopy and tandem-mass spectrometry (LC-MS/MS) used to elucidate the apoptotic effect of chamuangone in A549 cells. Biochem Biophys Res Commun, 2025, 764: 151826. |
| [25] |
Loutherback K, Birarda G, Chen L, et al. Microfluidic approaches to synchrotron radiation-based Fourier transform infrared (SR-FTIR) spectral microscopy of living biosystems. Protein Peptide Lett, 2016, 23: 273-82
|
| [26] |
Dučić T, Ninkovic M, Martínez-Rovira I, et al. Live-cell synchrotron-based FTIR evaluation of metabolic compounds in brain glioblastoma cell lines after riluzole treatment. Anal Chem, 2022, 94: 1932-40. |
| [27] |
Voute A, Deutsch M, Kalinko A, et al. New high-pressure/low-temperature set-up available at the AILES beamline. Vib Spectrosc, 2016, 86: 17-23. |
| [28] |
Tran MK, Levallois J, Akrap A, et al. Versatile setup for optical spectroscopy under high pressure and low temperature. Rev Sci Instrum, 2015, 86: 105102
|
| [29] |
Zhang J, Xie S, Qiao L, et al. A long working distance optical microscope for synchrotron infrared and Raman microspectroscopy. Infrared Phys Techn, 2025, 147: 105818
|
| [30] |
Liu Z, Wang L, Jiang Y, et al. The dynamics beamline at SSRF. Nucl Sci Tech, 2024, 35: 153. |
| [31] |
Mayer RA, Feres FH, Freitas RO. Synchrotron infrared nanospectroscopy as a game changer in nanophotonics[C]//2021 SBFoton international optics and photonics conference (SBFoton IOPC), 2021: 1-6
|
| [32] |
Dazzi A, Prazeres R, Glotin F, et al. Local infrared microspectroscopy with subwavelength spatial resolution with an atomic force microscope tip used as a photothermal sensor. Opt Lett, 2005, 30: 2388-90. |
| [33] |
Nowak D, Morrison W, Wickramasinghe HK, et al. Nanoscale chemical imaging by photoinduced force microscopy. Sci Adv, 2016, 2: e1501571. |
| [34] |
Knoll B, Keilmann F. Near-field probing of vibrational absorption for chemical microscopy. Nature, 1999, 399: 134-7. |
| [35] |
Zenhausern F, Martin Y, Wickramasinghe HK. Scanning interferometric apertureless microscopy: optical imaging at 10 angstrom resolution. Science, 1995, 269: 1083-5. |
| [36] |
Frogley MD, Lekkas I, Kelley CS, et al. Performances for broadband synchrotron photothermal infrared nano-spectroscopy at diamond light source. Infrared Phys Techn, 2020, 105: 103238. |
| [37] |
Wehmeier L, Liu M, Park S, et al. Ultrabroadband terahertz near-field nanospectroscopy with a HgCdTe detector. ACS Photonics, 2023, 10: 4329-39. |
| [38] |
Shin S. New era of synchrotron radiation: fourth-generation storage ring. AAPPS Bulletin, 2021, 31: 21. |
| [39] |
Raimondi P, Benabderrahmane C, Berkvens P, et al. The extremely brilliant source storage ring of the European Synchrotron Radiation Facility. Commun Phys, 2023, 6: 82. |
| [40] |
Santos TM, Lordano S, Mayer RA, et al. Synchrotron infrared nanospectroscopy in fourth-generation storage rings. J Synchrotron Radiat, 2024, 31: 547-56. |
| [41] |
Cinque G, Frogley MD, Bartolini R. Far-IR/THz spectral characterization of the coherent synchrotron radiation emission at diamond IR beamline B22. Rend Fis Acc Lincei, 2011, 22: 33-47. |
| [42] |
Roy P, Rouzières M, Qi Z, et al. The AILES infrared beamline on the third generation synchrotron radiation facility SOLEIL. Infrared Phys Techn, 2006, 49: 139-46. |
| [43] |
Abo-Bakr M, Feikes J, Holldack K, et al. Brilliant, coherent far-infrared (THz) synchrotron radiation. Phys Rev Lett, 2003, 90: 094801. |
| [44] |
Vita N, Brubach JB, Hienerwadel R, et al. Electrochemically induced far-infrared difference spectroscopy on metalloproteins using advanced synchrotron technology. Anal Chem, 2013, 85: 2891-8. |
| [45] |
Vilagosh Z, Lajevardipour A, Appadoo D, et al. Characterisation of biological materials at THz frequencies by attenuated total reflection: lard. Appl Sci, 2020, 10: 8692. |
| [46] |
Ivanova EP, Nguyen THP, Linklater DP, et al. Adaptations of Escherichia coli k 12 to synchrotron sourced THz radiation. ACS Omega, 2024, 9: 49878-86. |
| [47] |
Romanenko S, Appadoo D, Lawler N, et al. Terahertz radiation stimulates neurite growth in PC12 derived neurons during development phase: preliminary study[C]//2020 45th international conference on infrared, millimeter, and terahertz waves (IRMMW-THz), 2020: 1-2
|
| [48] |
Ji T, Tong Y, Zhu H, et al. The status of the first infrared beamline at Shanghai synchrotron radiation facility. Nucl Instrum Methods Phys Res Sect A, 2015, 788: 116-21. |
| [49] |
Zhou X, Zhong J, Dong J, et al. The BL01B1 infrared beamline at Shanghai synchrotron radiation facility. Infrared Phys Techn, 2018, 94: 250-4. |
| [50] |
Zhou X, Zhu H, Zhong J, et al. New status of the infrared beamlines at SSRF. Nucl Sci Tech, 2019, 30: 182. |
| [51] |
周晓洁, 钟佳佳, 常超, 等. 微流控芯片、微流控系统及红外微流控分析方法: 中国, 201910825025.8[P]. 2019-10-15
|
| [52] |
周晓洁, 钟佳佳, 俞文杰, 等. 一种红外微流控芯片液体池以及制备方法以及一种活细胞的FTIR分析方法: 中国, 202110762703.8[P]. 2021-10-08
|
| [53] |
Liu X, Qiao Z, Chai Y, et al. Nonthermal and reversible control of neuronal signaling and behavior by midinfrared stimulation. Proc Natl Acad Sci U S A, 2021, 118: e2015685118. |
| [54] |
Silva L, Oliveira AC, Vieira TC, et al. High-pressure chemical biology and biotechnology. Chem Rev, 2014, 114: 7239-67. |
| [55] |
钟佳佳, 周晓洁, 俞文杰, 等. 蛋白质溶液构象变化分析系统: 中国, 202411656188.5[P]. 2025-02-25
|
| [56] |
Fabian H, Naumann D. Methods to study protein folding by stopped-flow FT-IR. Methods, 2004, 34: 28-40. |
| [57] |
Cao X, Ye C, Cao L, et al. Biomimetic spun silk ionotronic fibers for intelligent discrimination of motions and tactile stimuli. Adv Mater, 2023, 35: 2300447. |
| [58] |
钟佳佳, 周晓洁, 唐雨钊, 等. 用于同步辐射红外线站的温控显微拉伸装置: 中国, 202010652304.1[P]. 2020-10-13
|
| [59] |
Wang Y, Wang Y, Qian J, et al. Single-cell infrared phenomics: phenotypic screening with infrared microspectroscopy. Chem Commun, 2020, 56: 13237-40. |
| [60] |
Wang Y, Dai W, Wang Y, et al. How many cells are enough for single-cell infrared spectroscopy?. Chem Commun, 2020, 56: 3773-6. |
| [61] |
Zhong J, Yu W, Tang Y, et al. Synchrotron radiation FTIR microspectroscopy study of biomolecular alterations in vincristine-treated WRL68 cells at the single-cell level. ACS Omega, 2022, 7: 47274-84. |
| [62] |
Guo Y, Chen T, Wang S, et al. Synchrotron radiation-based FTIR microspectroscopic imaging of traumatically injured mouse brain tissue slices. ACS Omega, 2020, 5: 29698-705. |
| [63] |
Yu W, Wang W, Zhou X, et al. FTIR microscopic study on biomolecular alterations in placental tissues of intrahepatic cholestasis of pregnancy. Anal Methods, 2025, 17: 1467-76. |
| [64] |
Zhou X, Wang W, Zhong J, et al. Biomolecular characterization of placental tissues in gestational diabetes mellitus using Fourier transform infrared microspectroscopy. Spectrochim Acta A, 2022, 270: 120794. |
| [65] |
Peng W, Chen S, Kong D, et al. Grade diagnosis of human glioma using Fourier transform infrared microscopy and artificial neural network. Spectrochim Acta A, 2021, 260: 119946. |
| [66] |
Guo S, Xiu J, Kong L, et al. Micro-tomographic and infrared spectral data mining for breast cancer diagnosis. OptLE, 2023, 160: 107305. |
| [67] |
Kong X, Wang F, Guo S, et al. Structural and spectral morphometry and diagnosis of lung tumors. Infrared Phys Techn, 2022, 124: 104229. |
| [68] |
Tang Y, Chen C, Liu F, et al. Structure and ingredient-based biomimetic scaffolds combining with autologous bone marrow-derived mesenchymal stem cell sheets for bone-tendon healing. Biomaterials, 2020, 241: 119837. |
| [69] |
Shi Q, Chen C, Li M, et al. Characterization of the distributions of collagen and PGs content in the decellularized book-shaped enthesis scaffolds by SR-FTIR. BMC Musculoskel Dis, 2021, 22: 235. |
| [70] |
Chen C, Shi Q, Li M, et al. Engineering an enthesis-like graft for rotator cuff repair: an approach to fabricate highly biomimetic scaffold capable of zone-specifically releasing stem cell differentiation inducers. Bioact Mater, 2022, 16: 451-71. |
| [71] |
Zhang T, Shi X, Li M, et al. Optimized allogenic decellularized meniscal scaffold modified by collagen affinity stromal cell-derived factor SDF1α for meniscal regeneration: a 6- and 12-week animal study in a rabbit model. Am J Sports Med, 2024, 52: 124-39. |
| [72] |
Wang M, Lu X, Yin X, et al. Synchrotron radiation-based Fourier-transform infrared spectromicroscopy for characterization of the protein/peptide distribution in single microspheres. Acta Pharm Sin B, 2015, 5: 270-6. |
| [73] |
Wu L, Yin X, Guo Z, et al. Hydration induced material transfer in membranes of osmotic pump tablets measured by synchrotron radiation based FTIR. Eur J Pharm Sci, 2016, 84: 132-8. |
| [74] |
Li J, Ma W, Ren X, et al. Supramolecular nano-grid platform to load and deliver liposomes and exosomes. Small Struct, 2024, 5: 2300487. |
| [75] |
Ren X, Wang S, Teng Y, et al. Engineered extracellular vesicles loaded in boronated cyclodextrin framework for pulmonary delivery. Carbohydr Polym, 2025, 352: 123160. |
 2025, Vol. 37
2025, Vol. 37 

 唐雨钊,中国科学院上海高等研究院正高级工程师,国家蛋白质科学研究(上海)设施(国家重大科技基础设施)蛋白质动态分析系统红外谱学显微线站负责人,中国生物物理学会太赫兹生物物理分会委员。1998年毕业于扬州大学,获学士学位;2001年毕业于扬州大学,获硕士学位;2009年毕业于上海交通大学,获博士学位;2009—2011年,在中国科学院上海应用物理研究所上海同步辐射光源从事博士后研究;2011年12月起,在国家蛋白质科学研究(上海)设施任高级工程师;2012—2013年,在加拿大国家光源中红外线站任高级访问学者;2019年12月任中国科学院上海高等研究院正高级工程师。唐雨钊博士主要从事同步辐射红外谱学显微应用研究及相关技术研发工作。带领团队开展了间充质干细胞、人工纺丝、妊娠期糖尿病胎盘组织等红外谱学显微研究工作,拓展了同步辐射太赫兹波段应用。团队研发的微流控装置实现了活体环境下红外谱学显微成像,研发搭建的远红外波段高分辨谱学成像系统已投入应用。参与编写三部专著章节,申请发明专利5项,3项已授权。团队在Nature、PNAS、Advanced Material等杂志发表论文30余篇。入选中国科学院2022年度技术支撑人才、2023年浦东明珠计划“领军人才”项目
唐雨钊,中国科学院上海高等研究院正高级工程师,国家蛋白质科学研究(上海)设施(国家重大科技基础设施)蛋白质动态分析系统红外谱学显微线站负责人,中国生物物理学会太赫兹生物物理分会委员。1998年毕业于扬州大学,获学士学位;2001年毕业于扬州大学,获硕士学位;2009年毕业于上海交通大学,获博士学位;2009—2011年,在中国科学院上海应用物理研究所上海同步辐射光源从事博士后研究;2011年12月起,在国家蛋白质科学研究(上海)设施任高级工程师;2012—2013年,在加拿大国家光源中红外线站任高级访问学者;2019年12月任中国科学院上海高等研究院正高级工程师。唐雨钊博士主要从事同步辐射红外谱学显微应用研究及相关技术研发工作。带领团队开展了间充质干细胞、人工纺丝、妊娠期糖尿病胎盘组织等红外谱学显微研究工作,拓展了同步辐射太赫兹波段应用。团队研发的微流控装置实现了活体环境下红外谱学显微成像,研发搭建的远红外波段高分辨谱学成像系统已投入应用。参与编写三部专著章节,申请发明专利5项,3项已授权。团队在Nature、PNAS、Advanced Material等杂志发表论文30余篇。入选中国科学院2022年度技术支撑人才、2023年浦东明珠计划“领军人才”项目