水稻(Oryza sativa)是我国的主粮作物,其健康稳定的生产直接关系到国家的粮食安全。稻飞虱是影响我国水稻生产的最主要的虫害之一,在稻飞虱暴发年份,其发生面积超过3 000万公顷,实际造成水稻产量损失超200万吨,超过当年份全国水稻总产的1% [1]。稻飞虱中尤以褐飞虱(Nilaparvata lugens Stål, brown planthopper, BPH)在国内危害范围最广、危害程度最深[2]。褐飞虱是属于半翅目(Hemiptera)飞虱科(Delphacidae)褐飞虱属(Nilaparvata)的单食性刺吸式口器害虫,利用针状口器刺吸水稻韧皮部汁液;同时,褐飞虱的产卵器能够划破水稻叶片或叶鞘组织,造成水分散失并更易被病原菌侵染,被褐飞虱为害后的水稻往往长势减弱,结实率降低[3]。此外,褐飞虱还可以携带并传播水稻锯齿叶矮缩病毒(rice ragged stunt virus, RRSV)和水稻草矮缩病毒(rice grass stunt virus, RGSV),加剧对水稻生产的危害[4]。褐飞虱的发生具有突发性和暴发性,并因其高繁殖力和迁飞性而难以防治,目前农业生产中对于褐飞虱的防治仍主要依赖于化学杀虫剂。然而,农药的过度使用不仅加速了褐飞虱种群抗药性的产生,也造成了日趋严重的环境污染、生态危害等问题[4]。当前,利用水稻自身抗性培育优质抗虫水稻品种,是褐飞虱绿色防控最经济有效的手段之一。自20世纪60年代起,抗褐飞虱水稻品种相继被报道,但其携带的抗性基因以及抗虫机理尚不明确[5]。进入21世纪,随着现代分子生物学技术的快速发展,多个褐飞虱抗性基因被克隆鉴定,水稻对褐飞虱的抗性机制逐步被解析。本文对目前已鉴定的褐飞虱抗性基因、褐飞虱诱导的水稻防御和褐飞虱的反防御策略进行概述,并对水稻和褐飞虱互作研究中的重要科学问题和未来方向进行讨论与展望。
1 褐飞虱抗性基因的研究1969年,Pathak等[5]首次报道了水稻对褐飞虱的抗性。此后,研究者们陆续在野生稻和栽培稻中发现了40多个褐飞虱数量抗性位点(quantitative trait loci, QTL)。这些QTL中通常含有褐飞虱抗性基因(又称为Bph基因)。
2009年,武汉大学何光存教授团队利用图位克隆鉴定了水稻中第一个褐飞虱抗性基因Bph14 [6]。Bph14编码一个CC-NB-LRR (coiled-coiled nucleotide-binding leucine-rich repeat)受体蛋白,Bph14能够与WRKY46和WRKY72转录因子互作,稳定并提高两个WRKY的蛋白水平,继而促进如细胞质激酶RLCK281和胼胝质合成酶等下游基因的表达,降低褐飞虱的取食活性[7]。该团队最新研究表明,Bph14可以作为受体特异性识别褐飞虱分泌的唾液效应子蛋白BISP (Bph14-interacting salivary protein),从而诱导BISP蛋白的降解并激活水稻对褐飞虱的防御反应[8]。除Bph14以外,该团队还陆续克隆了Bph9、Bph6、Bph37、Bph30、Bph40等抗性基因。Bph9与Bph1、Bph2、Bph7、Bph10、Bph18、Bph21和Bph26多个抗性基因呈复等位基因关系,编码一种罕见类型的富含亮氨酸重复受体蛋白(nucleotide-binding leucine-rich repeat, NLR),能够诱导细胞过敏性坏死反应,激活一条依赖于茉莉酸(jasmonate, JA)和水杨酸(salicylic acid, SA)的防御途径[9]。Bph6编码的蛋白定位于与囊泡运输相关的胞泌复合体Exocyst。Bph6通过与胞泌复合体亚基OsEXO70E1互作,促进细胞内蛋白向胞外分泌,增强细胞壁中纤维素和半纤维素的积累,强化细胞壁厚度,从而阻碍褐飞虱的取食[10]。另外,Bph6还可与胞泌复合体亚基OsEXO70H3互作,促进腺苷甲硫氨酸合成酶OsSMASL分泌到胞外,增加细胞壁中木质素的沉积以增强抗虫性[11]。Bph30编码一个含有2个富含亮氨酸结构域(leucine-rich domains, LRDs)的蛋白,在水稻叶鞘厚壁组织细胞中高表达。Bph30能够上调厚壁组织细胞中纤维素和半纤维素合成相关基因的表达,增加纤维素和半纤维素在厚壁组织中的积累,从而增加厚壁组织的厚度与细胞壁的硬度。当取食含有Bph30的水稻叶鞘时,褐飞虱的口器难以穿透厚壁组织到达韧皮部[12]。Bph40编码一个LRD蛋白,与Bph30功能类似。研究表明在含有Bph40的水稻中多个纤维素和半纤维素合成相关基因表达上调,厚壁组织细胞壁中的纤维素和半纤维素含量也显著升高[12]。
南京农业大学万建民院士团队从斯里兰卡籼稻Rathu Heenati中克隆了Bph3 基因。Bph3是由OsLecRK1-OsLecRK3串联组成的基因簇,和Bph15位于同一区域,这3个LecRK基因编码定位于细胞质膜上的G型凝集素类受体激酶,其抗虫效果具有累加效应,通过转基因技术将Bph3导入褐飞虱易感的水稻品种,能够显著增强其对褐飞虱和白背飞虱的抗性[13]。除上述之外,国内外其他团队也克隆了多个Bph基因。Bph29是一个褐飞虱隐性抗性基因,编码一个包含B3核酸结合域的蛋白,定位于细胞核,该基因在水稻维管束组织中特异性表达,并受褐飞虱为害抑制。Bph29正调控SA信号途径,并负调控JA和乙烯信号途径[14]。Bph32编码独特的短同源重复序列(short consensus repeat, SCR)蛋白,是一个褐飞虱显性抗性基因,在褐飞虱为害的水稻叶鞘中表达上调,通过降低褐飞虱的取食提高水稻对褐飞虱的抗性[15]。表 1列出了水稻中已克隆鉴定的褐飞虱抗性基因。
| 表 1 水稻中已克隆鉴定的褐飞虱抗性基因 |
当受到褐飞虱为害时,水稻通过细胞膜表面的模式识别受体(pattern recognition receptors, PRRs)识别褐飞虱取食或产卵过程中释放的植食性昆虫相关分子模式(herbivore-associated molecular patterns, HAMPs)或损伤相关分子模式(damage-associated molecular patterns, DAMPs),从而激活防御响应相关的早期信号事件,例如胞质钙离子(calcium ion, Ca2+)浓度的升高、活性氧(reactive oxygen species, ROS)的爆发和促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)级联途径的活化等[19],然后通过激素信号途径和转录因子激活防御相关基因的表达,使水稻产生对褐飞虱的基础抗性。
2.1 褐飞虱为害释放的信号分子褐飞虱取食或产卵会对水稻造成机械损伤,促使水稻释放DAMPs。DAMPs通常为细胞受应激或损伤后产生的游离核酸、蛋白质、离子、聚糖、代谢产物等 [19-20]。Shen等[21]研究发现,OsPep3 (peptide 3)小肽是水稻在褐飞虱为害时产生的重要DAMP分子,该小肽前体基因表达水平受褐飞虱为害诱导上调,OsPep3通过上调水稻中苯丙烷、脂质及JA途径代谢产物的积累,正调控水稻对褐飞虱的抗性。HAMPs也被称为激发子,包含很多昆虫唾液中鉴定的化合物或者蛋白质。褐飞虱唾液中一些分泌蛋白被鉴定为HAMPs,可以被水稻特异性识别,并激活水稻的防御反应。Shangguan等[22]报道了一种在褐飞虱唾液腺中高丰度表达的类黏蛋白NlMLP,NlMLP被分泌到水稻组织后能够促进细胞Ca2+浓度的上升、MEK2 (mitogen-activated protein kinase kinase 2)激酶和JA信号途径的激活,使得防御相关基因表达上调,诱导细胞凋亡和胼胝质沉积。Huang等[23]通过筛选褐飞虱唾液蛋白质组鉴定出一种蛋白——NlSP1 (N. lugens salivary protein 1),其能够被分泌到水稻组织中,诱导植物细胞凋亡、过氧化氢(hydrogen peroxide, H2O2)积累、防御相关基因表达以及胼胝质沉积。Gao等[24-25]从褐飞虱唾液腺中鉴定出唾液蛋白组分NlG14及NlDNAJB9,它们随褐飞虱取食进入水稻植株,能够诱导植物细胞凋亡、ROS爆发、胼胝质积累以及JA信号途径激活。有研究发现,褐飞虱产卵过程中释放的蛋白也可以作为激发子。卵黄原蛋白(vitellogenin, Vg)是昆虫发育和生殖所需的重要蛋白,Zeng等[26]发现褐飞虱在产卵和取食过程中,会释放卵黄原蛋白的N端亚基NlVgN进入水稻组织,诱导水稻JA的积累和下游防御相关基因的表达,促进水稻挥发物的释放,从而吸引更多褐飞虱卵寄生蜂。外用体外纯化的NlVgN还降低了褐飞虱卵的孵化率,在水稻中过表达NlVgN能够持续性激活H2O2信号。除取食和产卵中释放的激发子外,褐飞虱排泄的蜜露也能够诱导水稻直接和间接的防御反应。另外,褐飞虱排泄的蜜露中的微生物菌群可作为活性组分,促进水稻叶片中植保素的积累,诱导芳樟醇等水稻挥发性物质的释放[27]。
2.2 水稻抗褐飞虱相关的信号途径 2.2.1 受体蛋白目前对褐飞虱DAMPs和HAMPs相关受体的研究较少,仅有一例报道。OsPEPR1和OsPEPR2 (peptide receptor 1/2)是水稻内源性小肽激发子OsPep3的受体,编码定位于细胞膜表面的LRR受体蛋白,两个基因在褐飞虱取食后表达上调。敲除OsPEPR1/2使水稻不再响应OsPep3,显著削弱了水稻对褐飞虱的抗性[21];而当水稻体内过表达OsPEPR1时,其对于OsPep3的响应更加敏感,能够积累更高水平的酚胺化合物和稻壳素[28]。体细胞胚胎发生受体类蛋白激酶(somatic embryogenesis receptor-like kinases, SERKs)是一类模式识别受体的共受体,参与很多防御信号的传递[29]。沉默水稻中的OsSERK1或敲除OsSERK2降低了植株对褐飞虱的抗性,而分别过表达这两个OsSERK则提高了水稻的抗虫性[30],这些结果暗示水稻OsSERK1和OsSERK2可能参与识别褐飞虱为害释放的信号分子。
2.2.2 MAPK信号级联MAPK级联是真核生物中保守的信号途径,包含MAPKKK-MAPKK-MAPK三级磷酸化级联,作用于模式识别受体下游,将外界刺激信号逐级放大;MAPK通过磷酸化转录因子、酶等底物,实现对信号的传递[31-32]。在水稻中,MAPK信号途径被报道参与褐飞虱诱导的防御反应。水稻MAPKK基因家族成员OsMKK3的表达受褐飞虱为害诱导显著上调,过表达OsMKK3降低了褐飞虱卵的孵化率、若虫的存活率和成虫的产卵量[33]。褐飞虱成虫为害也可以诱导水稻中的一个MAPK成员OsMAPK20-5的表达,沉默该基因显著提高了水稻对褐飞虱成虫的抗性并降低了褐飞虱卵的孵化率;机理研究表明,OsMAPK20-5可能通过抑制一氧化氮(nitric oxid, NO)的积累来负调控水稻对褐飞虱的抗性[34]。
2.2.3 JA信号途径植物激素信号途径广泛参与植物的抗虫性,而JA信号途径在植物抗虫中发挥核心的作用[19]。当受到植食性昆虫为害时,植物体内JA合成被激活,JA可以被代谢成各种各样的衍生物;其中,JA在茉莉酸氨基酸合成酶(JASMONATE RESISTANT1, JAR1)的催化下与异亮氨酸(isoleucine, Ile)偶联生成JA-Ile,该化合物是维管植物中主要的活性JA分子[19, 35-36]。我们课题组的研究表明,JA信号途径主要参与了水稻对褐飞虱的抗性。我们通过对褐飞虱雌成虫为害水稻叶鞘不同时间点样品的转录组进行分析,发现差异表达基因主要富集于JA相关信号途径;褐飞虱为害后,水稻中JA合成和响应相关基因的表达显著上调,JA分子的含量也显著提高[37]。JA衍生物处理降低了水稻上褐飞虱卵的孵化率和若虫的存活率[10, 38];同时,外施JA能够诱导水稻植株释放出更多的挥发物吸引天敌稻虱缨小蜂(Anagrus nilaparvatae),提高水稻的间接抗性[39]。
敲除JA合成基因AOC (allene oxide cyclase)或OPDA还原酶基因OsOPR7 降低了水稻中褐飞虱诱导的JA、JA-Ile的水平以及水稻对褐飞虱的抗性 [37, 40-41]。过表达水稻JA代谢酶基因OsJMT1 (JA carboxyl methyltransferase 1)导致褐飞虱诱导的JA和JA-Ile含量降低、茉莉酸甲酯(methyl-JA, MeJA)含量升高,过表达植株对褐飞虱雌成虫的抗性增强[42]。而过表达AOC或一个JA合成相关的脂氧合酶RCI导致水稻体内积累更多的JA信号分子,并且表现出对褐飞虱的抗性增强[43-44]。另外,敲除参与JA信号转导的MYC2转录因子或者JA受体蛋白COI (CORONATINE INSENSITIVE)1a/1b、COI2后,褐飞虱卵在这些突变体上的孵化率更高、孵化历期更短[37, 45]。
我们还利用MeJA、褐飞虱、稻纵卷叶螟和黏虫处理过的不同组织、不同时间点的196个转录组数据以及MYC2的染色质免疫共沉淀测序(chromatin immunoprecipitation sequencing, ChIP-seq)数据,构建了水稻JA介导的防御信号网络,把水稻JA的防御响应分成了MYC2转录因子介导的转录调控模块、组织特异性表达模块以及JA负反馈调节模块。通过对模块中的bHLH6、TPS35、NAC1、NAC3和NAC4基因的功能分析,证实了这些模块基因都参与了水稻对褐飞虱的抗性[37, 46]。
2.2.4 其他激素信号途径SA信号途径被报道正调控拟南芥和番茄对蚜虫的抗性[47-48]。我们前期的研究表明,受褐飞虱为害的叶鞘中SA水平并无显著变化,敲除水稻SA受体NPR1或者过表达细菌来源的SA羟化酶基因NahG均不影响褐飞虱卵的孵化率[37]。而另外一项研究表明,NahG过表达的水稻对褐飞虱若虫的抗性减弱[49]。两项研究结果的不同可能是由于所选用的背景品种以及褐飞虱虫龄不一致所导致。在含有Bph6和Bph9的抗性水稻中,褐飞虱为害早期诱导的SA的含量显著高于对照植株[9-10],并且外源施加SA提高了水稻对褐飞虱若虫的抗性[10]。在He等[49]的研究中还发现,苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)参与了水稻对褐飞虱的抗性,PAL是苯丙素代谢途径最上游的催化酶,不但参与SA的合成,还参与很多苯丙素类次生代谢产物的合成。因此,SA信号途径是否以及如何在水稻抗褐飞虱中发挥作用还需要更多的研究解析。
其他激素信号途径被报道也参与了水稻对褐飞虱的抗性,并且许多激素都是通过和JA途径互作来调控水稻的抗虫性。乙烯信号途径被认为负调控水稻对褐飞虱的抗性。沉默乙烯合成酶基因OsACS2增强了褐飞虱诱导的挥发物的释放,从而增强了水稻对褐飞虱的直接和间接抗性[50]。褐飞虱为害能显著诱导水稻E3泛素连接酶OsEBF1 (EIN3-binding F-box protein 1)和OsEBF2基因的表达,OsEBF1和OsEBF2通过介导OsEIL1 (ethylene insensitive 3-like 1)转录因子的降解抑制乙烯信号途径,从而正调控水稻对褐飞虱的抗性[51-52]。Huang等[53]首次报道了光照强度正调控水稻对褐飞虱抗性,光敏色素互作因子(phytochrome-interacting factors) OsPIL14可结合乙烯合成酶基因OsACO1的启动子并激活其表达;在光照条件下,光敏色素OsPhyB介导了OsPIL14蛋白的降解,导致乙烯合成受阻,从而提高对褐飞虱的抗性。脱落酸在植物应对干旱、盐、冷或高温等非生物胁迫中发挥作用[54]。研究表明,水稻中脱落酸还正调控褐飞虱的抗性。外源施加脱落酸或干旱处理能够引起水稻体内胼胝质积累,抑制褐飞虱的取食和产卵行为,从而提高水稻对褐飞虱的抗性[55-56]。过表达水稻脱落酸合成相关的9-顺式环氧类胡萝卜素双加氧酶基因3 (9-cis-epoxycaro-tenoid dioxygenase 3, NCED3)提高了褐飞虱诱导的脱落酸、JA和JA-Ile的含量,该株系对褐飞虱具有更强的抗性[57]。水稻脱落酸代谢基因OsABA8ox3的敲除植株对褐飞虱的抗性也显著提高[58]。
生长素是促进植物生长发育的重要激素,有研究报道其负调控水稻对褐飞虱的抗性。Bph40近等基因系植株中组成型和褐飞虱诱导的生长素的含量均显著低于对照植株;外源施加生长素降低了水稻对褐飞虱的抗性[59]。细胞分裂素是一类促进细胞分裂和组织分化的植物激素。水稻细胞分裂素代谢基因OsCKX1的敲除植株对褐飞虱为害的耐受性提高;细胞分裂素可能是通过上调JA的含量来实现其对褐飞虱的抗性[41]。在水稻Bph6近等基因系中,褐飞虱为害显著诱导顺式玉米素的含量增加,表明细胞分裂素可能在Bph6介导的褐飞虱抗性中发挥作用[10]。赤霉素是重要的生长相关激素,参与植物生长发育的各个阶段。沉默水稻赤霉素信号途径的阻遏蛋白基因OsSLR1或通过外施GA3处理水稻,可提升水稻对褐飞虱的抗性[60-61]。赤霉素合成突变体sd-1对褐飞虱的抗性降低,而赤霉素过量的突变体eui对褐飞虱的抗性提高[62],表明赤霉素正调控对褐飞虱的抗性。油菜素内酯是一类参与调节植物生长发育及对病原菌抗性的植物激素。研究表明,外施油菜素内酯处理或者油菜素内酯过度积累的水稻(slg-D或m107)对褐飞虱的抗性降低,而油菜素内酯缺乏的突变体(lhdd10)对褐飞虱具有更强的抗性[63]。
2.2.5 转录因子在水稻中已鉴定许多调控褐飞虱抗性的转录因子。MYC2属于bHLH (basic helix-loop-helix)家族转录因子,是JA信号途径的核心调控元件[64]。水稻基因组中仅编码一个MYC2蛋白,MYC2敲除突变体对褐飞虱为害的耐受性显著降低,褐飞虱卵在其上的孵化率更高、孵化历期更短[37, 65]。我们课题组通过染色质免疫共沉淀测序发现,MYC2能够直接结合并调控大量JA响应基因。MYC2一方面通过其调控的转录因子级联,在JA信号转导初期对信号级联进行放大;另一方面,其直接调控次生代谢合成相关基因,广泛参与水稻的诱导抗性[37, 46]。OsbHLH6是位于MYC2下游的转录因子,参与调控部分JA响应,bhlh6敲除突变体对褐飞虱的抗性减弱[46]。
中国科学院分子植物卓越创新中心苗雪霞研究员团队鉴定了多个褐飞虱抗性相关的转录因子,并解析了其调控机制。OsMYB22能够与共抑制子TOPLESS及去乙酰化酶HDAC1形成MYB22-TOPLESS-HDAC1转录抑制复合体,协同抑制下游黄烷酮3′-羟化酶(flavanone 3-hydroxylase, F3′H)基因的转录,正调控水稻对褐飞虱的抗性[66]。HD-Zip Ⅳ转录因子ROC4 (rice outermost cell-specific 4)和ROC5分别通过调控水稻蜡质的生物合成和泡状细胞发育,正调控水稻对褐飞虱的抗性[67]。水稻生长相关的GRF8 (growth regulating factor 8)转录因子可以直接调控黄烷酮3-羟化酶(OsF3H)基因的表达,从而正调控水稻类黄酮的含量和褐飞虱抗性[68]。水稻microRNA中的miR396被褐飞虱为害诱导表达,能够特异性靶向GRF8的mRNA并抑制其翻译。而另外一个小RNA——miR319可以靶向TCP (teosinte branched 1/cycloidea/proliferating cell factor)类型的转录因子OsPCF5 [69],OsPCF5和OsMYB22、OsMYB30、OsMYB30C互作正调控水稻对褐飞虱的抗性。该团队还发现OsbHLH61-OsbHLH96转录因子级联可能位于JA信号途径下游,正调控对褐飞虱的抗性[70]。此外,万建民院士团队研究发现,褐飞虱为害时,OsMYB30转录因子直接结合PAL6和PAL8基因启动子上的特定元件并正调控两个基因的表达,从而调节SA和木质素的生物合成,影响水稻对褐飞虱的抗性[49]。何光存教授团队的研究发现,Bph14可以和WRKY46/72互作并增强两个转录因子的稳定性,WRKY46/72通过调控类受体激酶RLCK281以及胼胝质合成酶基因的表达参与水稻对褐飞虱的抗性[7]。
水稻中也存在诸多负调控褐飞虱抗性的转录因子。OsERF3 (ethylene-responsive transcriptional factor 3)是乙烯信号途径的重要转录因子,其基因表达受褐飞虱为害诱导上调,但负调控水稻对褐飞虱的抗性[71]。过表达乙烯应答转录因子OsEIL2减弱了水稻对褐飞虱的抗性,而沉默该基因的水稻对褐飞虱的抗性增强[53]。敲除水稻转录因子NAC1、NAC3和NAC4提高了褐飞虱诱导的JA响应基因的表达,敲除突变体上褐飞虱卵的孵化率降低、孵化历期延长[46]。表 2列出了水稻中已鉴定的一些参与褐飞虱抗性的转录因子。
| 表 2 水稻中参与褐飞虱抗性的转录因子 |
植食性昆虫为害会诱导植物产生大量的次生代谢产物、防御蛋白或大分子聚合物,这些物质在植物抗虫中发挥了重要作用。根据理化性质,可以将它们分为挥发性和非挥发性物质。目前,在水稻中鉴定的与褐飞虱抗性相关的物质还比较少。
2.3.1 挥发性物质浙江大学娄永根教授团队发现,当遭受褐飞虱为害时,水稻可产生大量的挥发物,包括绿叶挥发物(green leaf volatiles, GLVs)、萜类化合物[72-73]、甲基酮类化合物以及苯甲酸酯类化合物等[74],这些挥发物的生物合成多数受到JA信号途径调控[37, 46]。S-芳樟醇(linalool)对褐飞虱的取食和产卵具有趋避作用,而对褐飞虱卵的寄生性天敌——稻虱缨小蜂具有吸引作用。在田间,芳樟醇合成酶基因OsLIS (linalool synthase, LIS)沉默的水稻品系上褐飞虱种群密度远高于对照组植株[74]。氢过氧化物裂解酶(hydroperoxide lyase, HPL)基因OsHPL3参与GLVs的生物合成,在OsHPL3敲除突变体中,顺-3-己烯-1-醇无法合成,并导致该植株对褐飞虱雌成虫和若虫的抗性降低[73]。另外,2-庚酮和2-庚醇对褐飞虱的取食和产卵有一定的趋避作用[44, 50]。在田间施用水杨酸甲酯、顺-3-己烯醛、顺-3-己烯乙酸酯和芳樟醇组成的混合物,显著提高了水稻上褐飞虱卵的寄生率[75]。此外,最新的一项研究表明,低浓度的S-柠檬烯对褐飞虱成虫具有吸引作用,而高浓度的S-柠檬烯则产生趋避作用。褐飞虱卵在S-柠檬烯合成酶基因OsTPS19/OsTPS20过表达植株上的孵化率显著低于野生型植株;在田间,OsTPS19/OsTPS20过表达品系上褐飞虱的数量相较于野生型更少,而敲除品系则更多[76]。
2.3.2 非挥发性物质目前已报道的对褐飞虱具有防御作用的非挥发性物质包括酚胺类化合物、樱花素、木质素和胼胝质。酚胺类化合物是苯丙素代谢途径产生的酚酸和多胺的螯合物,广泛分布于不同的植物体内[77]。褐飞虱危害会显著性诱导多种酚胺类化合物的积累,在人工饲料中添加对香豆酰腐胺或阿魏酰腐能够降低褐飞虱成虫的存活率[78]。樱花素是苯丙素代谢途径中的一种黄酮类化合物,由柚皮素O-甲基转移酶NOMT1催化合成。褐飞虱为害会诱导NOMT1基因的表达以及樱花素的大量积累,NOMT1敲除突变体对褐飞虱的抗性降低。进一步研究发现,樱花素可以抑制褐飞虱体内的有益内生菌——类酵母共生菌,从而影响褐飞虱的生长发育[79]。异戊胺也是一种褐飞虱为害诱导上调的化合物,在水稻中添加异戊胺降低了褐飞虱成虫的取食量以及存活率[80]。同时,以上所述化合物的生物合成都是受经典的JA信号途径所调控[37, 45, 79, 80]。木质素、纤维素、半纤维素和胼胝质等细胞壁中的大分子聚合物在水稻抗褐飞虱中也发挥重要的功能。其中,木质素和胼胝质在褐飞虱为害的叶鞘中被诱导沉积,形成物理性屏障,影响褐飞虱的取食[6, 49, 55, 60]。而纤维素和半纤维素在携带Bph30和Bph40的抗性水稻品种中组成性地高积累,使得厚壁细胞增厚,阻碍了褐飞虱口针的穿刺[12]。
3 褐飞虱的反防御策略褐飞虱在与水稻的协同进化中,发展出了克服水稻防御的策略。目前研究集中在褐飞虱唾液中一些效应子蛋白的鉴定。褐飞虱唾液蛋白endo-β-1, 4-glucanase (NlEG1)随取食被分泌到水稻中,NlEG1能够降解细胞壁中的纤维素,使褐飞虱更顺利地取食韧皮部汁液。沉默NlEG1降低了褐飞虱取食能力,导致其在水稻上的取食量、产卵量和存活率都显著下降[81]。Ye等[82]在褐飞虱唾液腺中鉴定了一种EF-手形Ca2+结合蛋白——NlSEF1,该蛋白随着褐飞虱取食进入水稻组织中。外源施加体外纯化的NlSEF1蛋白则能够抑制H2O2的积累,而沉默NlSEF1的褐飞虱取食水稻可以引起更强烈的Ca2+和H2O2水平升高,并且褐飞虱的取食量和存活率下降。褐飞虱唾液腺中的钙调蛋白(calmodulin, CaM)起到类似作用,沉默CaM的褐飞虱取食时能激发水稻产生更多的H2O2和胼胝质,阻碍褐飞虱在水稻韧皮部的取食[83]。BISP是一个能和水稻Bph14互作的唾液效应子蛋白,在不含有Bph14抗性基因的水稻品种中,BISP随着褐飞虱的取食进入水稻细胞并靶向水稻细胞质激酶OsRLCK185,干扰其激酶活性,阻碍防御信号的传递[8]。细胞内快速的酸化可诱导水稻的防御反应,但褐飞虱在取食过程中通过分泌唾液蛋白碳酸酐酶——NlCA (carbonic anhydrase)来维持水稻细胞内pH的稳态,从而削弱了水稻的防御响应[84]。有趣的是,褐飞虱唾液中的miRNA也可以跨界发挥调控作用,褐飞虱miR-7-5P通过抑制水稻bZIP43的表达而削弱其介导的防御反应,miR-7-5P合成前体基因沉默的褐飞虱取食时会引起水稻更强的抗虫防御反应[85]。另一方面,褐飞虱能够调控水稻感虫基因表达,降低水稻抗虫性以提高自身适合度。OsLRR2类受体蛋白激酶基因是一个水稻感虫基因,在褐飞虱雌成虫为害后强烈地上调表达,OsLRR2能够与细胞质膜上的共受体OsSERK1/2互作,从而阻碍损伤相关模式识别受体OsPEPR1与OsSERK1/2的结合,抑制水稻对褐飞虱的防御反应[30]。
除上述主动防御外,褐飞虱也可以通过自身的解毒系统进行被动防御。例如,褐飞虱的谷胱甘肽S-转移酶(glutathione S-transferases, GSTs)以及羧酸酯酶(carboxylesterase, CarE)被报道参与代谢水稻抗性相关次生代谢产物芦竹碱和阿魏酸[86-88]。对取食Bph6过表达水稻和野生型水稻的褐飞虱进行二代和三代转录组测序分析表明,GSTs、CarE等解毒蛋白以及过氧化氢酶、甲硫氨酸亚砜还原酶、铁蛋白等抗氧化蛋白可能参与了褐飞虱对抗性水稻品系的适应性[89]。褐飞虱针对水稻防御的解毒机制仍需要进一步研究。
4 总结与展望早在2002年4月,中国科学家就绘制了水稻基因组工作框架图[90],从此开启了水稻分子生物学研究的新时代,国内外在水稻和病原菌互作以及抗病育种研究方面进展迅速。但由于昆虫生命周期的复杂性、实验操作困难等因素,水稻和害虫互作研究相对滞后。近15年来对于水稻和褐飞虱互作的研究已经取得了大量的研究成果,突破了对褐飞虱抗性基因的克隆,解析了褐飞虱诱导的一些防御相关途径,并对褐飞虱克服水稻抗性的机制进行了探索(图 1)。但是,我们对水稻和褐飞虱互作的认知仍然十分有限。例如,(1)抗褐飞虱的QTL位点很多,但是真正克隆的抗性基因不到40%。由于早期技术的限制,很多定位的QTL区间太大,导致一些QTL存在重复或假阳性;一些QTL还可能包括多个等位或复等位基因,增加了鉴定的难度;另外,致害型褐飞虱种群克服了先前鉴定的携带Bph基因水稻品种的抗性,导致这些Bph基因无法克隆。不同抗性基因的作用机制可能存在差异,同时聚合多个抗性基因有助于解决褐飞虱对抗性基因的快速适应问题。未来可进一步优化抗感褐飞虱筛选体系以及基因定位手段,准确并快速地对抗性基因进行克隆。(2)目前鉴定的虫源或者水稻来源的激发子的数量还比较少,这些激发子如何被水稻细胞膜表面的模式识别受体所识别更是空白,研究这些将极大地推动水稻胞内虫害诱导的防御信号途径的挖掘。(3)植物的抗虫性大都与一些物理性和化学性防御物质有关,特别是虫害诱导后产生的防御物质。但是,水稻中鉴定的褐飞虱抗性物质的数量非常少,对这些物质的抗虫机理以及在水稻体内的调控机制更是知之甚少。日益发展的各种组学技术在将来会加速对这一问题的研究。(4)“基因对基因”假说认为植物存在一组抗病基因与病原菌的致病基因相匹配,从而引发植物的免疫反应。褐飞虱唾液中大量效应子的存在意味着在水稻中也可能存在一些抗性基因与之协同进化,BISP和Bph14的互作为这一猜测提供了第一个证据,未来或许可以通过效应蛋白鉴定水稻中新的抗性基因。
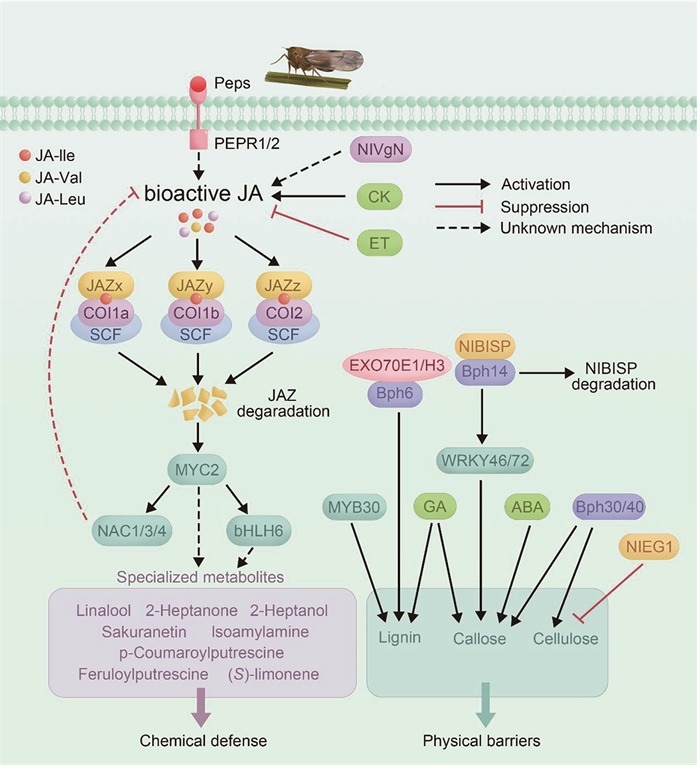
|
图 1 水稻与褐飞虱互作的分子机制 |
水稻和褐飞虱互作研究可为褐飞虱绿色防控提供新的思路,如培育褐飞虱抗性水稻品种以及开发绿色防控化合物等。我们前期的研究发现褐飞虱为害激活了水稻JA介导的基础防御,同时也抑制了水稻的生长,这是一种典型的生长和防御权衡的现象[65]。因此,在抗虫育种中要考虑提高抗性对水稻生长和产量的影响[91-92]。我们最近的一项研究发现,敲除水稻两个糖转运蛋白基因SWEET13和SWEET14可以提高对白叶枯病菌和褐飞虱的抗性,但不影响水稻的产量。SWEET13/14的敲除不改变JA介导的抗虫性,而是通过改变叶鞘韧皮部糖的含量来影响褐飞虱的取食行为[93]。基于水稻对褐飞虱的诱导抗性,还可开发水稻的诱导抗虫剂或天敌的引诱剂等。娄永根教授团队在该领域取得了很多进展,发现了4-氟苯氧乙酸是一种针对稻飞虱的高效诱导抗虫剂,而施用2, 4-二氯苯氧基乙酸可以提高水稻对稻虱缨小蜂的吸引,水稻一些挥发性物质的混剂也可以作为褐飞虱天敌的引诱剂[94-95]。未来通过对水稻JA介导的防御网络和防御化合物的研究,有望开发出新型的绿色防控化合物。
| [1] |
刘万才, 刘振东, 黄冲, 等. 近10年农作物主要病虫害发生危害情况的统计和分析. 植物保护, 2016, 42: 1-9. |
| [2] |
吕进, 祝增荣, 娄永根, 等. 稻飞虱灾变和治理研究透析. 应用昆虫学报, 2013, 50: 565-74. DOI:10.7679/j.issn.2095-1353.2013.081 |
| [3] |
芮明方, 谭宏, 沈卫新, 等. 稻褐飞虱发生规律及防治研究进展. 上海农业科技, 2011, 115-7. |
| [4] |
娄永根, 程家安. 稻飞虱灾变机理及可持续治理的基础研究. 应用昆虫学报, 2011, 48: 231-8. DOI:10.7679/j.issn.2095-1353.2011.043 |
| [5] |
Pathak MD, Cheng CH, Fortuno ME. Resistance to Nephotettix impicticeps and Nilaparvata lugens in varieties of rice. Nature, 1969, 223: 502-4. DOI:10.1038/223502a0 |
| [6] |
Du B, Zhang W, Liu B, et al. Identification and characterization of Bph14, a gene conferring resistance to brown planthopper in rice. Proc Natl Acad Sci U S A, 2009, 106: 22163-8. DOI:10.1073/pnas.0912139106 |
| [7] |
Hu L, Wu Y, Wu D, et al. The coiled-coil and nucleotide binding domains of BROWN PLANTHOPPER RESISTANCE14 function in signaling and resistance against planthopper in rice. Plant Cell, 2017, 29: 3157-85. DOI:10.1105/tpc.17.00263 |
| [8] |
Guo J, Wang H, Guan W, et al. A tripartite rheostat controls self-regulated host plant resistance to insects. Nature, 2023, 618: 799-807. DOI:10.1038/s41586-023-06197-z |
| [9] |
Zhao Y, Huang J, Wang Z, et al. Allelic diversity in an NLR gene BPH9 enables rice to combat planthopper variation. Proc Natl Acad Sci U S A, 2016, 113: 12850-5. DOI:10.1073/pnas.1614862113 |
| [10] |
Guo J, Xu C, Wu D, et al. Bph6 encodes an exocyst-localized protein and confers broad resistance to planthoppers in rice. Nat Genet, 2018, 50: 297-306. DOI:10.1038/s41588-018-0039-6 |
| [11] |
Wu D, Guo J, Zhang Q, et al. Necessity of rice resistance to planthoppers for OsEXO70H3 regulating SAMSL excretion and lignin deposition in cell walls. New Phytol, 2022, 234: 1031-46. DOI:10.1111/nph.18012 |
| [12] |
Shi S, Wang H, Nie L, et al. Bph30 confers resistance to brown planthopper by fortifying sclerenchyma in rice leaf sheaths. Mol Plant, 2021, 14: 1714-32. DOI:10.1016/j.molp.2021.07.004 |
| [13] |
Liu Y, Wu H, Chen H, et al. A gene cluster encoding lectin receptor kinases confers broad-spectrum and durable insect resistance in rice. Nat Biotechnol, 2015, 33: 301-5. DOI:10.1038/nbt.3069 |
| [14] |
Wang Y, Cao L, Zhang Y, et al. Map-based cloning and characterization of BPH29, a B3 domain-containing recessive gene conferring brown planthopper resistance in rice. J Exp Bot, 2015, 66: 6035-45. DOI:10.1093/jxb/erv318 |
| [15] |
Ren J, Gao F, Wu X, et al. Bph32, a novel gene encoding an unknown SCR domain-containing protein, confers resistance against the brown planthopper in rice. Sci Rep, 2016, 6: 37645. DOI:10.1038/srep37645 |
| [16] |
Tamura Y, Hattori M, Yoshioka H, et al. Map-based cloning and characterization of a brown planthopper eesistance gene BPH26 from Oryza sativa L. ssp. indica cultivar ADR52. Sci Rep, 2014, 4: 5872. DOI:10.1038/srep05872 |
| [17] |
Ji H, Kim SR, Kim YH, et al. Map-based cloning and characterization of the BPH18 gene from wild rice conferring resistance to brown planthopper (BPH) insect pest. Sci Rep, 2016, 6: 34376. DOI:10.1038/srep34376 |
| [18] |
Zhou C, Zhang Q, Chen Y, et al. Balancing selection and wild gene pool contribute to resistance in global rice germplasm against planthopper. J Integr Plant Biol, 2021, 63: 1695-711. DOI:10.1111/jipb.13157 |
| [19] |
Erb M, Reymond P. Molecular interactions between plants and insect herbivores. Ann Rev Plant Biol, 2019, 70: 527-57. DOI:10.1146/annurev-arplant-050718-095910 |
| [20] |
Vega-Muñoz I, Duran-Flores D, Fernández-Fernández ÁD, et al. Breaking bad news: dynamic molecular mechanisms of wound response in plants. Front Plant Sci, 2020, 11: 610445. DOI:10.3389/fpls.2020.610445 |
| [21] |
Shen W, Zhang X, Liu J, et al. Plant elicitor peptide signalling confers rice resistance to piercing-sucking insect herbivores and pathogens. Plant Biotechnol J, 2022, 20: 991-1005. DOI:10.1111/pbi.13781 |
| [22] |
Shangguan X, Zhang J, Liu B, et al. A mucin-like protein of planthopper is required for feeding and induces immunity response in plants. Plant Physiol, 2017, 176: 552-65. |
| [23] |
Huang J, Zhang N, Shan J, et al. Salivary protein 1 of brown planthopper is required for survival and induces immunity response in plants. Front Plant Sci, 2020, 11: 571280. DOI:10.3389/fpls.2020.571280 |
| [24] |
Gao H, Zou J, Lin X, et al. Nilaparvata lugens salivary protein NlG14 triggers defense response in plants. J Exp Bot, 2022, 73: 7477-87. DOI:10.1093/jxb/erac354 |
| [25] |
Gao H, Lin X, Yuan X, et al. The salivary chaperone protein NlDNAJB9 of Nilaparvata lugens activates plant immune responses. J Exp Bot, 2023, 74: 6874-88. DOI:10.1093/jxb/erad154 |
| [26] |
Zeng J, Ye W, Hu W, et al. The N-terminal subunit of vitellogenin in planthopper eggs and saliva acts as a reliable elicitor that induces defenses in rice. New Phytol, 2023, 238: 1230-44. DOI:10.1111/nph.18791 |
| [27] |
Wari D, Kabir MA, Mujiono K, et al. Honeydew-associated microbes elicit defense responses against brown planthopper in rice. J Exp Bot, 2019, 70: 1683-96. DOI:10.1093/jxb/erz041 |
| [28] |
Shinya T, Yasuda S, Hyodo K, et al. Integration of danger peptide signals with herbivore-associated molecular pattern signaling amplifies anti-herbivore defense responses in rice. Plant J, 2018, 94: 626-37. DOI:10.1111/tpj.13883 |
| [29] |
Snoeck S, Guayazan-Palacios N, Steinbrenner AD. Molecular tug-of-war: plant immune recognition of herbivory. Plant Cell, 2022, 34: 1497-513. DOI:10.1093/plcell/koac009 |
| [30] |
Kuai P, Lin N, Ye M, et al. Identification and knockout of a herbivore susceptibility gene enhances planthopper resistance and increases rice yield. Nat Food, 2024, 5: 846-59. DOI:10.1038/s43016-024-01044-4 |
| [31] |
Zhang M, Su J, Zhang Y, et al. Conveying endogenous and exogenous signals: MAPK cascades in plant growth and defense. Curr Opin Plant Biol, 2018, 45: 1-10. |
| [32] |
Xu J, Zhang S. Mitogen-activated protein kinase cascades in signaling plant growth and development. Trends Plant Sci, 2015, 20: 56-64. DOI:10.1016/j.tplants.2014.10.001 |
| [33] |
Zhou S, Chen M, Zhang Y, et al. OsMKK3, a stress-responsive protein kinase, positively regulates rice resistance to Nilaparvata lugens via phytohormone dynamics. Int J Mol Sci, 2019, 20: 3023. DOI:10.3390/ijms20123023 |
| [34] |
Li J, Liu X, Wang Q, et al. A group D MAPK protects plants from autotoxicity by suppressing herbivore-induced defense signaling. Plant Physiol, 2019, 179: 1386-401. DOI:10.1104/pp.18.01411 |
| [35] |
Chini A, Monte I, Zamarreño AM, et al. Evolution of the jasmonate ligands and their biosynthetic pathways. New Phytol, 2023, 238: 2236-46. DOI:10.1111/nph.18891 |
| [36] |
Howe GA, Major IT, Koo AJ. Modularity in jasmonate signaling for multistress resilience. Ann Rev Plant Biol, 2018, 69: 387-415. DOI:10.1146/annurev-arplant-042817-040047 |
| [37] |
Xu J, Wang X, Zu H, et al. Molecular dissection of rice phytohormone signaling involved in resistance to a piercing-sucking herbivore. New Phytol, 2021, 230: 1639-52. DOI:10.1111/nph.17251 |
| [38] |
Fu W, Jin G, Jimenez-Aleman GH, et al. The jasmonic acid-amino acid conjugates JA-Val and JA-Leu are involved in rice resistance to herbivores. Plant Cell Environ, 2022, 45: 262-72. DOI:10.1111/pce.14202 |
| [39] |
Lou YG, Du MH, Turlings TCJ, et al. Exogenous application of jasmonic acid induces volatile emissions in rice and enhances parasitism of Nilaparvata lugens Eggs by the parasitoid Anagrus nilaparvatae. J Chem Ecol, 2005, 31: 1985-2002. DOI:10.1007/s10886-005-6072-9 |
| [40] |
Li X, Wang Y, Duan E, et al. OPEN GLUME1: a key enzyme reducing the precursor of JA, participates in carbohydrate transport of lodicules during anthesis in rice. Plant Cell Rep, 2018, 37: 329-46. DOI:10.1007/s00299-017-2232-y |
| [41] |
Zhang X, Liu D, Gao D, et al. Cytokinin confers brown planthopper resistance by elevating jasmonic acid pathway in rice. Int J Mol Sci, 2022, 23: 5946. DOI:10.3390/ijms23115946 |
| [42] |
Qi J, Li J, Han X, et al. Jasmonic acid carboxyl methyltransferase regulates development and herbivory-induced defense response in rice. J Integr Plant Biol, 2016, 58: 564-76. DOI:10.1111/jipb.12436 |
| [43] |
Guo HM, Li HC, Zhou SR, et al. Cis-12-oxo-phytodienoic acid stimulates rice defense response to a piercing-sucking insect. Mol Plant, 2014, 7: 1683-92. DOI:10.1093/mp/ssu098 |
| [44] |
Liao Z, Wang L, Li C, et al. The lipoxygenase gene OsRCI-1 is involved in the biosynthesis of herbivore-induced JAs and regulates plant defense and growth in rice. Plant Cell Environ, 2022, 45: 2827-40. DOI:10.1111/pce.14341 |
| [45] |
Wang X, Chen Y, Liu S, et al. Functional dissection of rice jasmonate receptors involved in development and defense. New Phytol, 2023, 238: 2144-58. DOI:10.1111/nph.18860 |
| [46] |
Chen Y, Jin G, Liu M, et al. Multi-omic analyses reveal key sectors of jasmonate-mediated defense responses in rice. Plant Cell, 2024, 36: 3362-77. DOI:10.1093/plcell/koae159 |
| [47] |
Avila CA, Arévalo-Soliz LM, Jia L, et al. Loss of function of FATTY ACID DESATURASE7 in tomato enhances basal aphid resistance in a salicylate-dependent manner. Plant Physiol, 2012, 158: 2028-41. DOI:10.1104/pp.111.191262 |
| [48] |
Mewis I, Appel HM, Hom A, et al. Major signaling pathways modulate Arabidopsis glucosinolate accumulation and response to both phloem-feeding and chewing insects. Plant Physiol, 2005, 138: 1149-62. DOI:10.1104/pp.104.053389 |
| [49] |
He J, Liu Y, Yuan D, et al. An R2R3 MYB transcription factor confers brown planthopper resistance by regulating the phenylalanine ammonia-lyase pathway in rice. Proc Natl Acad Sci U S A, 2020, 117: 271-7. DOI:10.1073/pnas.1902771116 |
| [50] |
Lu J, Li J, Ju H, et al. Contrasting effects of ethylene biosynthesis on induced plant resistance against a chewing and a piercing-sucking herbivore in rice. Mol Plant, 2014, 7: 1670-82. DOI:10.1093/mp/ssu085 |
| [51] |
Ma F, Yang X, Shi Z, et al. Novel crosstalk between ethylene- and jasmonic acid-pathway responses to a piercing-sucking insect in rice. New Phytol, 2020, 225: 474-87. DOI:10.1111/nph.16111 |
| [52] |
Ma F, Li Z, Wang S, et al. The F-box protein OsEBF2 confers the resistance to the brown planthopper (Nilparvata lugens Stål). Plant Sci, 2023, 327: 111547. DOI:10.1016/j.plantsci.2022.111547 |
| [53] |
Huang J, Qiu ZY, He J, et al. Phytochrome B mediates dim-light-reduced insect resistance by promoting the ethylene pathway in rice. Plant Physiol, 2023, 191: 1272-87. DOI:10.1093/plphys/kiac518 |
| [54] |
Leng P, Yuan B, Guo Y. The role of abscisic acid in fruit ripening and responses to abiotic stress. J Exp Bot, 2014, 65: 4577-88. |
| [55] |
Liu J, Du H, Ding X, et al. Mechanisms of callose deposition in rice regulated by exogenous abscisic acid and its involvement in rice resistance to Nilaparvata lugens Stål (Hemiptera: Delphacidae). Pest Manag Sci, 2017, 73: 2559-68. DOI:10.1002/ps.4655 |
| [56] |
Liao G, Li J, Fan W, et al. Drought stress reduces the feeding preference of Nilaparvata lugens due to the accumulation of abscisic acid and callose deposition in rice. J Asia-Pacific Entomol, 2023, 26: 102014. DOI:10.1016/j.aspen.2022.102014 |
| [57] |
Li J, Liu H, Lv X, et al. A key ABA biosynthetic gene OsNCED3 is a positive regulator in resistance to Nilaparvata lugens in Oryza sativa. Front Plant Sci, 2024, 15: 1359315. DOI:10.3389/fpls.2024.1359315 |
| [58] |
Zhou Y, Sun L, Wang S, et al. A key ABA hydrolase gene, OsABA8ox3 is involved in rice resistance to Nilaparvata lugens by affecting callose deposition. J Asia-Pacific Entomol, 2019, 22: 625-31. DOI:10.1016/j.aspen.2019.04.008 |
| [59] |
Zhang Q, Li T, Gao M, et al. Transcriptome and metabolome profiling reveal the resistance mechanisms of rice against brown planthopper. Int J Mol Sci, 2022, 23: 4083. DOI:10.3390/ijms23084083 |
| [60] |
Zhang J, Luo T, Wang W, et al. Silencing OsSLR1 enhances the resistance of rice to the brown planthopper. Plant Cell Environ, 2017, 40: 2147-59. DOI:10.1111/pce.13012 |
| [61] |
Wang W, Jin N, Mo X, et al. Exogenous gibberellin GA3 enhances defense responses in rice to the brown planthopper Nilaparvata lugens (Stål). J Plant Biol, 2021, 64: 379-87. DOI:10.1007/s12374-020-09271-5 |
| [62] |
Li R, Zhang J, Li J, et al. Prioritizing plant defence over growth through WRKY regulation facilitates infestation by non-target herbivores. Elife, 2015, 4: e04805. DOI:10.7554/eLife.04805 |
| [63] |
Pan G, Liu Y, Ji L, et al. Brassinosteroids mediate susceptibility to brown planthopper by integrating with the salicylic acid and jasmonic acid pathways in rice. J Exp Bot, 2018, 69: 4433-42. DOI:10.1093/jxb/ery223 |
| [64] |
Kazan K, Manners JM. MYC2: the master in action. Mol Plant, 2013, 6: 686-703. DOI:10.1093/mp/sss128 |
| [65] |
Jin G, Qi J, Zu H, et al. Jasmonate-mediated gibberellin catabolism constrains growth during herbivore attack in rice. Plant Cell, 2023, 35: 3828-44. DOI:10.1093/plcell/koad191 |
| [66] |
Sun B, Shen Y, Chen S, et al. A novel transcriptional repressor complex MYB22-TOPLESS-HDAC1 promotes rice resistance to brown planthopper by repressing F3'H expression. New Phytol, 2023, 239: 720-38. DOI:10.1111/nph.18958 |
| [67] |
Tao Z, Zhu L, Li H, et al. ACL1-ROC4/5 complex reveals a common mechanism in rice response to brown planthopper infestation and drought. Nat Commun, 2024, 15: 8107. DOI:10.1038/s41467-024-52436-w |
| [68] |
Dai Z, Tan J, Zhou C, et al. The OsmiR396-OsGRF8-OsF3H-flavonoid pathway mediates resistance to the brown planthopper in rice (Oryza sativa). Plant Biotechnol J, 2019, 17: 1657-69. DOI:10.1111/pbi.13091 |
| [69] |
Sun B, Shen Y, Zhu L, et al. OsmiR319-OsPCF5 modulate resistance to brown planthopper in rice through association with MYB proteins. BMC Biol, 2024, 22: 68. DOI:10.1186/s12915-024-01868-3 |
| [70] |
Wang M, Yang D, Ma F, et al. OsHLH61-OsbHLH96 influences rice defense to brown planthopper through regulating the pathogen-related genes. Rice, 2019, 12: 9. DOI:10.1186/s12284-019-0267-0 |
| [71] |
Lu J, Ju H, Zhou G, et al. An EAR‐motif‐containing ERF transcription factor affects herbivore‐induced signaling, defense and resistance in rice. Plant J, 2011, 68: 583-96. DOI:10.1111/j.1365-313X.2011.04709.x |
| [72] |
Lou YG, Ma B, Cheng JA. Attraction of the parasitoid Anagrus nilaparvatae to rice volatiles induced by the rice brown planthopper Nilaparvata lugens. J Chem Ecol, 2005, 31: 2357-72. DOI:10.1007/s10886-005-7106-z |
| [73] |
Tong X, Qi J, Zhu X, et al. The rice hydroperoxide lyase OsHPL3 functions in defense responses by modulating the oxylipin pathway. Plant J, 2012, 71: 763-75. DOI:10.1111/j.1365-313X.2012.05027.x |
| [74] |
Xiao Y, Wang Q, Erb M, et al. Specific herbivore-induced volatiles defend plants and determine insect community composition in the field. Ecol Lett, 2012, 15: 1130-9. DOI:10.1111/j.1461-0248.2012.01835.x |
| [75] |
汪鹏, 娄永根. 稻飞虱卵期寄生蜂稻虱缨小蜂引诱剂的筛选与田间试验(英文). 应用昆虫学报, 2013, 50: 431-40. DOI:10.7679/j.issn.2095-1353.2013.059 |
| [76] |
Qiu CL, Li W, Wang LN, et al. Limonene enhances rice plant resistance to a piercing-sucking herbivore and rice pathogens. Plant Biotechnol J, 2025, 23: 84-96. DOI:10.1111/pbi.14481 |
| [77] |
Roumani M, Besseau S, Gagneul D, et al. Phenolamides in plants: an update on their function, regulation, and origin of their biosynthetic enzymes. J Exp Bot, 2021, 72: 2334-55. DOI:10.1093/jxb/eraa582 |
| [78] |
Alamgir KM, Hojo Y, Christeller JT, et al. Systematic analysis of rice (Oryza sativa) metabolic responses to herbivory. Plant Cell Environ, 2016, 39: 453-66. DOI:10.1111/pce.12640 |
| [79] |
Liu M, Hong G, Li H, et al. Sakuranetin protects rice from brown planthopper attack by depleting its beneficial endosymbionts. Proc Natl Acad Sci U S A, 2023, 120: e2305007120. DOI:10.1073/pnas.2305007120 |
| [80] |
Aboshi T, Iitsuka C, Galis I, et al. Isopentylamine is a novel defence compound induced by insect feeding in rice. Plant Cell Environ, 2021, 44: 247-56. DOI:10.1111/pce.13902 |
| [81] |
Ji R, Ye W, Chen H, et al. A salivary endo-β-1, 4-glucanase acts as an effector that enables the brown planthopper to feed on rice. Plant Physiol, 2017, 173: 1920-32. DOI:10.1104/pp.16.01493 |
| [82] |
Ye W, Yu H, Jian Y, et al. A salivary EF-hand calcium-binding protein of the brown planthopper Nilaparvata lugens functions as an effector for defense responses in rice. Sci Rep, 2017, 7: 40498. DOI:10.1038/srep40498 |
| [83] |
Fu J, Shi Y, Wang L, et al. Planthopper-secreted salivary calmodulin acts as an effector for defense responses in rice. Front Plant Sci, 2022, 13: 841378. DOI:10.3389/fpls.2022.841378 |
| [84] |
Jiang Y, Zhang XY, Li S, et al. Rapid intracellular acidification is a plant defense response countered by the brown planthopper. Curr Biol, 2024, 34: 5017-27. DOI:10.1016/j.cub.2024.09.039 |
| [85] |
Zhang ZL, Wang XJ, Lu JB, et al. Cross-kingdom RNA interference mediated by insect salivary microRNAs may suppress plant immunity. Proc Natl Acad Sci U S A, 2024, 121: e2318783121. DOI:10.1073/pnas.2318783121 |
| [86] |
Sun XQ, Zhang MX, Yu JY, et al. Glutathione S-transferase of brown planthoppers (Nilaparvata lugens) is essential for their adaptation to gramine-containing host plants. PLoS One, 2013, 8: e64026. DOI:10.1371/journal.pone.0064026 |
| [87] |
Yang J, Kong XD, Zhu-Salzman K, et al. The key glutathione S-transferase family genes involved in the detoxification of rice gramine in brown planthopper Nilaparvata lugens. Insects, 2021, 12: 1055. DOI:10.3390/insects12121055 |
| [88] |
Yang J, Sun XQ, Yan SY, et al. Interaction of ferulic acid with glutathione S-transferase and carboxylesterase genes in the brown planthopper, Nilaparvata lugens. J Chem Ecol, 2017, 43: 693-702. DOI:10.1007/s10886-017-0859-3 |
| [89] |
Zhang J, Guan W, Huang C, et al. Combining next-generation sequencing and single-molecule sequencing to explore brown plant hopper responses to contrasting genotypes of japonica rice. BMC Genom, 2019, 20: 682. DOI:10.1186/s12864-019-6049-7 |
| [90] |
Yu J, Hu S, Wang J, et al. A draft sequence of the rice genome (Oryza sativa L. ssp. indica). Science, 2002, 296: 79-92. DOI:10.1126/science.1068037 |
| [91] |
Deng Y, Ning Y, Yang DL, et al. Molecular basis of disease resistance and perspectives on breeding strategies for resistance improvement in crops. Mol Plant, 2020, 13: 1402-19. DOI:10.1016/j.molp.2020.09.018 |
| [92] |
He Z, Webster S, He SY. Growth-defense trade-offs in plants. Curr Biol, 2022, 32: R634-9. DOI:10.1016/j.cub.2022.04.070 |
| [93] |
Yu L, Chen Y, Zeng X, et al. Brown planthoppers manipulate rice sugar transporters to benefit their own feeding. Curr Biol, 2024, 34: 2990-6. DOI:10.1016/j.cub.2024.05.028 |
| [94] |
Xin Z, Yu Z, Erb M, et al. The broad-leaf herbicide 2,4-dichlorophenoxyacetic acid turns rice into a living trap for a major insect pest and a parasitic wasp. New Phytol, 2012, 194: 498-510. DOI:10.1111/j.1469-8137.2012.04057.x |
| [95] |
Wang W, Zhou P, Mo X, et al. Induction of defense in cereals by 4-fluorophenoxyacetic acid suppresses insect pest populations and increases crop yields in the field. Proc Natl Acad Sci U S A, 2020, 117: 12017-28. DOI:10.1073/pnas.2003742117 |
 2025, Vol. 37
2025, Vol. 37 

 李冉,浙江大学农业与生物技术学院研究员,洪堡学者,国家高层次青年人才项目入选者。2012年毕业于浙江大学昆虫科学研究所,获农学博士学位;2012—2018年先后在新加坡淡马锡生命科学研究所和德国马普化学生态研究所从事博士后研究;2018年通过浙江大学“百人计划”任职于昆虫科学研究所,并建立植物与昆虫互作课题组。近年来,聚焦茉莉酸(JA)信号途径在水稻和害虫互作中的功能,发现了JA正调控水稻对褐飞虱的抗性并鉴定了JA调控的抗性模块,揭示了JA调控水稻对褐飞虱抗性的机制以及褐飞虱为害抑制水稻生长的分子机制,找到了提高水稻抗虫性而不影响水稻生长的途径。在PNAS、Current Biology、Plant Cell、New Phytologist、Plant Journal等期刊发表论文40篇,主持和参与国家自然科学基金面上项目、区域创新发展联合项目和科技部重点研发计划子课题等,且在德国马普学会的资助下成立了“马普学会-浙江大学海外伙伴小组”,并担任小组组长
李冉,浙江大学农业与生物技术学院研究员,洪堡学者,国家高层次青年人才项目入选者。2012年毕业于浙江大学昆虫科学研究所,获农学博士学位;2012—2018年先后在新加坡淡马锡生命科学研究所和德国马普化学生态研究所从事博士后研究;2018年通过浙江大学“百人计划”任职于昆虫科学研究所,并建立植物与昆虫互作课题组。近年来,聚焦茉莉酸(JA)信号途径在水稻和害虫互作中的功能,发现了JA正调控水稻对褐飞虱的抗性并鉴定了JA调控的抗性模块,揭示了JA调控水稻对褐飞虱抗性的机制以及褐飞虱为害抑制水稻生长的分子机制,找到了提高水稻抗虫性而不影响水稻生长的途径。在PNAS、Current Biology、Plant Cell、New Phytologist、Plant Journal等期刊发表论文40篇,主持和参与国家自然科学基金面上项目、区域创新发展联合项目和科技部重点研发计划子课题等,且在德国马普学会的资助下成立了“马普学会-浙江大学海外伙伴小组”,并担任小组组长