(2 上海图书馆(上海科学技术情报研究所),上海 200031)
(2 Shanghai Library (Shanghai Institute of Scientific and Technical Information), Shanghai 200031, China)
新药研发作为医药创新发展的核心关键环节,构成了新一轮生物技术革命与生物经济变革的核心领域,对于引领科技创新、驱动经济蓬勃发展、增进人民健康福祉具备极为重大且深远的战略意义。2024年,随着新靶点新机制的深入开发、AI与大数据的深度融合、基因编辑技术的不断成熟,嵌合抗原受体T细胞(chimeric antigen receptor T cell, CAR-T)药物、信使核糖核酸(messenger RNA, mRNA)疫苗等重大创新产品上市进程不断提速,新药开发向着高含金量、高效率方向持续发展。本文对近年新药开发情况和进展进行梳理,并着重就2024年的研发态势加以梳理和分析,以期为相关研究提供参考。
1 “多赛道”齐相发力驱动新药开发向“高能级”方向发展近年来,以小分子药物、抗体药物、细胞治疗药物、核酸药物为代表的新药上市进程不断提速,与2023年相比,2024年获批上市的新药不仅在数量上实现增长,在质量和疗效上更是取得了显著突破,多款针对肿瘤、罕见病、神经系统疾病等领域的新药获批上市,为全球患者带来了全新的治疗选择,新药开发向“高能级”方向持续发展。
1.1 小分子药物依然占据主力2024年,以靶向药物为代表的小分子药物仍在不断地推陈出新,依然是全球获批数量最多的药物类别。2024年,美国食品药品管理局(FDA)批准了37款新分子实体(表 1),占全年获批药物总数74%,相比2023年新增了3款新分子实体,其中有多个“首款”小分子靶向药物获批上市。例如,Zelsuvmi是全球首个传染性软疣新型治疗药物;Arimoclomol与酶抑制剂Miglustat联合使用,用于治疗C型尼曼匹克病(Niemannpick disease type C, NPC),是FDA批准的首个NPC药物。
| 表 1 2024年FDA批准的新分子实体 |
在我国,根据国家药监局药品审评中心(CDE)官网,2024年首次进行新药临床研究申请的1类新药共有300多款。从药物类型来看,小分子药物依然占据主力,有约160款,占比达40%,这些小分子药物中,既有传统小分子靶向药,也包括了蛋白降解靶向嵌合体、分子胶以及共价剂、别构调节剂等。
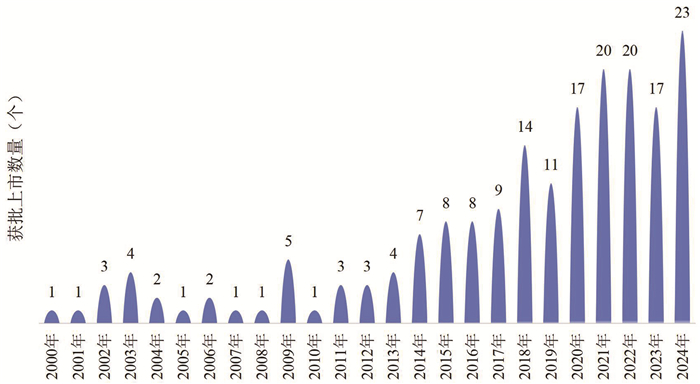
1.2 抗体药物仍处于上市密集期从全球抗体药物审批上市的情况来看,获批产品数量整体呈增长趋势。根据国际抗体协会发布的数据,截至2024年已有224款抗体药物获批,其中2024年当年已有23款抗体药物获批上市,是2000年以来批准抗体上市最多的一年,相比2023年新增6款(图 1)。从首次全球批准的国家来看,2024年,中国是抗体药获批上市数量最多的国家,有12款,占52%,其次是美国,有7款抗体药获批上市。
|
数据来源:国际抗体协会 截至日期:2024年12月31日 图 1 2000—2024年全球获批上市的抗体药物 |
从药物类型来看,单克隆抗体药物仍是抗体药物开发的主要形式。2024年,有15款单克隆抗体药物获批上市,占65%。同时,由于兼具小分子药物与抗体药物优点,抗体偶联药物(antibody-drug conjugate, ADC)正成为医药行业广为关注的新领域。截至2024年,全球已获批的ADC药物共15款,有554项ADC药物正在进行临床试验,其中Ⅰ期、Ⅱ期和Ⅲ期分别有113款、69款和14款。在双抗领域,2024年罗氏仍然是双抗赛道的领军企业,是两款重磅药物的研发生产企业,其中,舒友立乐仍是目前唯一一款在血友病领域应用的双抗药物,2023年销售额达46.35亿美元,在全球双抗市场占比超过50%。
1.3 细胞治疗药物取得重大进展2024年,全球共有7款细胞治疗药物获批上市(表 2),其中美国批准数量最多,为4款,中国、日本和俄罗斯各1款。另外,免疫细胞药物共有4款获批上市,相比2023年新增1款。从药物类别来看,CAR-T是获批最多的药物类别,但目前获批上市的CAR-T疗法均是自体细胞来源、适应证为血液瘤、靶向单个靶点,其广泛应用仍面临诸多限制,如自体CAR-T药物属于“个性化”产品,较难实现规模化和标准化生产,且患者等待周期漫长[1];抗原逃逸是逃避细胞治疗的主要潜在机制,单靶点治疗后面临复发快、复发率高等问题[2]。因此,适应证为实体瘤的CAR-T、通用型CAR-T和多靶点CAR-T成为新的开发热点,多家机构和企业争相布局,并取得了一定进展。拓展适应证到实体瘤方面,贝勒医学院和德克萨斯儿童癌症中心开发了靶向白细胞介素-15 (interleukin-15, IL-15)蛋白、适应证为肝细胞癌的CAR-T疗法,研究发现添加IL-15可以提高基于CAR-T细胞的免疫疗法的性能,IL-15可以帮助T细胞存活和繁殖[3]。通用型CAR-T开发方面,Celyad公司开发的全球首个非基因编辑的通用型CAR-T细胞产品CYAD-101在1期临床中取得良好结果,入组的15例转移性结直肠癌患者总体疾病控制率达73%,2名患者达到了部分缓解,9名患者达到了疾病稳定[4];海军军医大学第二附属医院徐沪济团队对健康供体来源的靶向分化簇19 (cluster of differentiation 19, CD 19)的CAR-T细胞进行基因工程改造,开发出了新一代异体通用型CAR-T疗法,并在三名严重自身免疫疾病的患者中进行了首次人体试验,这项突破性进展是大规模生产CAR-T细胞疗法治疗自身免疫病迈出的关键一步,相关研究成果发表在Cell,徐沪济教授也因此获评“2024 Nature年度十大人物”[5]。多靶点CAR-T方面,Miltenyi Biotec公司开发了三靶点CAR-T疗法,在细胞实验和急性淋巴细胞白血病小鼠模型中,该疗法的细胞能有效控制CD 19抗原逃逸的肿瘤[6]。
| 表 2 2024年全球获批上市的细胞治疗药物 |
除CAR-T疗法外,更具安全性的嵌合抗原受体自然杀伤(chimeric antigen receptor-natural killer, CAR-NK)细胞治疗、具有实体瘤治疗潜力的T细胞受体嵌合T (T cell receptor chimeric T, TCR-T)细胞治疗和肿瘤浸润淋巴(tumor infiltrating lymph, TIL)细胞治疗等均成为免疫细胞治疗领域的研发热点,2024年已有两款产品获批上市。2024年2月16日,FDA批准Iovance Biotherapeutics公司的TIL疗法Lifileucel,用于治疗晚期黑色素瘤;Lifileucel是首款获批的TIL疗法,也是首款获批治疗实体瘤的T细胞疗法,是细胞疗法的重要里程碑。2024年8月1日,Adaptimmune Therapeutics公司的Aucatzyl获得FDA加速批准,是全球首款获批上市的TCR-T疗法。
干细胞疗法方面,2024年间充质干细胞和造血干细胞分别有一款药物获批上市,其中日本批准了SanBio公司的AKUUGO,用于治疗创伤性脑损伤,是全球首个脑再生治疗剂。2025年1月2日,铂生卓越生物开发的艾米迈托赛注射液在国内获批上市,用于治疗14岁以上消化道受累为主的激素治疗失败的急性移植物抗宿主病(GvHD),这是国内首款获批的干细胞疗法,也是我国干细胞疗法的重大突破。
1.4 核酸类新药产业化进程提速核酸类新药具有效果持久、不易产生耐药性等优点,在基因治疗领域具有广阔的应用前景。RNA技术的突破则丰富了对基因表达调控机制的认识,为核酸类药物的开发提供了新动力。RNA干扰技术、CRISPR/Cas9 (clustered regularly interspaced short palindromic repeat/CRISPR associated protein 9,常间回文重复序列丛集关联蛋白)基因编辑以及mRNA疫苗的成功应用,都是RNA技术在新药开发中的重要里程碑。RNA干扰技术通过特异性降解目标mRNA,在分子水平上调控基因表达,为治疗遗传性疾病和某些癌症提供新治疗手段[7],CRISPR-Cas9技术则通过精确的基因编辑,为遗传性疾病的根治提供了可能,而mRNA疫苗的快速研发和大规模应用展示了mRNA技术在应对突发公共卫生事件中的潜力。
核酸类药物种类多样,主要分为小核酸药物和mRNA两大类,包括小干扰RNA(small interfering RNA, siRNA)、反义寡核苷酸(antisense oligonucleotides, ASO)、核酸适配体、转运RNA、治疗性mRNA疫苗等,其中研究最热门的小核酸药物主要是ASO、siRNA和核酸适配体。根据Insight数据库,截至2024年,全球已有22款小核酸药物获批上市,其中ASO药物有12款、siRNA药物有6款、核酸适配体2款。目前已上市的ASO和siRNA药物主要用于遗传性疾病或与基因缺陷有关的疾病治疗。此外,mRNA新冠疫苗的成功上市使得大量的研究和资金投入到mRNA癌症疫苗和mRNA药物的开发,全球已有多家企业布局相关业务,其中Intellia Therapeutics公司开发的mRNA药物NTLA-2001和NTLA-2002,分别用于治疗转甲状腺素蛋白淀粉样变性和遗传性血管性水肿,预计于2025年上市。
2 “多要素”交织重叠驱动新药研发向“高效率”方向提升药物发现是新药研发过程中的关键步骤之一,也是难点所在。当前,基于靶点的药物发现模式已成为现代创新药物研发的核心策略,全球众多靶点药物处于开发及上市进程;同时,AI、量子算法等新技术和新方法的发展为新药研发带来了新的技术手段,赋能药物靶点、化合物筛选等过程,推动新药开发向“高效率”方向提升,并引领疾病治疗方法的创新。
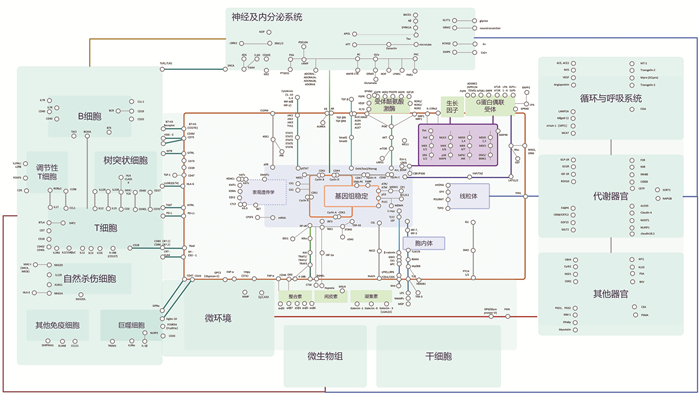
2.1 基于靶点的开发是当前新药研发的核心策略靶点是药物与人体内特定分子相互作用的目标位置,也可以是参与疾病发生和发展的关键蛋白质、酶或细胞结构,主要包括蛋白质和核酸两大类。其中蛋白质包括酶、受体、离子通道、转运体等,核酸包括DNA和RNA。靶点发现与验证在新药研发中具有至关重要的作用。首先,通过靶点发现可以更好地理解疾病的发生机制,为药物设计提供准确的方向;其次,确定靶点后,利用计算方法筛选合适的化合物进行药物设计,从而提高研发的效率和成功率;此外,靶点发现也有助于开发个性化医疗,根据患者的基因型和表型选择最佳的治疗方式。因此,基于靶点的开发是当前新药研发的核心策略。根据Insight数据库,本文统计了全球进入临床Ⅱ期后的药物靶点逻辑图谱,其中3期临床中药物对应靶标有80个。可以看到,在细胞内,药物靶点主要集中在细胞核和线粒体这两个重要的细胞器上;相当一部分靶点位于细胞膜表面,细胞表面的靶点包括受体、离子通道和转运蛋白等,这些靶点通过调节细胞内外物质的流动和信号传递来发挥作用(图 2)。B细胞、树突状细胞、T细胞、自然杀伤细胞等是免疫系统中的关键细胞,在免疫反应中扮演着重要角色,其中T细胞和B细胞主要通过CD、白细胞介素(interleukin, IL)等受体与其他细胞进行信号转导。药物靶点开发还涉及多个生理系统的相互作用和精细调控,如神经及内分泌系统、循环与呼吸系统、代谢器官等。神经及内分泌系统靶点以神经递质(如N-花生四烯酸乙醇胺、α-突触核蛋白)、神经退行性疾病相关蛋白(如载脂蛋白、微管相关蛋白)、离子通道及受体(如甘氨酸转运体1、谷氨酸代谢型受体22)为主;循环与呼吸系统靶点则以血管调节和血管生成类(如血管紧张素转化酶)、细胞信号转导和细胞骨架类(如冠状病毒3C样蛋白酶、肌动蛋白结合蛋白)为主。以受体为例,根据受体蛋白结构、信息转导过程、效应性质、受体位置等特点,受体大致可分为G蛋白偶联受体(G protein-coupled receptor, GPCR)、离子通道受体、单次跨膜受体、核受体等[8]。据统计,大约34%的小分子药物能和GPCR结合,因此GPCR被认为是最理想的药物靶点,进入临床Ⅱ期的GPCR主要包括神经降压素受体1、胃泌素释放肽受体、血管紧张素Ⅱ受体等[9]。
|
截至日期:2024年12月31日 图 2 临床及以后新药靶点分布情况 |
当前,靶点开发与验证技术以系统生物学方法和基于靶点结构的方法两大类为主,提高了靶点预测和发现的效率[10]。系统生物学通过研究生物系统内部所有组分间相互关系,建立整个系统的可理解模型。Berg Health公司开发了Interrogative Biology系统生物学平台,可生成数据驱动的无偏网络,用于识别靶点和疾病的生物标志物[11];此外,英矽智能在其靶点发现平台内推出基于Transformer的知识图谱功能,从期刊论文中提取信息,将基因、疾病、化合物和生物通路联系起来,并将其与基于大型语言模型的问答功能相结合,以识别药物靶点[12]。基于靶点结构的方法常见的有反向对接、药效团、结合位点相似性等,其中利用药效团模型进行反向找靶是进行靶点预测的重要方式。华东师范大学李洪林团队开发了药效团匹配与潜在识别靶标平台PharmMapper,该平台通过将所查询化合物的药效团与内部药效团模型数据库进行匹配以预测靶点,近年来该团队将其药效团数据库进行了6倍规模的扩增,并成功地对抗菌剂卡那霉素的作用靶点进行了预测[13]。
2.2 新技术新方法的突破提高新药产业化效率高通量筛选、虚拟筛选、基于结构的药物设计以及基于片段的药物设计逐渐成为药物研发的常见技术,这些技术至今仍然在不断丰富和发展中,药物研发领域也出现诸多新技术和新方法,比如基因编辑技术、靶向蛋白质降解技术等,新技术和新方法的发展为新药研发带来了新的技术手段,赋能药物靶点发现、化合物筛选等过程,技术平台的突破很大程度上改善了新药的成药性和产业化效率(表 3)。具体来说,根据双抗药物是否含有可结晶片段(fragment crystallizable, Fc片段)开发了不同技术平台;ADC药物则依据抗体、连接子和毒素分子等重要的组成部分形成相应技术平台;蛋白降解靶向嵌合体(proteolysis targeting chimera, PROTAC)药物主要围绕靶蛋白配体和E3连接酶配体的开发建立不同的技术平台;细胞基因治疗药物则在基因编辑、诱导多能干细胞、异体通用细胞治疗、RNA干扰等技术领域持续发展。
| 表 3 新药开发代表性技术平台 |
以双抗为例,双抗药物根据结构分为免疫球蛋白G (IgG)类和非IgG类。对于存在1个Fc段IgG类双抗来说,开发过程主要需要解决抗体链错配问题。为解决这一问题,全球多个跨国企业都推出双抗技术平台,比如罗氏集团的Crossmab平台和KiH平台,强生公司的DuoBody平台等,根据DuoBody平台开发的IgG骨架,强生近年连续上市两个重磅的双抗药物Rybrevant和Tecvayli;对于非IgG类双抗来说,开发过程主要需要解决半衰期问题,不含Fc区的非IgG类双抗分子量较小,易被靶细胞溶酶体降解,因此半衰期较短。Gilead Sciences公司基于DART技术平台开发了CD123/CD3双抗MGD024药物,在设计上延长了半衰期,减少了细胞因子的释放,目前处于治疗血液瘤的临床阶段。
当前,AI和大数据技术、量子算法的融合,以及新型计算工具和基础设施解决方案,如数据库、云服务等,都在重新定义新药开发的模式。越来越多的量子计算企业将医药作为重要应用场景,其中IBM、谷歌、英特尔、亚马逊、微软等企业都在开发量子计算云平台的同时,不约而同地布局医药应用;同时,一批量子计算的初创企业也积极与量子计算机开发企业合作或利用量子云平台,将量子计算与医药开发知识相结合,开发用于药物发现等方面的工具,以加速应用开发。例如,北极星量子生物致力于将量子启发技术、机器学习、分子力学模拟等技术相结合,其宣称的目标是把临床前候选药物的交付时间从5年压缩到4个月,每年产生约100个候选药物。人工智能驱动药物开发的重要性也越来越突出,人工智能驱动的新药设计与开发主要分为三大类:从头药物设计、现有数据库虚拟筛选和药物再利用[14]。从头药物设计主要由深度生成AI模型实现,包括英矽智能的Chemistry42软件、Iktos公司的Makya和Ro5公司的DeNovo。现有数据库虚拟筛选方面,应用AI赋能的超大规模虚拟筛选,可从数十亿分子中筛选出成功的苗头化合物。2022年8月,赛诺菲与Atomwise公司合作进行了一项价值可能高达12亿美元的药物设计交易,这笔交易将重点利用Atomwise公司的AtomNet平台研究赛诺菲选定的多达五个药物靶标的小分子,AtomNet能够快速地搜索Atomwise的超过3万亿种可合成化合物的专有库。还有许多公司使用药物再利用策略进行人工智能药物发现,这一类的公司包括Healx、Benevolent AI、BioXcel Therapeutics,主要使用自然语言处理模型和机器学习,通过分析大量的非结构化文本数据,研究文章和专利、电子健康记录以及其他数据类型来建立和搜索“知识图谱”。与传统计算机辅助药物研发相比,AI具有数据量大、精度高、新颖性强等优势。越来越多的企业布局AI赋能药物开发业务,根据Deep Pharma Intelligence发布的数据,截至2024年,全球约有800家AI公司辅助药物研发,主要布局了六大环节:早期药物开发、临床前开发、临床开发、数据处理、端到端药物开发、药物再利用,企业数量分别是315家、50家、123家、174家、110家、28家。
2.3 适用于多种疾病的新药开发取得显著突破全球批准新药上市的速度一直呈现稳中有升的态势,恶性肿瘤、神经系统等疾病的新药开发持续加速[15]。2024年Science杂志评选的十大科学突破,有两个与新药开发相关,分别是长效艾滋病预防药物和CAR-T疗法治疗自身免疫性疾病,可见新药开发不断出现重大突破。2024年,以恶性肿瘤、糖尿病、自身免疫系统疾病、罕见病为适应证的新药开发和上市进程更是不断提速,相继取得重大进展,极大丰富了新药的品种(表 4)。
| 表 4 2024年新药用于疾病治疗的重要进展例举 |
以糖尿病治疗为例,近年糖尿病的药物治疗手段越来越丰富。2022年11月,抗CD3单克隆抗体Tzield获得FDA的批准,用于1型糖尿病,自此1型糖尿病患者迎来新疗法;随后2023年6月28日,FDA批准首个用于1型糖尿病治疗的细胞疗法Lantidra,Lantidra是由CellTrans公司开发的同种异体胰岛细胞疗法;VX-880是一种在研的异体干细胞衍生完全分化胰岛细胞替代疗法,2024年9月,Vertex在欧洲糖尿病研究协会年会上报道的研究结果显示:所有接受全剂量治疗的参与者都显示出益处,包括通过C肽测量的胰岛素产生、血糖控制显著改善等,12名参与者中有11名减少了对外部胰岛素的需求,所有4名接受全剂量细胞并在一年多后随访的参与者均达到降低严重低血糖事件的主要终点,表明了干细胞疗法在糖尿病中的应用前景;2024年9月25日,中国科学家首次利用干细胞再生疗法证明化学重编程多能干细胞制备的胰岛细胞疗法安全有效,实现了1型糖尿病的临床功能性治愈,这一成果标志着干细胞治疗在1型糖尿病领域取得了突破性进展[16],为全球糖尿病治疗贡献了“中国力量”。
3 总结与展望从获批上市的新药来看,2024年是新药的丰收之年。与2023年相比,2024年全球小分子药物、抗体药物、细胞治疗药物等新药不仅在数量上实现了增长,更在质量和疗效上取得了显著突破,并实现了多个首次。例如,Lifileucel是全球首个获批上市的TIL疗法,Aucatzyl是全球首个获批上市的TCR-T疗法,多款针对肿瘤、罕见病、神经系统疾病等领域的新药获批上市,为全球患者带来了全新的治疗选择。我国新药开发也实现了多款突破,海军军医大学开发的通用型CAR-T疗法,铂生卓越开发的国内首款干细胞疗法艾米迈托赛注射液等,均为全球新药开发贡献“中国力量”。从推动新药开发的要素来看,新靶点的挖掘已然成为新药创新的核心驱动力之一,各大企业纷纷建立先进的靶点筛选平台,整合多组学数据,运用大数据分析、机器学习等手段挖掘关键靶点,而新技术的强化赋能更是让新药开发进入高速发展的时代。以细胞治疗为例,从简单的细胞移植概念发展到CAR - T疗法,通过对患者或健康人群免疫细胞进行基因改造,使其能够精准识别并杀伤肿瘤细胞,为癌症治疗带来了革命性的突破。此外,生物技术、信息技术、材料技术等新技术层出不穷,且呈现出深度融合的态势,跨学科研究成为常态,因此新靶点的不断挖掘、新技术的强化赋能、多学科综合集成的趋势不断增强,新药开发向着更高效、更精准和更个性化的方向发展。不过,全球新药开发仍面临诸多挑战,如何确保新药可及性和可负担性、如何在药物创新性与安全性之间寻求平衡点、如何加强国际合作与交流等问题,是各国未来共同努力和探索的方向。
| [1] |
Köhl U, Arsenieva S, Holzinger A, et al. CAR T cells in trials: recent achievements and challenges that remain in the production of modified T cells for clinical applications. Hum Gene Ther, 2018, 29: 559-68. DOI:10.1089/hum.2017.254 |
| [2] |
Titov A, Zmievskaya E, Ganeeva I, et al. Adoptive immunotherapy beyond CAR T-cells. Cancers, 2021, 13: 743. DOI:10.3390/cancers13040743 |
| [3] |
Steffin D, Ghatwai N, Montalbano A, et al. Interleukin-15-armored GPC3-CAR T cells for patients with solid cancers. Res Sq, 2024, rs.3.rs-4103623. |
| [4] |
Prenen H, Dekervel J, Hendlisz A, et al. Updated data from the alloSHRINK phase 1 first-in-human study evaluating CYAD-101, an innovative non-gene-edited allogeneic CAR-T, in metastatic colorectal cancer. J Clin Oncol, 2021, 39: 74. |
| [5] |
Wang X, Wu X, Tan B, et al. Allogeneic CD19-targeted CAR-T therapy in patients with severe myositis and systemic sclerosis. Cell, 2024, 187: 4890-904. e9. DOI:10.1016/j.cell.2024.06.027 |
| [6] |
Fousek K, Watanabe J, Joseph SK, et al. CAR T-cells that target acute B-lineage leukemia irrespective of CD19 expression. Leukemia, 2021, 35: 75-89. DOI:10.1038/s41375-020-0792-2 |
| [7] |
Gao S, Chen Z, Bao H. Application of RNA technology in renal diseases. Chin J Nephrol Dialysis Transplant, 2024, 33: 148-54. |
| [8] |
Venkatakrishnan AJ, Deupi X, Lebon G, et al. Molecular signatures of G-protein-coupled receptors. Nature, 2013, 494: 185-94. DOI:10.1038/nature11896 |
| [9] |
Duan J, Liu H, Zhao F, et al. GPCR activation and GRK2 assembly by a biased intracellular agonist. Nature, 2023, 620: 676-81. DOI:10.1038/s41586-023-06395-9 |
| [10] |
Pinzi L, Rastelli G. Molecular docking: shifting paradigms in drug discovery. Int J Mol Sci, 2019, 20: 4331. DOI:10.3390/ijms20184331 |
| [11] |
Narain N, Kiebish M, Vishnudas V, et al. CSAO-1. Interrogative biology: unraveling insights into causal disease drivers by use of a dynamic systems biology and Bayesian AI to identify the intersect of disease and healthy signatures. Neuro-Oncology Adv, 2021, 3: ii1-ii1. |
| [12] |
王超, 肖辅, 李妙竹, 等. 人工智能在药物靶点的筛选及验证方面的应用进展. 中国药科大学学报, 2023, 54: 269-81. |
| [13] |
Wang X, Shen Y, Wang S, et al. PharmMapper 2017 update: a web server for potential drug target identification with a comprehensive target pharmacophore database. Nucleic Acids Res, 2017, 45: W356-60. DOI:10.1093/nar/gkx374 |
| [14] |
Yang X, Wang Y, Byrne R, et al. Concepts of artificial intelligence for computer-assisted drug discovery. Chem Rev, 2019, 119: 10520-94. |
| [15] |
Scott EC, Baines AC, Gong Y, et al. Trends in the approval of cancer therapies by the FDA in the twenty-first century. Nat Rev Drug Discov, 2023, 22: 625-40. |
| [16] |
Wang S, Du Y, Zhang B, et al. Transplantation of chemically induced pluripotent stem-cell-derived islets under abdominal anterior rectus sheath in a type 1 diabetes patient. Cell, 2024, 187: 6152-64. e18. |
| [17] |
Shi M, Wang J, Huang H, et al. Bispecific CAR T cell therapy targeting BCMA and CD19 in relapsed/refractory multiple myeloma: a phase Ⅰ/Ⅱ trial. Nat Commun, 2024, 15: 3371. |
 2025, Vol. 37
2025, Vol. 37 

 李荣,馆员,从事生物领域产业与技术情报研究和服务,主持3项上海市软课题项目,并参与多项国家科技重大专项、上海市软科学研究项目等,为国家和区域生物技术科技发展和政策管理提供决策参考。参编《中国生命科学与生物技术发展报告》《中国临床医学研究发展报告》等多本著作,近两年主要参与完成的成果获得多项华东地区科技情报成果奖与上海科学技术情报成果奖;
李荣,馆员,从事生物领域产业与技术情报研究和服务,主持3项上海市软课题项目,并参与多项国家科技重大专项、上海市软科学研究项目等,为国家和区域生物技术科技发展和政策管理提供决策参考。参编《中国生命科学与生物技术发展报告》《中国临床医学研究发展报告》等多本著作,近两年主要参与完成的成果获得多项华东地区科技情报成果奖与上海科学技术情报成果奖; 陈大明,中国科学院上海营养与健康研究所研究员,长期从事科技情报方法研究和产业情报分析,主持多项国家科技重大专项、上海市软科学研究项目等,为国家和区域生物技术科技发展和政策管理提供决策参考
陈大明,中国科学院上海营养与健康研究所研究员,长期从事科技情报方法研究和产业情报分析,主持多项国家科技重大专项、上海市软科学研究项目等,为国家和区域生物技术科技发展和政策管理提供决策参考