(2 中国科学院上海营养与健康研究所,上海 200031)
(3 中国科学院大学,北京 100049)
(2 Shanghai Institute of Nutrition and Health, Chinese Academy of Sciences, Shanghai 200031, China)
(3 University of Chinese Academy of Sciences, Beijing 100049, China)
随着21世纪生物科技的飞速发展,全球衰老机制的研究正逐步迈向一个前所未有的高峰。作为生命科学的重大课题,衰老机制的探索不仅关乎人类健康与寿命的延长,更是生物学、医学、遗传学等多个学科交叉融合的前沿阵地。在学术前沿方面,科学家们正通过高通量测序、基因编辑、蛋白质组学等先进技术,揭示衰老过程中基因、分子、细胞层面的复杂变化,这些研究不仅深化了我们对衰老本质的理解,更为开发有效的抗衰老策略提供了理论基础。同时,随着单细胞分析、系统生物学等新兴方法的引入,衰老机制的探索正逐步迈向更加精细、深入的层次。在产业层面,抗衰老产业正迎来前所未有的发展机遇。基于最新的科研成果,一系列抗衰老产品和技术应运而生,如基因疗法、细胞治疗、精准医疗等,为延缓衰老、提高生命质量提供了更多可能。然而,产业的快速发展也伴随着诸多挑战,如技术成熟度、安全性评估、伦理道德等问题,需要科研人员、企业家、政策制定者等多方共同努力,共同推动抗衰老产业的健康发展。本文将以“衰老机制研究前沿与抗衰老产业发展动态”为题,深入剖析当前衰老研究领域的最新进展,以及这些研究成果如何推动抗衰老产业的革新与发展。
1 衰老机制研究进展衰老机制的研究涉及多个层面,包括细胞衰老(cell senescence)、器官和组织衰老(aging)以及寿命(longevity)。细胞衰老是指细胞失去分裂和增殖能力,进入一种长期的生长停滞状态;器官和组织衰老表现为功能逐渐减退和结构逐渐退化;而寿命是指生物体从出生到死亡的总时间。衰老机制的研究是一个多层次、多维度的复杂过程,涉及细胞、器官和组织以及整个生物体的各个方面,需要综合考虑不同层面的相互作用和影响,以全面理解衰老的本质和机制。
2024年,衰老机制的研究取得了显著进展,涉及基因与分子层面、细胞与组织层面、系统与整体水平以及环境与生活方式对衰老的影响等多个维度。随着分子生物学、遗传学和生物信息学的发展,衰老研究进入了一个新的时代。举例而言,科学家们发现了许多与衰老密切相关的基因、蛋白质、代谢物和信号通路(图 1);单细胞转录组分析揭示了衰老、基因组不稳定性和免疫变化等年龄相关的细胞特性;组织结构失序和细胞身份丢失是多器官衰老的共性特征;环境暴露与衰老的复杂关联阐释了健康生活方式和环境因素在衰老过程中的重要作用等等。
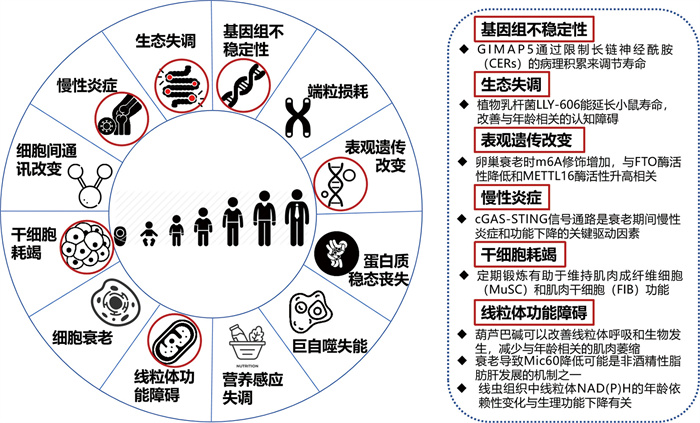
|
图 1 2024年衰老机制研究代表性前沿进展概括图 |
2024年的研究进展为我们提供了对衰老机制更全面的理解,并为未来的干预策略提供了新的视角和潜在靶点。本节将从基因与分子层面、细胞与组织层面、系统与整体水平及环境与生活方式等方面梳理2024年衰老机制的研究前沿,供读者参考。
1.1 基因与分子层面的衰老机制基因组不稳定性是细胞衰老的一个核心因素。随着年龄的增长,细胞不断暴露于各种DNA损伤源,如活性氧、紫外线辐射和环境诱变剂等。尽管细胞有复杂的基因组维护系统来修复这些损伤,但偶尔修复错误或无法正确复制基因组,会导致突变和表观遗传变异的积累,这些积累的突变会破坏细胞的正常功能,引发细胞衰老。2024年1月,美国国立卫生研究院的研究团队[1]发现了一种新型人类遗传疾病,该疾病由GIMAP5酶(GTPase, IMAP family member 5)缺陷引起,导致细胞衰老、肝脏和免疫功能障碍以及早逝。研究指出,GIMAP5通过限制长链神经酰胺(long-chain ceramides, CERs)的病理积累来调节寿命。GIMAP5与蛋白激酶CK2相互作用,控制CER的丰度,减弱其激活CER合成酶的能力。因此,GIMAP5控制着对哺乳动物免疫功能和健康至关重要的长寿路径。2024年10月,来自西班牙Bellvitge生物医学研究所的研究人员[2]探讨了SVBP (small vasohibin-binding protein)基因变异如何通过影响细胞内部的结构和功能来促进衰老和神经退行性疾病。研究团队采用全外显子组测序,在来自三个不相关家庭的6名患者中鉴定了SVBP中先前未被报道的双等位基因错义变异。这项研究表明了SVBP在中枢神经系统发育和维持中的关键作用,为细胞分裂失败与皮质运动神经元疾病和智力残疾之间的联系提供了新的见解。
DNA损伤是衰老过程中的一个关键驱动力。细胞在正常代谢过程中会不断产生DNA损伤,如DNA单链和双链断裂、碱基损伤等。随着时间的推移,这些损伤会逐渐累积,导致基因组不稳定,进而引发细胞功能的逐渐衰退和衰老。2024年10月,来自荷兰皇家艺术与科学学院的学者[3]揭示了细胞如何修复受损的DNA。研究团队首次绘制了单个人类细胞中修复蛋白的活动图。研究团队使用DamID和ChIC测序技术,对单个人细胞中修复蛋白定位进行了全面分析。该研究报告了由AsiSI诱导的DNA双链断裂响应的全基因组结合谱,并探索了在空间基因组图谱背景下基因组损伤位置的变异性及相关修复特征。这项研究展示了蛋白质如何协作修复DNA损伤,有助于了解细胞如何修复DNA断裂,并为治疗与DNA损伤有关的疾病提供靶点。
异染色质的丢失是细胞衰老的一个重要分子标志。在衰老过程中,异染色质结构会发生显著变化,如异染色质区域的开放性和相互作用增强。2024年3月,美国康奈尔大学的Felicity等[4]研究了保守的染色质因子SET-26 (SET domain protein 26)、HCF-1 (host cell factor 1)和HDA-1 (histone deacetylase HDA-1)如何调节线虫的基因表达和寿命。研究发现,SET-26与HCF-1合作调控一组共同的基因,并共同拮抗组蛋白去乙酰化酶HDA-1,限制寿命延长。文章指出,SET-26、HCF-1和HDA-1形成一个微调基因表达和寿命的机制,对理解这些因子在不同生物体中的作用及衰老生物学具有重要意义。2024年10月,中国科学院动物研究所曲静和刘光慧课题组发表综述[5],全面总结了染色质和基因组不稳定性在衰老及相关疾病中的作用和机制,阐述了异染色质丢失、端粒磨损和DNA损伤如何通过引发基因组不稳定性、天然免疫和炎症反应,促进细胞衰老,进而驱动组织、器官与个体衰老,并导致衰老相关疾病的发生,并且探讨了这些分子机制在共同影响细胞命运和组织功能过程中的相互作用。
1.2 细胞与组织层面的衰老特征线粒体功能障碍和低烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)水平是各类细胞组织衰老的标志之一,例如骨骼肌老化和肌肉减少就是如此。研究表明[6]在人体中,作为一种NAD+前体,血清葫芦巴碱水平随着肌肉减少而降低,并与肌肉力量和骨骼肌线粒体氧化磷酸化呈正相关。其营养补充可确定为一种NAD+增强策略,具有治疗与年龄相关的肌肉衰退的潜力。瑞士雀巢健康科学研究所和瑞士洛桑联邦理工学院的研究团队[6]就发现了在秀丽隐杆线虫中,葫芦巴碱可以改善线粒体呼吸和生物发生,减少与年龄相关的肌肉萎缩;而在雄性小鼠的饮食中补充葫芦巴碱可以增强肌肉力量,防止衰老过程中的疲劳。这意味着摄入葫芦巴碱可作为一种NAD+促进策略,治疗与年龄相关的肌肉衰退。2024年1月,韩国国立卫生研究院Kim等[7]研究了维生素D对年龄相关非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)的影响,特别是其与线粒体异常的关系。他们发现老龄小鼠线粒体中Mic60 (mitochondrial contact site and cristae organizing system protein 60)水平降低,而Mic60是人类基因Imm (inner membrane mitochondrial protein)编码的,与线粒体内膜结构调控相关。这项研究首次揭示了衰老导致Mic60降低可能是NAFLD发展的机制之一,而维生素D3通过上调Mic60表达,有助于改善年龄诱导的NAFLD。11月,美国哈佛大学和南加州大学的研究人员[8]提出了一种非破坏性、无标记和亚细胞分辨率方法,通过内源性NAD(P)H (nicotinamide adenine dinucleotide (phosphate))荧光寿命成像(fluorescence lifetime imaging, FLIM),光学解析线粒体中NAD(P)H生物物理性质随年龄的变化,从而定量衰老。他们揭示了线虫组织中线粒体NAD(P)H的年龄依赖性变化与生理功能下降有关,并构建了能够预测个体衰老速度和剩余寿命的年龄预测模型“mito-NAD(P)H年龄时钟”。研究发现,线粒体NAD(P)H的荧光寿命与线虫的生理功能下降相关,并且这种关系在不同组织和细胞类型中具有异质性。该研究还提供了线粒体NAD(P)H在衰老过程中的高分辨率视图,拓宽了对线粒体在衰老过程中如何变化的见解。
器官和组织衰老是多种因素共同作用的结果。细胞衰老是基础,衰老细胞的积累会影响组织的结构和功能。此外,基因组不稳定性、炎症反应、氧化应激、线粒体功能下降等也对器官和组织衰老有重要影响。大脑的衰老是备受关注的器官衰老研究方向之一。2024年4月,爱尔兰科克大学Dohm-Hansen等[9]发表综述,阐述了中年大脑可能发生的衰老变化。文章指出中年大脑呈现出步态、反应时间、记忆力、功能连接、白质完整性、神经炎症以及基因和蛋白质表达的加速变化,并强调了在研究样本中广泛年龄范围的非线性变化建模的效用。2024年9月,中国科学院动物研究所曲静、刘光慧课题组与中国科学院北京基因组研究所张维绮课题组共同发表研究成果[10],首次发现二甲双胍不仅能够调节血糖,还能促进包括大脑在内的雄性老年灵长类个体多种组织器官的年轻化。
表观遗传调控是基因表达的开关枢纽,其程序化的改变被认为是衰老的重要标志和关键因素。例如,DNA甲基化、组蛋白修饰、染色质重塑、非编码RNA等表观遗传标记在衰老过程中会发生显著变化。这些变化直接影响基因的表达模式,从而影响细胞的衰老和相关疾病的发生。m6A (N6-methyladenosine)作为一种关键的表观遗传标记,同样在生理和病理过程中扮演重要角色。尽管m6A与组蛋白修饰和转座因子在卵巢发育和衰老中的作用机制尚未完全明确,但2024年10月,南京医科大学的Hu等[11]研究发现,卵巢衰老时m6A修饰增加,与FTO酶(fat mass and obesity-associated protein)活性降低和METTL16酶(methyltransferase-like protein 16)活性升高相关。通过敲除FTO基因的小鼠和KGN细胞系证实,FTO缺失和METTL16过表达能提高m6A水平,降低SUV39H1 (suppressor of variegation 3-9 homolog 1)和H3K9me3 (histone H3 lysine 9 trimethylation)水平,激活LTR7 (long terminal repeat 7)、LTR12和ERV1 (endogenous retrovirus 1),导致卵巢细胞增殖减少,凋亡、衰老和自噬标志物增加。这揭示了m6A修饰在卵巢衰老中的表观遗传和自噬作用,为理解其在卵巢衰老中的作用提供了新视角。
1.3 系统与整体水平上的衰老表现系统与整体水平上的衰老表现涉及多个层面的变化,包括分子、细胞和组织器官的功能衰退。免疫衰老是系统水平上衰老过程中一个重要的组成部分,它不仅影响免疫功能,还可能驱动机体系统性组织器官的衰老。研究免疫系统衰老的机制和寻找有效的干预措施,对于延缓衰老和提高老年人生活质量具有重要意义。发表在Nature的一项研究发现[12],老年小鼠的免疫细胞过继转移给年轻小鼠后,会促进年轻小鼠全身多个组织器官的衰老;反之,年轻小鼠的免疫细胞过继转移则会抑制老年小鼠体内组织器官的衰老。通过在小鼠造血细胞中选择性删除Ercc1基因以增加内源性DNA损伤,从而模拟诱导免疫系统衰老,同样会促进小鼠体内组织器官的衰老。另一项研究[13]探讨了衰老过程中持续的促炎反应如何导致多种疾病,并特别指出衰老大脑对炎症的脆弱性,表现为与年龄相关的认知衰退和阿尔茨海默病的高发。还有一项研究[14]发现,cGAS-STING (cyclic GMP-AMP synthase (cGAS)- stimulator of interferon genes (STING))信号通路是衰老期间慢性炎症和功能下降的关键驱动因素。从受损线粒体中释放的细胞质DNA能够激活老年小胶质细胞中的cGAS,从而触发cGAS-STING信号通路。cGAS-STING信号通路的阻断可以减轻衰老细胞的炎症表型,并改善组织功能,可能是治疗衰老相关炎症和神经退行性疾病的潜在策略。近年来中国科学院上海营养与健康研究所的肖意传研究团队在免疫衰老领域也获得了重要研究进展。2021年,该研究团队发现[15]衰老的CD4+ T细胞通过感知DNA损伤,导致老年个体外周T细胞的异常增殖,进而驱动老年机体系统性炎症。2024年,研究团队又发现[16]衰老导致CD8+ T细胞在机体多个实体组织中向TRM (tissue resident memory T cells)分化的能力受损,导致机体系统性的抗肿瘤免疫受损,并潜在影响了老年个体的抗感染免疫功能。
组学图谱,尤其是转录组、代谢组及空间转录组学技术,能够揭示衰老过程中细胞和分子在组织中的动态变化。这种技术为研究组织水平上的衰老机制提供了新的途径,有助于全面理解衰老的时空特性。2024年1月,通过在不同衰老亚型的人成纤维细胞中进行动态转录组和代谢组分析,巴黎西岱大学Tighanimine等[17]发现G3P和pEtN的积累是脂质代谢与衰老基因表达的联系点。依赖p53的甘油激酶(p53-dependent glycerol kinase)激活和磷酸胞嘧啶转移酶2 (phosphate cytidylyltransferase 2)的翻译后失活作为代谢开关,可被乙醇胺调节,从而导致甘油三酯积累并激活衰老基因。这项研究为治疗衰老相关疾病提供了新途径。2024年2月,中国的科研人员构建了灵长类动物肾上腺的单核转录组图谱,揭示衰老影响脂质代谢和类固醇生成[18]。研究发现,网状带区域细胞,特别是产生DHEA-S (dehydroepiandrosterone sulfate)的细胞,对衰老敏感,表现为衰老、功能衰竭和激素分泌失调。该研究为理解内分泌生理学提供新视角,并为治疗衰老相关的肾上腺功能不全和延缓全身衰老提供潜在治疗方向。同月,Wu等[19]研究了哺乳动物大脑衰老过程中的空间基因表达和细胞类型。他们创建了年轻和老年小鼠大脑的空间转录图谱,识别了27个不同的大脑区域,并详细描述了大脑衰老过程中基因表达的空间变化,特别关注了大脑皮层、海马体、脑干和纤维束。他们建立的衰老小鼠大脑的空间分子图谱为理解大脑衰老的分子机制提供了新视角。2024年11月,中国科学院动物研究所等研究团队构建发布了全球首个多器官衰老时空图谱[20],发现免疫球蛋白G (immunoglobulin G, IgG)积累是驱动衰老的关键因素。12月,该研究团队发表了特邀展望性文章[21],系统性地介绍生殖系统衰老的生物标志物框架,并回顾梳理了当前临床使用的生殖功能生物标志物,同时也对该领域当前所面临的挑战及未来的研究方向进行了深入的总结与前瞻性展望。
衰老伴随着代谢变化,导致细胞健康状况下降,但许多代谢产物在衰老中的作用尚不清楚。了解已知抗衰老分子的机制可以揭示调节衰老的代谢网络,并有助于识别额外的抗衰老分子。2024年10月,Arora等[22]通过AI平台AgeXtend分析,预测新的抗衰老剂。研究发现AgeXtend能识别训练数据外的已知抗衰老分子(如二甲双胍和牛磺酸)的长寿效应。他们筛选约11亿种化合物,鉴定出许多潜在抗衰老分子,并评估预测为抗衰老调节剂的内源性代谢产物;使用人类成纤维细胞衰老测定显示,AgeXtend在揭示未知抗衰老分子和提供衰老机制见解方面具有潜力。2024年12月,厦门大学林圣彩团队在个体抗衰老研究领域取得重大突破[23-24],揭示了卡路里限制(calorie restriction, CR)延缓个体衰老的具体机制,并发现了一种能够模拟卡路里限制效果的分子石胆酸。研究团队从卡路里限制小鼠的血清出发,通过代谢组学鉴定和逐个排查,最终确定了石胆酸作为卡路里限制的模拟物,并在线虫、果蝇和小鼠中验证了其延缓衰老和延长寿命的效果。研究进一步揭示了石胆酸的分子靶点TULP3 (TUB like protein 3),发现TULP3能够通过激活sirtuin-v-ATPase (sirtuin-vacuolar H+-ATPase)信号轴,激活AMPK蛋白(adenosine 5'-monophosphate (AMP)- activated protein kinase),从而延缓衰老。
1.4 环境与生活方式对衰老的影响环境与生活方式对衰老影响的相关性研究持续成为关注热点,这是因为健康的生活方式被广泛认为是延缓衰老、提高生活质量的关键因素。环境与生活方式对衰老影响的相关研究不仅揭示了衰老过程中的多种生物学变化,而且为预防和治疗与衰老相关的疾病提供了新的视角和潜在的治疗策略。
研究表明肠道微生物组的变化与衰老过程中的代谢和生理功能密切相关。随着年龄的增长,肠道微生物群的结构和代谢过程会发生明显变化。2024年2月,西北农林科技大学的研究人员[25]探讨了植物乳杆菌LLY-606对老年小鼠认知功能的影响。研究发现LLY-606能延长小鼠寿命,改善与年龄相关的认知障碍。LLY-606作为一种潜在的功能性益生菌,能够通过调节肠道菌群、调节突触可塑性和增强神经营养因子水平,影响老年小鼠的认知功能。
锻炼作为一种常见的积极生活方式通过某种未知机制保持衰老过程中的神经肌肉功能。来自丹麦哥本哈根大学的学者[26]探讨了肌肉成纤维细胞(musle fibroblast, FIB)和肌肉干细胞(muscle stem cell, MuSC)如何以年龄和运动依赖的方式影响运动神经元。该研究表明,定期锻炼可能有助于维持神经肌肉功能,减缓与年龄相关的运动神经元衰退。2024年2月,伦敦大学学院的研究者[27]对8 771名老年人进行了为期8年的跟踪研究,探讨了多样化休闲活动对健康老龄化的积极作用。结果显示,参与体育、创造性、认知和社交活动能提升老年人在多个健康和功能方面的表现(心脏健康除外)。研究指出,体育和创造性活动可能对老年人的关键衰老指标有积极影响,降低与年龄相关衰退的风险,并帮助老年人保持更长时间的功能自主。2024年4月,Yu等[28]研究发现,随年龄增长,白色脂肪组织中IgG积累增多,影响脂肪功能和代谢健康;热量限制减少IgG积累,而补充IgG抵消其益处;消融巨噬细胞FcRn (neonatal Fc receptor)受体可阻止IgG积累,延长健康寿命;IgG积累与衰老相关,热量限制和FcRn消融可抑制IgG积累,改善代谢健康。2024年11月,来自美国德克萨斯大学和哥伦比亚大学等的学者[29]探讨了饮食在促进大脑健康和认知衰退及痴呆症中的潜在作用。这项研究为认知衰退及痴呆的饮食干预提供了新的研究方向,强调了个性化和大规模公共卫生干预的重要性。
2 全球抗衰老产业发展态势全球抗衰老产业在2024年展现出强劲的发展态势,这一趋势覆盖了市场规模、抗衰老产品以及资本市场三个关键领域。关于抗衰老市场规模,全球抗衰老市场正经历着快速的增长。在抗衰老产品方面,抗衰老产品种类繁多,覆盖药品、保健品、化妆品等多个领域。抗衰老资本市场也显示出对抗衰老产业的高度关注。全球抗衰老市场规模的持续扩张,以及中国抗衰老行业的持续扩容,吸引了大量资本的投入。全球抗衰老产业正处于一个快速发展的阶段,市场规模不断扩大,产品种类日益丰富,资本市场投资活跃,预示着抗衰老产业未来巨大的发展潜力和市场机会。本节将从市场规模、抗衰老产品以及资本市场等方面梳理2024年全球抗衰老产业发展态势,供读者参考。
2.1 抗衰老市场规模平稳增长根据联合国发布的《2024年世界人口展望》报告,到21世纪70年代末,全球65岁及以上的人口数量将超过18岁以下的人口数量。各国老龄化进程虽不同步,但总体在加速发展。老龄化进程的加快为全球抗衰老市场提供巨大的发展空间。Precedence Research的数据显示(图 2),2024年全球抗衰老市场规模为730亿美元,预计到2034年将达到约1 409.4亿美元,2024年至2034年的复合年增长率为6.8%。
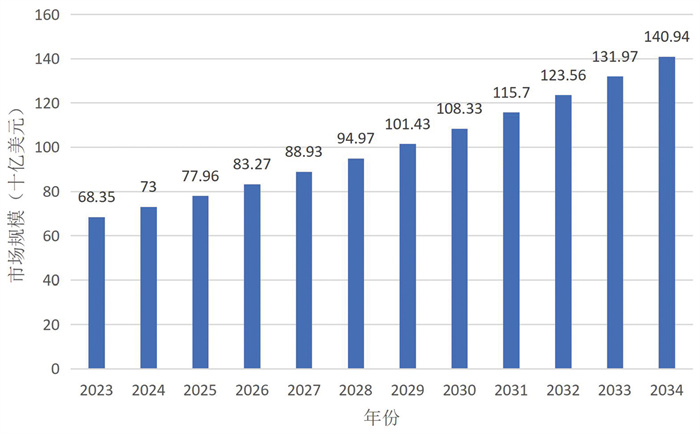
|
数据来源:Precedence Research 图 2 2023—2034全球抗衰老市场规模 |
药品、保健品是市场上常见的抗衰老领域。药品领域也在探索一些药物的抗衰老效果,如二甲双胍等[30]。保健品如β-烟酰胺单核苷酸(NMN),通过增加人体内辅酶(NAD+)含量,延缓身体各器官的衰老[31]。
过去几十年中,科学界广泛探索研究预防疾病的抗衰老机制,多种潜在可以延长生物体寿命的小分子化合物和药物被发现,包括二甲双胍、雷帕霉素、亚精胺、Senolytics药物、Sirtuin活化剂和NAD+前体药物等(表 1)。然而,目前这些药物仍大多处于动物模型阶段,缺乏相关临床试验证据,是否能在临床试验中发挥真正的抗衰老作用,还需要进行更深入的研究进行验证。
| 表 1 常见抗衰老药物概况 |
全球抗衰老保健品市场呈现出快速增长的趋势。NMN (β-烟酰胺单核苷酸)是一种天然存在的生物活性核苷酸,是人体内辅酶(NAD+)的前体物质,人体内的NAD+含量会随着年龄增长而下降。因为NAD+分子很大,没有办法直接被人体吸收,所以只能通过补充分子量较小的NAD+前体物质来实现。而在几种前体物质中,NMN是NAD+最高效、最直接的合成途径[32]。补充NMN可提升人体内NAD+含量,起到抗衰老作用。在2024年上半年,NMN全球销量已达到2 563.8亿美元,较上年同期的同比增长率高达34.6%,在保健品领域的市场占有率飙升至64.7%[33]。随着全球人口老龄化现象的加剧以及消费者健康意识的显著提升,对于具有抗衰老功效的保健品的需求呈现出急剧增长的态势。
2.3 创新驱动发展获资本青睐科学研究的突破是抗衰老产业发展的核心驱动力。无论是细胞重编程、基因疗法,还是mRNA技术,前沿科技的进步为抗衰老产品的开发提供了坚实的基础。
2023年到2024年,全球范围内涌现出大量抗衰老相关的融资事件(表 2),涉及细胞重编程、基因疗法、免疫治疗、mRNA技术等多个前沿科学领域。2023年Altos Labs获得了高达30亿美元的融资,致力于通过细胞重编程技术恢复细胞健康,延缓衰老进程。同样在2023年,Rejuvenation Technologies获得了1 060万美元的融资,专注于开发基于mRNA技术的抗衰老疗法。2024年Terray Therapeutics获得了1.2亿美元的融资,专注于解决与年龄相关的复杂疾病问题;Tolerance Bio则通过1 720万美元的融资,致力于开发预防和治疗免疫相关疾病的新方法,进一步延长寿命。在中国市场,抗衰老领域的融资活动同样活跃。2024年,瑞初医药获得了近亿元人民币的融资,专注于抗衰老药物的开发;2023年,至善唯新获得了逾2亿元人民币的融资,布局基因疗法等抗衰老领域。
| 表 2 近年来抗衰老市场融资事件 |
随着中国逐步进入老龄化社会,衰老领域研究的重要性日益凸显。衰老生物学作为一个快速发展的领域,专注于理解和干预生物衰老的过程。2024年,衰老机制、系统性研究及评价、干预策略、转化应用等方向均取得了丰硕的成果。基于大数据的衰老生物学系统性研究具有战略性意义,相较于其他前沿领域,衰老领域的发展更加依赖于数据驱动型研究范式,以便在系统层面了解生物体是如何动态变化并影响机体衰老的。衰老领域的发展依赖于数据驱动型研究范式,这种研究模式超越了传统的理论框架,成为一种具有迭代特征的“开放式科学”。近年来,大规模数据采集和分析技术的快速发展推动了数据驱动型研究模式的成熟。未来,随着衰老领域的系统性研究不断深入,预计将为衰老生物学带来更加多元的研究视角和发现。例如,多组学数据的集成分析,可能有助于全面理解衰老的复杂本质,揭示更多关于延缓衰老的新靶标。基于生物组学数据构建的衰老时钟,将用于量化个体生理年龄研究,并在人群研究和临床研究中体现实践价值。
新兴技术的出现也可能对衰老机制的前沿研究作出贡献。值得重点关注的技术可能包括单细胞测序技术、器官芯片与类器官技术、人工智能与大数据分析技术及合成生物学技术等。尤其是利用人工智能算法和大数据分析技术,可以整合和分析海量的衰老相关数据,发现新的衰老标志物和干预靶点,推动衰老研究的系统化和精准化。
然而,衰老研究的产业化进程中仍存在一些亟待解决的关键问题。目前,许多抗衰老研究成果仍停留在实验室阶段,如何加强基础研究与临床研究的协同合作,建立完善的转化机制,是产业发展面临的重要挑战。另外,抗衰老产业的发展涉及基因编辑、细胞治疗等前沿技术,存在一定的伦理争议和监管难题。
综上所述,衰老领域的研究正朝着系统性、数据驱动的方向发展,新兴技术的出现将逐步赋能衰老机制研究进入“新纪元”。这些改变不仅有助于学者们更深入理解衰老机制,还将为延缓衰老和改善老年人群健康提供科学依据。然而,如何强化基础研究与临床转化的衔接,加强抗衰老产业的监管,仍是加速衰老研究成果产业化落地的重要议题。需要制定相应的伦理规范和监管政策,确保技术的合理应用和产业的健康发展。
| [1] |
Park AY, Leney-Greene M, Lynberg M, et al. GIMAP5 deficiency reveals a mammalian ceramide-driven longevity assurance pathway. Nat Immunol, 2024, 25: 282-93. DOI:10.1038/s41590-023-01691-y |
| [2] |
Nathalie L, Maria EA, Edgard V, et al. Altered tubulin detyrosination due to SVBP malfunction induces cytokinesis failure and senescence, underlying a complex hereditary spastic paraplegia. Aging Cell, 2025, 24: e14355. DOI:10.1111/acel.14355 |
| [3] |
de Luca KL, Rullens PMJ, Karpinska MA, et al. Genome-wide profiling of DNA repair proteins in single cells. Nat Commun, 2024, 15: 9918. DOI:10.1038/s41467-024-54159-4 |
| [4] |
Felicity JE, Caitlin C, Laura YL, et al. The chromatin factors SET-26 and HCF-1 oppose the histone deacetylase HDA-1 in longevity and gene regulation in C. elegans. Nat Commun, 2024, 15: 2320. DOI:10.1038/s41467-024-46510-6 |
| [5] |
Wu Z, Qu J, Liu GH. Roles of chromatin and genome instability in cellular senescence and their relevance to ageing and related diseases. Nat Rev Mol Cell Biol, 2024, 25: 979-1000. DOI:10.1038/s41580-024-00775-3 |
| [6] |
Membrez M, Migliavacca E, Christen S, et al. Trigonelline is an NAD+ precursor that improves muscle function during ageing and is reduced in human sarcopenia. Nat Metab, 2024, 6: 433-47. DOI:10.1038/s42255-024-00997-x |
| [7] |
Kim GH, Jeong HJ, Lee YJ, et al. Vitamin D ameliorates age-induced nonalcoholic fatty liver disease by increasing the mitochondrial contact site and cristae organizing system (MICOS) 60 level. Exp Mol Med, 2024, 56: 142-55. DOI:10.1038/s12276-023-01125-7 |
| [8] |
Morrow CS, Yao P, Vergani-Junior CA, et al. Endogenous mitochondrial NAD(P)H fluorescence can predict lifespan. Commun Biol, 2024, 7: 1551. DOI:10.1038/s42003-024-07243-w |
| [9] |
Sebastian DH, Jane AE, Aonghus L, et al. The 'middle-aging'brain. Trends Neurosci, 2024, 47: 259-72. DOI:10.1016/j.tins.2024.02.001 |
| [10] |
Yang Y, Lu X, Liu N, et al. Metformin decelerates aging clock in male monkeys. Cell, 2024, 187: 6358-78.e29. DOI:10.1016/j.cell.2024.08.021 |
| [11] |
Hu X, Lu J, Ding C, et al. The N6-methyladenosine landscape of ovarian development and aging highlights the regulation by RNA stability and chromatin state. Aging Cell, 2024. DOI:10.1111/acel.14376 |
| [12] |
Yousefzadeh MJ, Flores RR, Zhu Y, et al. An aged immune system drives senescence and ageing of solid organs. Nature, 2021, 594: 100-5. DOI:10.1038/s41586-021-03547-7 |
| [13] |
Minhas PS, Latif-Hernandez A, McReynolds MR, et al. Restoring metabolism of myeloid cells reverses cognitive decline in ageing. Nature, 2021, 590: 122-28. DOI:10.1038/s41586-020-03160-0 |
| [14] |
Gulen MF, Samson N, Keller A, et al. cGAS-STING drives ageing-related inflammation and neurodegeneration. Nature, 2023, 620: 374-80. DOI:10.1038/s41586-023-06373-1 |
| [15] |
Wang Y, Fu Z, Li X, et al. Cytoplasmic DNA sensing by KU complex in aged CD4+ T cell potentiates T cell activation and aging-related autoimmune inflammation. Immunity, 2021, 54: 632-47.e9. DOI:10.1016/j.immuni.2021.02.003 |
| [16] |
Pei S, Deng X, Yang R, et al. Age-related decline in CD8+ tissue resident memory T cells compromises antitumor immunity. Nat Aging, 2024, 4: 1828-44. DOI:10.1038/s43587-024-00746-5 |
| [17] |
Tighanimine K, Nabuco JA, Nemazanyy I, et al. A homoeostatic switch causing glycerol-3-phosphate and phosphoethanolamine accumulation triggers senescence by rewiring lipid metabolism. Nat Metab, 2024, 6: 323-42. DOI:10.1038/s42255-023-00972-y |
| [18] |
Wang Q, Wang X, Liu B, et al. Aging induces region-specific dysregulation of hormone synthesis in the primate adrenal gland. Nat Aging, 2024, 4: 396-413. DOI:10.1038/s43587-024-00588-1 |
| [19] |
Wu C, Tu T, Xie M, et al. Spatially resolved transcriptome of the aging mouse brain. Aging Cell, 2024, 23: e14109. DOI:10.1111/acel.14109 |
| [20] |
Ma S, Ji Z, Zhang B, et al. Spatial transcriptomic landscape unveils immunoglobin-associated senescence as a hallmark of aging. Cell, 2024, 187: 7025-44.e34. DOI:10.1016/j.cell.2024.10.019 |
| [21] |
Wang S, Ren J, Jing Y, et al. Perspectives on biomarkers of reproductive aging for fertility and beyond. Nat Aging, 2024, 4: 1697-710. DOI:10.1038/s43587-024-00770-5 |
| [22] |
Arora S, Mittal A, Duari S, et al. Discovering geroprotectors through the explainable artificial intelligence-based platform AgeXtend. Nat Aging, 2024. DOI:10.1038/s43587-024-00763-4 |
| [23] |
Qu Q, Chen Y, Wang Y, et al. Lithocholic acid phenocopies anti-ageing effects of calorie restriction. Nature, 2024. DOI:10.1038/s41586-024-08329-5 |
| [24] |
Qu Q, Chen Y, Wang Y, et al. Lithocholic acid binds TULP3 to activate sirtuins and AMPK to slow down ageing. Nature, 2024. DOI:10.1038/s41586-024-08348-2 |
| [25] |
Shi R, Ye J, Fan H, et al. Lactobacillus plantarum LLY-606 supplementation ameliorates the cognitive impairment of natural aging in mice: the potential role of gut microbiota homeostasis. J Agric Food Chem, 2024, 72: 4049-62. DOI:10.1021/acs.jafc.3c07041 |
| [26] |
Soendenbroe C, Schjerling P, Bechshøft CJL, et al. Muscle fibroblasts and stem cells stimulate motor neurons in an age and exercise-dependent manner. Aging Cell, 2024, 18: e14413. |
| [27] |
Bone JK, Bu F, Sonke JK, et al. Leisure engagement in older age is related to objective and subjective experiences of aging. Nat Commun, 2024, 15: 1499. DOI:10.1038/s41467-024-45877-w |
| [28] |
Yu L, Wan Q, Liu Q, et al. IgG is an aging factor that drives adipose tissue fibrosis and metabolic decline. Cell Metab, 2024, 36: 793-807. DOI:10.1016/j.cmet.2024.01.015 |
| [29] |
Charisis S, Yannakoulia M, Scarmeas N. Diets to promote healthy brain ageing. Nat Rev Neurol, 2025, 21: 5-16. DOI:10.1038/s41582-024-01036-9 |
| [30] |
Barzilai N, Crandall JP, Kritchevsky SB, et al. Metformin as a tool to target aging. Cell Metab, 2016, 23: 1060-65. DOI:10.1016/j.cmet.2016.05.011 |
| [31] |
Imai S, Guarente L. NAD+ and sirtuins in aging and disease. Trends Cell Biol, 2014, 24: 464-71. DOI:10.1016/j.tcb.2014.04.002 |
| [32] |
Yoshino J, Baur J A, Imai S. NAD+ intermediates: the biology and therapeutic potential of NMN and NR. Cell Metab, 2018, 27: 513-28. DOI:10.1016/j.cmet.2017.11.002 |
| [33] |
NMN年终市场调研报告: 2024年发展状态与科研技术突破[EB/OL](2024-12-17)[2025-01-02]. https://www.sohu.com/a/838429546_121320448
|
 2025, Vol. 37
2025, Vol. 37 

 张博文,男,中国科学院上海营养与健康研究所生命科学信息中心馆员,上海科技翻译学会会员。主要从事生物医药领域的科技情报研究与咨询服务工作。先后参与了多项上海市卫健委、上海市科委、生态环境部等组织机构课题项目。发表SCI论文2篇,参编生物医药科技领域著作6本。近三年获得上海市科技情报成果奖二等奖1项,服务数十余家政府单位、科研机构与企业;
张博文,男,中国科学院上海营养与健康研究所生命科学信息中心馆员,上海科技翻译学会会员。主要从事生物医药领域的科技情报研究与咨询服务工作。先后参与了多项上海市卫健委、上海市科委、生态环境部等组织机构课题项目。发表SCI论文2篇,参编生物医药科技领域著作6本。近三年获得上海市科技情报成果奖二等奖1项,服务数十余家政府单位、科研机构与企业; 肖意传,中国科学院上海营养与健康研究所研究员,博士生导师。国家杰出青年基金获得者,上海市优秀学术带头人。主要致力于免疫衰老的调控与致病机制的研究,针对衰老机体免疫学特征、免疫失衡,及其促进相关疾病病理等方面,取得了重要的原创性成果,筛选获得了治疗衰老相关疾病的新型小分子先导化合物。近年来以通讯作者在Immunity、Nat Aging、Cell Rep Med、Mol Cell、J Exp Med等期刊上发表研究论文,并申请多项专利。获Harold C. and Mary L. Daily奖、上海市生化与分子生物学学会青年新锐奖、中国科学院优秀导师奖、领雁奖等;
肖意传,中国科学院上海营养与健康研究所研究员,博士生导师。国家杰出青年基金获得者,上海市优秀学术带头人。主要致力于免疫衰老的调控与致病机制的研究,针对衰老机体免疫学特征、免疫失衡,及其促进相关疾病病理等方面,取得了重要的原创性成果,筛选获得了治疗衰老相关疾病的新型小分子先导化合物。近年来以通讯作者在Immunity、Nat Aging、Cell Rep Med、Mol Cell、J Exp Med等期刊上发表研究论文,并申请多项专利。获Harold C. and Mary L. Daily奖、上海市生化与分子生物学学会青年新锐奖、中国科学院优秀导师奖、领雁奖等; 江洪波,博士,中国科学院上海营养与健康研究所生命科学信息中心研究馆员,硕士生导师。2014年入选国家知识产权局“全国专利信息领军人才”,2016年入选“中国科学院特聘研究员”计划特聘骨干人才。主要研究方向为产业与技术情报、竞争情报、科技查新。先后承担科技部、商务部、工信部、生态环境部、国家开发银行、上海市科委、上海市经信委、上海市商务委、上海市知识产权局等委托的决策咨询课题研究工作,以及多家企业委托的产业研究和知识产权战略课题
江洪波,博士,中国科学院上海营养与健康研究所生命科学信息中心研究馆员,硕士生导师。2014年入选国家知识产权局“全国专利信息领军人才”,2016年入选“中国科学院特聘研究员”计划特聘骨干人才。主要研究方向为产业与技术情报、竞争情报、科技查新。先后承担科技部、商务部、工信部、生态环境部、国家开发银行、上海市科委、上海市经信委、上海市商务委、上海市知识产权局等委托的决策咨询课题研究工作,以及多家企业委托的产业研究和知识产权战略课题