真核光合生物的胞内氧化还原平衡和全细胞代谢的协调高度依赖于细胞内多个区室间复杂的相互作用[1-2]。叶绿体是能量和物质的加工厂,越来越多的证据表明叶绿体与其他区室间的电子流动可以显著影响细胞功能和光合固碳效率[3-5]。本文聚焦叶绿体还原力的穿梭以及光合同化产物的运输机制,总结真核光合生物如何通过调控物质与能量运输维持高光效,从而实现对多变环境的适应。
1 电子安全阀门在高等植物和藻类中,光合作用是一种关键生物过程,它驱动着光合电子传递与二氧化碳的固定,为胞内代谢合成过程提供能量和有机碳。光合作用的核心是光合复合体,它们能够捕获和吸收光能,将其转化为低电位的电子,推动线性与环状电子流、还原力、ATP以及还原态有机碳的生产。然而,光驱动产生的电子是一把双刃剑。一方面,光驱动电子能够促进细胞分裂与生长;另一方面,在胁迫环境下,光驱动产生的过量电子、还原力以及ATP会导致能量产生与利用的失衡,并生产有毒性的活性氧(ROS)分子[6]。为了缓解胁迫环境诱导产生的过量电子对胞内氧化还原平衡的影响,光合生物进化了多样的光保护机制,也被称为“电子安全阀门”,主要包括能够以热量形式安全散发过量光能的非光化学猝灭(non-photochemical quenching, NPQ)和以化学能形式消散的光化学猝灭(photochemical quenching)[7-12]。
2 光化学猝灭近些年来光化学猝灭在帮助光合细胞对抗过量电子压力中的关键作用越来越清晰。其中,参与CO2固定的多糖与油脂合成是光化学猝灭的主要形式。在胁迫环境下,高等植物或藻类可以将叶绿体过量电子通过合成多糖或油脂的形式储存起来,对抗逆境条件[13-15] (图 1)。除涉及CO2固定的路径外,光系统I (PSI)附近的电子通过梅勒(Mehler)反应转化为H2O,产生有害的活性氧物质(ROS)[16];另外,在高等植物或蓝藻叶绿体中,NADH脱氢酶(NDH)复合体(在莱茵衣藻中为II型NADH脱氢酶NDA2)能够将过量NADPH的电子导入质体醌库(PQ pool),最终被质体末端氧化酶(PTOX)将O2转化为H2O (图 1)[17-18];除了PTOX外,黄素蛋白(FLVA和FLVB)可直接将O2还原为H2O,此过程无ROS的产生(图 1),而此蛋白在光合生物中仅存在于蓝藻、绿藻以及裸子植物中,在被子植物中并不保守[19-22]。
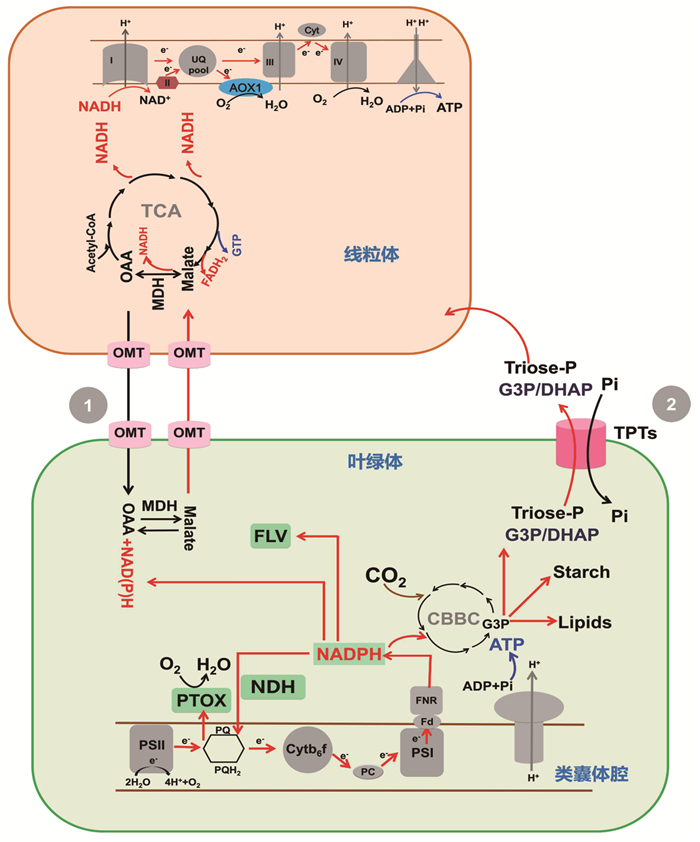
|
图 1 光驱动电子流图谱(红色线:电子/还原力流;蓝色线:ATP流) |
此外,叶绿体内过剩电子可以被运出至线粒体,并且被呼吸电子传递链消散,叶绿体与线粒体电子流协作能够有效对抗光胁迫。最初,通过使用线粒体抑制剂的研究首次发现了叶绿体与线粒体之间的能量流协作现象[23-24]。随后的研究通过对一系列线粒体呼吸缺陷型突变株的表征(包括缺失线粒体ATPase以及复合体I或III的突变株),进一步确定了叶绿体与线粒体之间的功能互作[25-26]。抗氰交替途径被证明是维持叶绿体和线粒体能量流协作的重要机制之一。
真核光合生物的线粒体电子传递链不仅包含细胞色素主路径,还具有对氰化物不敏感的抗氰交替途径。抗氰交替途径的电子流动受交替氧化酶(alternative oxidase, AOX)的调控,电子流绕过复合体III或IV,经AOX催化氧生成水,整个过程不产生质子电化学势,该路径是一个耗能过程[27]。另一方面,AOX路径也可保证在呼吸主链受限制时糖酵解与三羧酸循环的正常运行。在高等植物与藻类中,线粒体交替呼吸途径对优化光合代谢至关重要, 例如,对绿藻模式种莱茵衣藻AOX敲除株的研究发现,AOX可以维持在强光下衣藻的存活以及光合电子的高效传递[5] (图 2)。在硅藻模式种三角褐指藻中,AOX甚至对正常光下的光合活性的维持也起到重要作用[3]。此外,AOX调控的叶绿体与线粒体的能量流协作有助于CO2的浓缩与固定[3-4]。而此路径似乎也参与了高等植物的生长发育和信号转导等众多生理过程[28-29]。可见,在高等植物和藻类中,受AOX调控的呼吸电子流对维持强光或正常光照下光合电子传递链的活性以及高效固碳至关重要。虽然近些年来对于叶绿体与线粒体间还原力穿梭以及物质交换机制的研究取得了一些进展,但仍有待进一步研究。
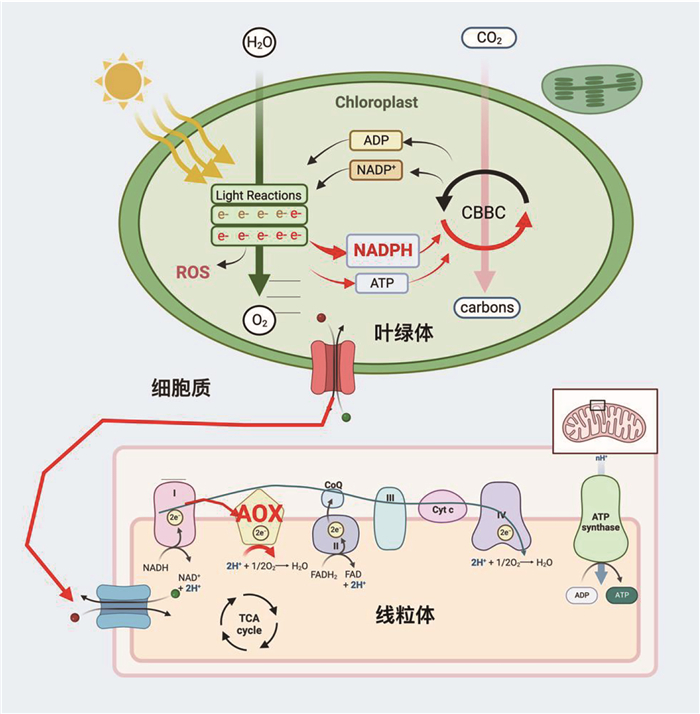
|
图 2 AOX维持强光下叶绿体高效电子传递 |
虽然植物含有NAD(P)+转运体,但这些NAD(P)+转运体对NAD(P)H的亲和性很低,还原力(NAD(P)H)不能够直接穿透细胞的膜系统,因此NAD(P)H只能通过间接方式在细胞器之间运输。长期以来,苹果酸阀(malate valves) 被认为是负责各区室间还原力交换的主要机制之一[30-31]。苹果酸阀由苹果酸脱氢酶(MDH) 以及二羧酸盐转运体等元件组成(图 3)。MDH可催化苹果酸氧化为草酰乙酸,并在可逆反应中将NAD(P)+转化为NAD(P)H。在高等植物或绿藻中,MDH分布于叶绿体、细胞质、线粒体以及过氧化物酶体等多个细胞区室内[32-33] (图 3)。另外一个使苹果酸阀成为主要穿梭机制的关键元件是位于不同细胞器被膜上的二羧酸盐转运蛋白体,主要负责运输苹果酸或草酰乙酸等物质。这种不同细胞器之间的分布允许还原力以苹果酸的形式在不同区室之间的间接穿梭,从而平衡各区室的氧化还原状态,参与全细胞能量代谢(图 3)。例如,叶绿体和线粒体之间的苹果酸循环会引起线粒体产生ROS,从而调节细胞生长,甚至诱发细胞凋亡[34]。因此,苹果酸阀的穿梭对细胞代谢平衡至关重要。
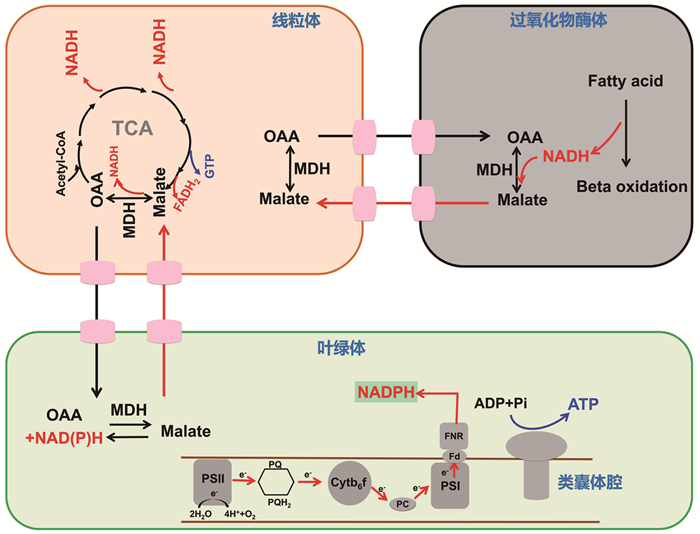
|
图 3 还原力通过苹果酸阀实现在细胞器之间的穿梭 |
植物叶绿体MDH受到光的严格调控,主要通过硫氧还蛋白系统进行。长期以来,学术界普遍认为叶绿体过剩的NADPH可被质体NADP依赖型MDH (plNADP-MDH) 氧化为苹果酸。然后,二羧酸盐转运体将苹果酸从叶绿体运输至细胞质等其他细胞器,以消散过剩的NADPH,从而平衡叶绿体氧化还原稳态,保护光系统的活性。但是,当拟南芥缺失plNADP-MDH时,突变株的生长及光合电子传递并没有受到显著影响[35];而拟南芥或烟草中负责苹果酸转运的叶绿体内膜上的二羧酸盐转运体突变株omt1的生长和光合活性被显著抑制[36-37]。这些研究结果表明,叶绿体可能存在除NADP-MDH外的替代酶负责苹果酸的生成,或者存在还原力穿梭的替代路径。尽管在强光下,plNADP-MDH的缺失不会引起明显的生长表型,但最新研究表明,plNADP-MDH对维持波动光条件下拟南芥的最优光合电子传递速率至关重要[38]。
与高等植物类似,绿藻的模式种莱茵衣藻叶绿体中含有5种MDH。据推测,MDH1可能在叶绿体或过氧化物酶体中,MDH2在过氧化物酶体中,MDH3、4和5分别存在于在细胞质、线粒体和叶绿体中[1, 39-40]。然而,除了MDH2的生理功能已被详细研究外,其他四种MDH的功能尚未被研究。同样,其他藻类中也缺乏对苹果酸阀穿梭机制鉴定以及生理功能的研究。
3.2 质体NAD依赖型苹果酸脱氢酶除NADP依赖型MDH外,叶绿体还含有NAD依赖型MDH (plNAD-MDH)。近些年的研究发现,plNAD-MDH能将叶绿体中过量的NADH还原为苹果酸,并将其输出至线粒体。在线粒体中,苹果酸被线粒体MDH (mMDH1)转化为草酰乙酸(oxaloa-cetate, OAA) OAA,同时产生NADH,为线粒体呼吸链提供电子,从而诱导ROS形成,并有可能引起细胞的程序性死亡过程。因此,plNAD-MDH可以消散叶绿体过剩的NADH,更进一步表明其是叶绿体和线粒体之间交流的关键元件[34, 41]。此外,plNAD-MDH在拟南芥中是兼职功能蛋白,参与叶绿体发育过程[42]。
4 叶绿体代谢物的运输叶绿体代谢物的向外运输可以显著影响细胞的生长和光合活性,也可以将还原力输出叶绿体同时将氧化还原信号传递至细胞核,协调叶绿体和核基因的表达,以响应环境变化和细胞的代谢需求(图 4)。光合生物叶绿体被膜上含有多种糖的转运蛋白,这些转运蛋白允许碳水化合物在叶绿体和细胞质之间交换。质体磷酸转运蛋白(plastidic phosphate translocators, pPT)家族是叶绿体被膜上最主要的碳水化合物转运蛋白,该家族的转运体能够催化无机磷酸(Pi) 与磷酸化丙糖、五碳糖或六碳糖等的反向交换[43]。光合生物含有四种pPT亚家族(图 4),包括:磷酸丙糖转运体(triose-P/phosphate translocator, TPT)能够将叶绿体光合初级产物磷酸丙糖输出至细胞质[44-45];6-磷酸-葡萄糖转运体(GPT)负责把6-磷酸-葡萄糖输入到植物异养组织的质体中[46];磷酸木酮糖转运体(XPT),在协调胞质和质体戊糖磷酸途径中发挥关键作用[47];以及磷酸烯醇丙酮酸(PEP) 转运体(PPT),在C3植物的叶绿体中,PPT负责把PEP导入C3植物质体中,用于脂肪酸的合成[48];而在C4植物中,PPT则将PEP从质体中输出[49]。此外,光合生物叶绿体被膜还含有麦芽糖转运体(MEX1),负责将夜间淀粉的降解产物运出叶绿体,MEX1的缺失显著抑制了高等植物的生长,因此,MEX1对麦芽糖的转运是双子叶植物光合同化产物在夜间输出叶绿体的主导通道[50]。由此可见,叶绿体被膜上拥有由多种转运蛋白组成的复杂的碳水化合物运输体系。
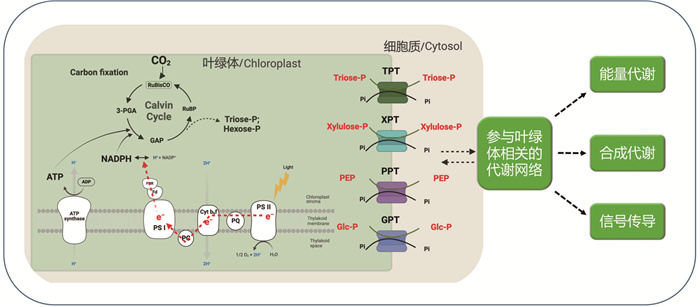
|
图 4 叶绿体被膜有机碳转运体系及其功能 |
光合作用暗反应,即卡尔文循环,利用ATP和NADPH把二氧化碳同化为磷酸丙糖(triose-phosphate: triose-P),如3-磷酸-甘油醛(glyceraldehyde- 3-phosphate, G3P)和磷酸二羟丙酮(dihydroxyacetone phosphate, DHAP)。因此,磷酸丙糖是同时携带了还原力(NADPH)和固定碳的初级光合产物。据此,除苹果酸阀外,叶绿体TPT运输体系被认为是光合电子传递链积累的过剩还原力穿梭的另一机制。
在过去的几十年中,对于高等植物叶绿体TPT的生理功能进行了较为详尽的研究,然而在单细胞微藻中的研究却相对较少。在多种双子叶植物(例如烟草和拟南芥等)中,敲除或敲降叶绿体TPT的表型并不明显,其生长和光合活性仅受轻微影响[51-54]。研究表明,TPT活性的降低可以通过将光合同化的碳重新分配到过渡性淀粉库中来补偿,这些淀粉在光照和/或黑暗中会加速降解,降解产物通过MEX1从叶绿体中输出至细胞质,用于合成蔗糖(图 5)。随后,蔗糖被运输到植物异养组织中,供细胞生长[51-52, 54] (图 5)。因此,在大部分双子叶植物中,TPT丢失后光合同化产物可以通过替代路径从叶绿体输出(图 5)。有趣的是,与双子叶植物相比,水稻TPT缺乏则导致了较为显著的表型。水稻突变株与野生型相比,其光合速率降低,淀粉和可溶性糖水平降低。水稻叶片储存淀粉能力有限,这可能是导致此现象的原因,因为它倾向于以蔗糖而不是淀粉作为过渡性碳库。
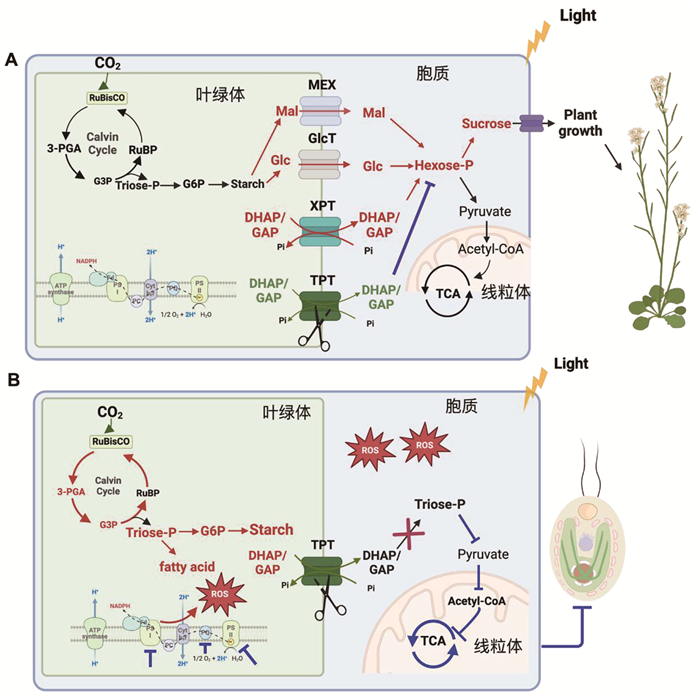
|
A:高等植物光合同化碳转运的可塑性;B:莱茵衣藻TPT光合产物的输出是必需的 图 5 高等植物与莱茵衣藻叶绿体光合产物输出比较 |
在TPT缺失的情况下,叶绿体积累的磷酸丙糖可以被XPT转出,部分弥补了TPT缺失导致的磷酸丙糖转运失活[55]。综上所述,在高等植物中,光合同化碳水化合物的转运具有很强的可塑性,涉及多个转运体之间的高度协调(图 5)。然而,关于磷酸丙糖转运体作为叶绿体还原力的穿梭通道的直接生理证据仍然不足。
4.2 莱茵衣藻叶绿体磷酸丙糖的运输虽然叶绿体代谢物向外运输对全细胞代谢活动至关重要,然而在莱茵衣藻等微藻中,叶绿体转运蛋白的活性和底物特异性、具体调控方式及其协同发挥功能的机制尚不清楚。最新研究发现磷酸丙糖转运蛋白3 (TPT3) 是莱茵衣藻在多种光照条件下叶绿体向外运输固定碳的主要渠道[56]。突变体tpt3表现出极为显著的多效性表型,TPT3的缺失显著影响了生长、光合作用活性、代谢产物谱、碳分配以及细胞器过氧化氢的积累等多个表型[56] (表 1)。并且,该研究从生理上揭示了TPT3同时发挥光合安全阀的作用,可以将叶绿体过剩还原力从叶绿体中排出,以减轻低/中等光照强度下细胞过量的氧化应激和活性氧积累,有效地维持光合电子传递链的最优传递速率[56];阐明了衣藻TPT对光合产物的转运是必不可少的,不能被其他路径所替代,从而展现了衣藻和高等植物在叶绿体光同化物输出机制的差异(图 5)。
| 表 1 拟南芥与莱茵衣藻中参与叶绿体还原力与光合固定碳输出的主要元件 |
叶绿体被膜代谢物转运体将叶绿体以及其他各区室代谢连为复杂的网络,并且光合生物胞内区室化的代谢分布显著影响细胞的光合效率。因此,一方面叶绿体代谢物转运体系的研究有助于深度解析各个区室物质能量代谢及其对光合效率的调控作用,另一方面为通过合成生物学的手段定向改造叶绿体、细胞质等的代谢流,提高光合效率提供了关键元件。目前虽然对叶绿体被膜碳转运蛋白的转运特性以及生理功能的研究取得了一定的进展(表 1),但是受限于转运蛋白协同的生理复杂性以及技术上目前无法区分区室化代谢,多种蛋白协同调控光合效率以及胞内代谢的研究尚浅。因此,未来利用基因组编辑技术创制突变株结合多组学、代谢网络流分析与机器学习对区室代谢进行分析与模拟,深度解析多种运输体系的协作机制以及它们是如何互作维持多变环境下代谢的平稳,同时挖掘可定向改造代谢流,提高光合效率的关键元件,为通过合成生物学的手段创制新的光合底盘提供工具。
| [1] |
Johnson X, Alric J. Central carbon metabolism and electron transport in Chlamydomonas reinhardtii: metabolic constraints for carbon partitioning between oil and starch. Eukaryot Cell, 2013, 12: 776-93. DOI:10.1128/EC.00318-12 |
| [2] |
Gruber A, Kroth PG. Intracellular metabolic pathway distribution in diatoms and tools for genome-enabled experimental diatom research. Philos Trans R Soc Lond B Biol Sci, 2017, 372: 20160402. DOI:10.1098/rstb.2016.0402 |
| [3] |
Bailleul B, Berne N, Murik O, et al. Energetic coupling between plastids and mitochondria drives CO2 assimilation in diatoms. Nature, 2015, 524: 366-9. DOI:10.1038/nature14599 |
| [4] |
Burlacot A, Dao O, Auroy P, et al. Alternative photosynthesis pathways drive the algal CO2-concentrating mechanism. Nature, 2022, 605: 366-71. DOI:10.1038/s41586-022-04662-9 |
| [5] |
Kaye Y, Huang W, Clowez S, et al. The mitochondrial alternative oxidase from Chlamydomonas reinhardtii enables survival in high light. J Biol Chem, 2019, 294: 1380-95. DOI:10.1074/jbc.RA118.004667 |
| [6] |
Niyogi KK. Safety valves for photosynthesis. Curr Opin Plant Biol, 2000, 3: 455-60. DOI:10.1016/S1369-5266(00)00113-8 |
| [7] |
Asada K. The water-water cycle in chloroplasts: scavenging of active oxygens and dissipation of excess photons. Annu Rev Plant Physiol Plant Mol Biol, 1999, 50: 601-39. DOI:10.1146/annurev.arplant.50.1.601 |
| [8] |
Peltier G, Tolleter D, Billon E, et al. Auxiliary electron transport pathways in chloroplasts of microalgae. Photosynth Res, 2010, 106: 19-31. DOI:10.1007/s11120-010-9575-3 |
| [9] |
Dang KV, Plet J, Tolleter D, et al. Combined increases in mitochondrial cooperation and oxygen photoreduction compensate for deficiency in cyclic electron flow in Chlamydomonas reinhardtii. Plant Cell, 2014, 26: 3036-50. DOI:10.1105/tpc.114.126375 |
| [10] |
Erickson E, Wakao S, Niyogi KK. Light stress and photoprotection in Chlamydomonas reinhardtii. Plant J, 2015, 82: 449-65. DOI:10.1111/tpj.12825 |
| [11] |
Kramer DM, Evans JR. The importance of energy balance in improving photosynthetic productivity. Plant Physiol, 2011, 155: 70-8. DOI:10.1104/pp.110.166652 |
| [12] |
Saroussi SI, Wittkopp TM, Grossman AR. The type Ⅱ NADPH dehydrogenase facilitates cyclic electron flow, energy-dependent quenching, and chlororespiratory metabolism during acclimation of Chlamydomonas reinhardtii to nitrogen deprivation. Plant Physiol, 2016, 170: 1975-88. DOI:10.1104/pp.15.02014 |
| [13] |
Krishnan A, Kumaraswamy GK, Vinyard DJ, et al. Metabolic and photosynthetic consequences of blocking starch biosynthesis in the green alga Chlamydomonas reinhardtii sta6 mutant. Plant J, 2015, 81: 947-60. DOI:10.1111/tpj.12783 |
| [14] |
Huang W, Haferkamp I, Lepetit B, et al. Reduced vacuolar β-1, 3-glucan synthesis affects carbohydrate metabolism as well as plastid homeostasis and structure in Phaeodactylum tricornutum. Proc Natl Acad Sci U S A, 2018, 115: 4791-6. DOI:10.1073/pnas.1719274115 |
| [15] |
Ge F, Huang W, Chen Z, et al. Methylcrotonyl-CoA carboxylase regulates triacylglycerol accumulation in the model diatom Phaeodactylum tricornutum. Plant Cell, 2014, 26: 1681-97. DOI:10.1105/tpc.114.124982 |
| [16] |
Osmond CB, Foyer CH, Bock G, et al. Electron flow to oxygen in higher plants and algae: rates and control of direct photoreduction (Mehler reaction) and rubisco oxygenase. Philos Trans R Soc Lond B Biol Sci, 2000, 355: 1433-46. DOI:10.1098/rstb.2000.0704 |
| [17] |
Houille-Vernes L, Rappaport F, Wollman FA, et al. Plastid terminal oxidase 2 (PTOX2) is the major oxidase involved in chlororespiration in Chlamydomonas. Proc Natl Acad Sci U S A, 2011, 108: 20820-5. DOI:10.1073/pnas.1110518109 |
| [18] |
Ma M, Liu Y, Bai C, et al. The significance of chloroplast NAD(P)H dehydrogenase complex and its dependent cyclic electron transport in photosynthesis. Front Plant Sci, 2021, 12: 661863. DOI:10.3389/fpls.2021.661863 |
| [19] |
Helman Y, Tchernov D, Reinhold L, et al. Genes encoding A-type flavoproteins are essential for photoreduction of O2 in Cyanobacteria. Curr Biol, 2003, 13: 230-5. DOI:10.1016/S0960-9822(03)00046-0 |
| [20] |
Chaux F, Burlacot A, Mekhalfi M, et al. Flavodiiron proteins promote fast and transient O2 photoreduction in Chlamydomonas. Plant Physiol, 2017, 174: 1825-36. DOI:10.1104/pp.17.00421 |
| [21] |
Zhang P, Allahverdiyeva Y, Eisenhut M, et al. Flavodiiron proteins in oxygenic photosynthetic organisms: photoprotection of photosystem Ⅱ by Flv2 and Flv4 in Synechocystis sp. PCC 6803. PLoS One, 2009, 4: e5331. DOI:10.1371/journal.pone.0005331 |
| [22] |
Yamamoto H, Takahashi S, Badger MR, et al. Artificial remodelling of alternative electron flow by flavodiiron proteins in Arabidopsis. Nat Plants, 2016, 2: 16012. DOI:10.1038/nplants.2016.12 |
| [23] |
Kromer S. Respiration during photosynthesis. Annu Rev Plant Biol, 1995, 46: 45-70. DOI:10.1146/annurev.pp.46.060195.000401 |
| [24] |
Krömer S, Heldt HW. On the role of mitochondrial oxidative phosphorylation in photosynthesis metabolism as studied by the effect of oligomycin on photosynthesis in protoplasts and leaves of barley (Hordeum vulgare). Plant Physiol, 1991, 95: 1270-6. DOI:10.1104/pp.95.4.1270 |
| [25] |
Cardol P, Alric J, Girard-Bascou J, et al. Impaired respiration discloses the physiological significance of state transitions in Chlamydomonas. Proc Natl Acad Sci U S A, 2009, 106: 15979-84. DOI:10.1073/pnas.0908111106 |
| [26] |
Cardol P, Matagne RF, Remacle C. Impact of mutations affecting ND mitochondria-encoded subunits on the activity and assembly of complex I in Chlamydomonas. Implication for the structural organization of the enzyme.. J Mol Biol, 2002, 319: 1211-21. DOI:10.1016/S0022-2836(02)00407-2 |
| [27] |
Vanlerberghe GC, McIntosh L. Alternative oxidase: from gene to function. Annu Rev Plant Physiol Plant Mol Biol, 1997, 48: 703-34. DOI:10.1146/annurev.arplant.48.1.703 |
| [28] |
Pu X, Lv X, Tan T, et al. Roles of mitochondrial energy dissipation systems in plant development and acclimation to stress. Ann Bot, 2015, 116: 583-600. DOI:10.1093/aob/mcv063 |
| [29] |
Rogov AG, Zvyagilskaya RA. Physiological role of alternative oxidase (from yeasts to plants). Biochemistry (Mosc), 2015, 80: 400-7. DOI:10.1134/S0006297915040021 |
| [30] |
Noguchi K, Yoshida K. Interaction between photosynthesis and respiration in illuminated leaves. Mitochondrion, 2008, 8: 87-99. DOI:10.1016/j.mito.2007.09.003 |
| [31] |
Scheibe R, Backhausen JE, Emmerlich V, et al. Strategies to maintain redox homeostasis during photosynthesis under changing conditions. J Exp Bot, 2005, 56: 1481-9. DOI:10.1093/jxb/eri181 |
| [32] |
Selinski J, Scheibe R. Malate valves: old shuttles with new perspectives. Plant Biol, 2019, 21: 21-30. DOI:10.1111/plb.12869 |
| [33] |
Cousins AB, Pracharoenwattana I, Zhou W, et al. Peroxisomal malate dehydrogenase is not essential for photorespiration in Arabidopsis but its absence causes an increase in the stoichiometry of photorespiratory CO2 release. Plant Physiol, 2008, 148: 786-95. DOI:10.1104/pp.108.122622 |
| [34] |
Zhao Y, Yu H, Zhou JM, et al. Malate circulation: linking chloroplast metabolism to mitochondrial ROS. Trends Plant Sci, 2020, 25: 446-54. DOI:10.1016/j.tplants.2020.01.010 |
| [35] |
Hebbelmann I, Selinski J, Wehmeyer C, et al. Multiple strategies to prevent oxidative stress in Arabidopsis plants lacking the malate valve enzyme NADP-malate dehydrogenase. J Exp Bot, 2011, 63: 1445-59. |
| [36] |
Kinoshita H, Nagasaki J, Yoshikawa N, et al. The chloroplastic 2-oxoglutarate/malate transporter has dual function as the malate valve and in carbon/nitrogen metabolism. Plant J, 2011, 65: 15-26. DOI:10.1111/j.1365-313X.2010.04397.x |
| [37] |
Schneidereit J, Häusler RE, Fiene G, et al. Antisense repression reveals a crucial role of the plastidic 2-oxoglutarate/malate translocator DiT1 at the interface between carbon and nitrogen metabolism. Plant J, 2006, 45: 206-24. DOI:10.1111/j.1365-313X.2005.02594.x |
| [38] |
Yokochi Y, Yoshida K, Hahn F, et al. Redox regulation of NADP-malate dehydrogenase is vital for land plants under fluctuating light environment. Proc Natl Acad Sci U S A, 2021, 118: e2016903118. DOI:10.1073/pnas.2016903118 |
| [39] |
Burlacot A, Peltier G, Li-Beisson Y. Subcellular energetics and carbon storage in Chlamydomonas. Cells, 2019, 8: 1154. DOI:10.3390/cells8101154 |
| [40] |
Kong F, Liang Y, Légeret B, et al. Chlamydomonas carries out fatty acid β-oxidation in ancestral peroxisomes using a bona fide acyl-CoA oxidase. Plant J, 2017, 90: 358-71. DOI:10.1111/tpj.13498 |
| [41] |
Zhao Y, Luo L, Xu J, et al. Malate transported from chloroplast to mitochondrion triggers production of ROS and PCD in Arabidopsis thaliana. Cell Res, 2018, 28: 448-61. DOI:10.1038/s41422-018-0024-8 |
| [42] |
Schreier TB, Cléry A, Schläfli M, et al. Plastidial NAD-dependent malate dehydrogenase: a moonlighting protein involved in early chloroplast development through its interaction with an FtsH12-FtsHi protease complex. Plant Cell, 2018, 30: 1745-69. DOI:10.1105/tpc.18.00121 |
| [43] |
Flügge UI, Häusler RE, Ludewig F, et al. Functional genomics of phosphate antiport systems of plastids. Physiologia Plantarum, 2003, 118: 475-82. DOI:10.1034/j.1399-3054.2003.00137.x |
| [44] |
Lee Y, Nishizawa T, Takemoto M, et al. Structure of the triose-phosphate/phosphate translocator reveals the basis of substrate specificity. Nat Plants, 2017, 3: 825-32. DOI:10.1038/s41477-017-0022-8 |
| [45] |
Flügge UI, Fischer K, Gross A, et al. The triose phosphate-3-phosphoglycerate-phosphate translocator from spinach chloroplasts: nucleotide sequence of a full-length cDNA clone and import of the in vitro synthesized precursor protein into chloroplasts. EMBO J, 1989, 8: 39-46. DOI:10.1002/j.1460-2075.1989.tb03346.x |
| [46] |
Kammerer B, Fischer K, Hilpert B, et al. Molecular characterization of a carbon transporter in plastids from heterotrophic tissues: the glucose 6-phosphate/phosphate antiporter. Plant Cell, 1998, 10: 105-17. DOI:10.1105/tpc.10.1.105 |
| [47] |
Eicks M, Maurino V, Knappe S, et al. The plastidic pentose phosphate translocator represents a link between the cytosolic and the plastidic pentose phosphate pathways in plants. Plant Physiol, 2002, 128: 512-22. DOI:10.1104/pp.010576 |
| [48] |
Prabhakar V, Löttgert T, Geimer S, et al. Phosphoenolpyruvate provision to plastids is essential for gametophyte and sporophyte development in Arabidopsis thaliana. Plant Cell, 2010, 22: 2594-617. DOI:10.1105/tpc.109.073171 |
| [49] |
Häusler RE, Baur B, Scharte J, et al. Plastidic metabolite transporters and their physiological functions in the inducible crassulacean acid metabolism plant Mesembryanthemum crystallinum. Plant J, 2000, 24: 285-96. DOI:10.1046/j.1365-313x.2000.00876.x |
| [50] |
Niittylä T, Messerli G, Trevisan M, et al. A previously unknown maltose transporter essential for starch degradation in leaves. Science, 2004, 303: 87-9. DOI:10.1126/science.1091811 |
| [51] |
Riesmeier JW, Flügge UI, Schulz B, et al. Antisense repression of the chloroplast triose phosphate translocator affects carbon partitioning in transgenic potato plants. Proc Natl Acad Sci U S A, 1993, 90: 6160-4. DOI:10.1073/pnas.90.13.6160 |
| [52] |
Häusler RE, Schlieben NH, Schulz B, et al. Compensation of decreased triose phosphate/phosphate translocator activity by accelerated starch turnover and glucose transport in transgenic tobacco. Planta, 1998, 204: 366-76. DOI:10.1007/s004250050268 |
| [53] |
Schneider A, Häusler RE, Kolukisaoglu U, et al. An Arabidopsis thaliana knock-out mutant of the chloroplast triose phosphate/phosphate translocator is severely compromised only when starch synthesis, but not starch mobilisation is abolished. Plant J, 2002, 32: 685-99. DOI:10.1046/j.1365-313X.2002.01460.x |
| [54] |
Walters RG, Ibrahim DG, Horton P, et al. A mutant of Arabidopsis lacking the triose-phosphate/phosphate translocator reveals metabolic regulation of starch breakdown in the light. Plant Physiol, 2004, 135: 891-906. DOI:10.1104/pp.104.040469 |
| [55] |
Hilgers EJA, Staehr P, Flügge UI, et al. The xylulose 5-phosphate/phosphate translocator supports triose phosphate, but not phosphoenolpyruvate transport across the inner envelope membrane of plastids in Arabidopsis thaliana mutant plants. Front Plant Sci, 2018, 9: 1461. DOI:10.3389/fpls.2018.01461 |
| [56] |
Huang W, Krishnan A, Plett A, et al. Chlamydomonas mutants lacking chloroplast TRIOSE PHOSPHATE TRANSPORTER3 are metabolically compromised and light sensitive. Plant Cell, 2023, 35: 2592-614. DOI:10.1093/plcell/koad095 |
 2024, Vol. 36
2024, Vol. 36 

 黄伟超,中国科学院水生生物研究所研究员,德国康斯坦茨大学博士,斯坦福大学卡内基研究所博士后,曾任法国应用科学院工程师。长期致力于藻类光合机理以及高附加值化合物分子合成机制的研究。以淡水绿藻莱茵衣藻(Chlamydomonas reinhardtii)和海洋硅藻三角褐指藻(Phaeodactylum tricornutum) 作为研究对象,发现了位于莱茵衣藻叶绿体内膜上光合产物输出的关键通道,阐明了衣藻与陆生植物叶绿体碳转运体系的不同,揭示了三角褐指金藻昆布多糖(β-1, 3-葡聚糖)分子合成路径,明确了叶绿体与线粒体的能量流偶联维持衣藻高效光合。研究成果以第一或通讯作者发表在PNAS、Plant Cell、JBC等国际学术期刊
黄伟超,中国科学院水生生物研究所研究员,德国康斯坦茨大学博士,斯坦福大学卡内基研究所博士后,曾任法国应用科学院工程师。长期致力于藻类光合机理以及高附加值化合物分子合成机制的研究。以淡水绿藻莱茵衣藻(Chlamydomonas reinhardtii)和海洋硅藻三角褐指藻(Phaeodactylum tricornutum) 作为研究对象,发现了位于莱茵衣藻叶绿体内膜上光合产物输出的关键通道,阐明了衣藻与陆生植物叶绿体碳转运体系的不同,揭示了三角褐指金藻昆布多糖(β-1, 3-葡聚糖)分子合成路径,明确了叶绿体与线粒体的能量流偶联维持衣藻高效光合。研究成果以第一或通讯作者发表在PNAS、Plant Cell、JBC等国际学术期刊