(2 中国科学院分子植物科学卓越创新中心,上海 200032)
(2 Center for Excellence in Molecular Plant Sciences, Chinese Academy of Sciences, Shanghai, 200032, China)
高等植物通过光合作用从环境中获取能量,光合作用的基础是光能的吸收和传递。类囊体膜上的叶绿素(chlorophyll, Chl)吸收光能后的能量去向主要有两种:低光强时,大部分吸收的光能被传递至反应中心用于进行光化学反应;高光强时,为了避免过剩激发能量对反应中心造成损伤,植物吸收光能的80%会以热耗散的方式释放到环境中。这种以热的形式将多余的叶绿素激发能量耗散的方式被称为非光化学猝灭(non-photochemical quenching, NPQ)[1-5]。NPQ作为高等植物在分子水平上对光强变化的响应,在高光强时避免光损伤和低光强时高效捕光都十分重要。NPQ根据响应时间和弛豫方式的不同又分为能量依赖猝灭(energy-dependent quenching, qE)、玉米黄质依赖猝灭(zeaxanthin-dependent quenching, qZ)、持续荧光猝灭(sustained fluorescence quenching, qH)和光抑制猝灭(photo-inhibitory quenching, qI)[6]。其中响应最快的是一种由类囊体膜两侧的质子梯度触发的能量依赖猝灭qE[6-7],该过程发生在光强增加后的数秒内[7],光强减弱后需要1~2 min才能重新转换到高效捕光状态[8]。qE在NPQ中占据主导地位,也是研究的重点,后文中的NPQ指的都是qE。
在自然环境中,由于风引起的叶片运动,植物冠层的光环境时刻受到波动光的影响。植物从光保护态恢复至高效捕光态的过程较慢,在几分钟量级,而光强变化往往在秒的量级。植物在这两种状态间的切换相较于光强变化的滞后,会导致光合效率的损失。2004年,朱新广等[9]研究了正常冠层在动态变化的光辐照强度中从光保护态到高效捕光态间切换的时间滞后效应,结果表明,如果植物在光保护态到捕光态间的切换速率和太阳光辐照强度的瞬时变化相匹配,光合效率(CO2转化率)可以提高17%~32%。肖怡等[10]研究发现,在植物叶片中由于聚光效应、光散射效应及光导引效应,叶片内部的光环境存在极大的异质性。由于聚光效应,单个叶绿体受到的光强可能是入射到叶片表面光强的5倍以上。因此,叶片处于波动光强时,轻微的位置波动就会导致内部光环境的剧烈改变。这意味着叶绿体内部的光系统处于一个高频变化的动态光强环境中,因此NPQ适应动态光的速度或能力是控制植物光能利用效率的关键因素之一[10]。在中国大部分地区,中午太阳光强可以达到1 500~2 000 µmol·m-2·s-1,而C3植物的饱和光强一般在400~500 µmol·m-2·s-1左右,超过饱和光强的光能主要以热能的形式被猝灭。NPQ代表着植物中除了光反应以外最大的能量消耗,而低光下被NPQ耗散的光能小于5%[11]。优化NPQ调控过程,在高光下进行快速能量耗散实现光保护,而在低光下保持低水平的NPQ是当前提高光合效率的最重要途径之一[12-13]。
1 PsbS和叶黄素循环对NPQ水平的影响NPQ的形成和恢复速率主要由蛋白质PsbS (photosystem Ⅱ subunit S)以及叶黄素循环调控[14-20]。PsbS是类囊体膜上以二聚体形式存在,分子量约44 kDa的膜蛋白,它的存在可以增强NPQ水平[21]。并且在缺少PsbS的突变体中NPQ也能发生[22],因此PsbS并不是直接的猝灭位点而是一种促进NPQ发生的催化剂。PsbS的晶体结构进一步证实了它并不是猝灭位点,因为它并不结合色素。PsbS通过单体间的疏水相互作用形成同源二聚体,其单体的二级结构和LHCⅡ的单体具有同源性,但PsbS总共有四段跨膜螺旋[23]。PsbS在类囊体膜上囊腔侧的两个酸性氨基酸谷氨酸比LHCⅡ中对应的酸性氨基酸具有更高的酸感知灵敏度[24-25](图 1),因此当环境pH变化时,PsbS可以更早被触发使LHCⅡ聚集更快达到NPQ状态[26-27]。此外,免疫沉淀反应显示PsbS在高光条件或有质子浓度差时会和LHCⅡ相互作用[16-17, 28]。有研究者认为PsbS在暗适应条件下以二聚体形式和PSⅡ紧密结合,光照下会单体化,并且朝向捕光天线蛋白移动,进而与其发生相互作用(图 1)[29]。
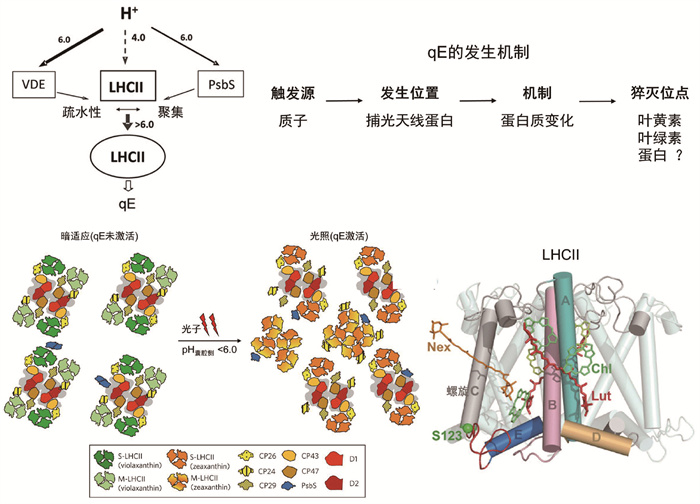
|
图 1 NPQ的发生机制和LHCⅡ的蛋白结构 |
叶黄素循环是指高等植物中的紫黄质(violaxanthin, Vio) 和玉米黄质(zeaxanthin, Zea)互相转换的过程[30],Vio在强光下通过紫黄质脱环氧化酶(violaxanthin de-epoxidase, VDE)催化经中间产物氧玉米黄质(antheraxanthin, Ant)形成Zea,而Zea弱光下通过玉米黄质环氧化酶(zeaxanthin epoxidase, ZEP)的作用形成Vio。Demmig等[31]最早发现Vio在有质子浓度梯度存在时向Zea的转换会增强NPQ作用,认为Zea可能是直接的能量受体达到猝灭能量的作用[32]。但是,后续在缺少Zea的突变体中的实验结果显示,当囊腔一侧pH低于5.5时NPQ仍然能发生[33]。因此,Zea更像是起到调控作用,它相比Vio具有更高的疏水性,能够增加膜的刚性和促进LHCⅡ的聚集[34-36],从而增强NPQ作用[37]。总的来说,PsbS和Zea加快NPQ的形成过程,而紫黄质Vio则加快从NPQ状态到捕光状态的恢复过程[38]。2016年和2022年,Long研究团队[39-40]通过生物基因工程,过量表达PsbS、VDE和ZEP,获得了在捕光态和光保护态间切换速度加快的突变株。在室外自然光辐照下先后将烟草的干物质产量和大豆的种子产量提高了15%和33%。因此,研究NPQ发生的分子机制,可以为植物生物学家通过基因改造调控NPQ水平,从而提高作物产量提供新思路。
2012年,Ruban等[24]提出NPQ由四个关键因素组成,即触发条件、猝灭位点、猝灭机制和作用对象(图 1)。NPQ是由质子梯度ΔpH触发的,但是NPQ形成和恢复慢于质子梯度的形成,这两者之间形成的动力学的不一致说明在质子梯度存在时PSⅡ中蛋白发生某种构象变化才能达到光保护状态。NPQ主要发生在光系统Ⅱ中的主要捕光天线蛋白LHCⅡ中而不是在反应中心(reaction center, RC)[41-43]。光系统Ⅱ中的小天线蛋白(minor light-harvesting complex) CP24、CP26、CP29也会发生NPQ,不过LHCⅡ占据了PSⅡ上约65%的Chl [44],承担着主要的捕光和能量耗散的功能,对LHCⅡ中NPQ发生机制的研究尤为重要。2004年,中国科学家解析出的LHCⅡ 2.72 Å分辨率的晶体结构(PDB ID:1RWT)[45]显示,其由三聚体组成,每个单体由三段主跨膜螺旋A、B、C,类囊体囊腔侧的两亲性螺旋D和短310螺旋E组成(图 1)。每个单体包含8个叶绿素a (Chla)、6个叶绿素b (Chlb)和4个类胡萝卜素,这4个类胡萝卜素包括2个叶黄素(lutein, Lut1和Lut2)、1个新黄质(neoxanthin, Nex)和1个紫黄质(Vio)。
LHCⅡ通过发生某种可逆的构象变化在未猝灭态和猝灭态之间转换[46-48]。分子动力学模拟结果显示,LHCⅡ在捕光状态和光保护状态间的转换(后文中简称为两态转换)伴随着helix D螺旋向疏水区域的运动和特定色素对耦合强度的增加[49-51]。此外,超快光谱[52-54]和分子动力学模拟[55]的结果都表明Chl612的最低激发态向Lut1的S1激发态的激发态能量传递是LHCⅡ中一种主要的能量猝灭方式。但是,LHCⅡ蛋白质骨架如何响应外界环境变化带动局部色素相互作用改变,从而发生两态转换一直没有定论,这是研究者们一直关注的重点。调控NPQ水平的前提是对其响应机制的透彻理解,下面介绍的两部分内容正是基于红外光谱、分子动力学模拟和冷冻电镜等研究手段对LHCⅡ蛋白质变构调控两态转换分子机制的研究。
2 温度调控下LHCⅡ的蛋白质变构调节机制环境酸度或温度的变化都会导致LHCⅡ发生两态转换,LHCⅡ中的Chl会将多余的激发态能量传递给邻近的Lut,后者以热的形式释放到环境中实现能量猝灭[52-53, 56]。相关拉曼光谱研究表明,NPQ状态的形成伴随着LHCⅡ内Nex和Luts构象的变化[54, 57]。核磁共振(NMR)的结果进一步证实,当聚集态的LHCⅡ处于NPQ状态时,膜脂两侧的螺旋与loop结构都会发生重构[58],但LHCⅡ蛋白骨架构象如何响应光强变化导致色素分子相互靠近实现状态转化的分子机制还不清楚。2020年,Science China Chemistry报告了中国科学院物理研究所翁羽翔团队和深圳湾实验室高加力团队[59]应用脉冲升温时间分辨红外光谱和分子动力学模拟揭示LHCⅡ实现高效捕光和光保护功能可逆切换的机制。
该研究团队通过不同温度、酸度和聚集程度下LHCⅡ的瞬态荧光光谱实验,发现温度的升高、聚集程度的增加都能导致显著的荧光猝灭。对荧光寿命拟合分析,发现LHCⅡ存在长寿命的捕光构象(light harvesting, H)、短寿命的能量猝灭构象(quenching, Q),以及在较高温度下存在的变性蛋白构象(denatured, D)。并且猝灭构象Q的含量随温度升高而增加,在55 ℃左右达到最大值。此外,热稳定分析结果显示LHCⅡ在55 ℃以下的结构变化几乎是完全可逆的。应用自主研发的高精度脉冲升温-纳秒时间分辨中红外光谱仪(T-jump)[60]结合变温傅里叶变换红外光谱(FTIR),进一步研究了LHCⅡ在热胁迫下发生的结构变化。T-jump实验是通过脉宽50 ns,中心波长为2.1 μm的近红外脉冲光,使样品溶剂重水的温度在几十纳秒内升高。同时使用CO激光器作为探测光源记录酰胺Ⅰ带的瞬态差谱,探测光分辨率可达4 cm-1,光谱分辨率可达到1 × 10-4 OD (optical density)。T-jump和FTIR实验结果表明温度升高与酸度增加都会促使囊腔一侧处于松弛状态的310螺旋E向结构更紧凑的α-螺旋转变(图 2),热胁迫下310螺旋E向α-螺旋转变的时间约1 μs,新生成的α-螺旋E向疏水内核插入(插膜运动)的时间约1.24 μs。
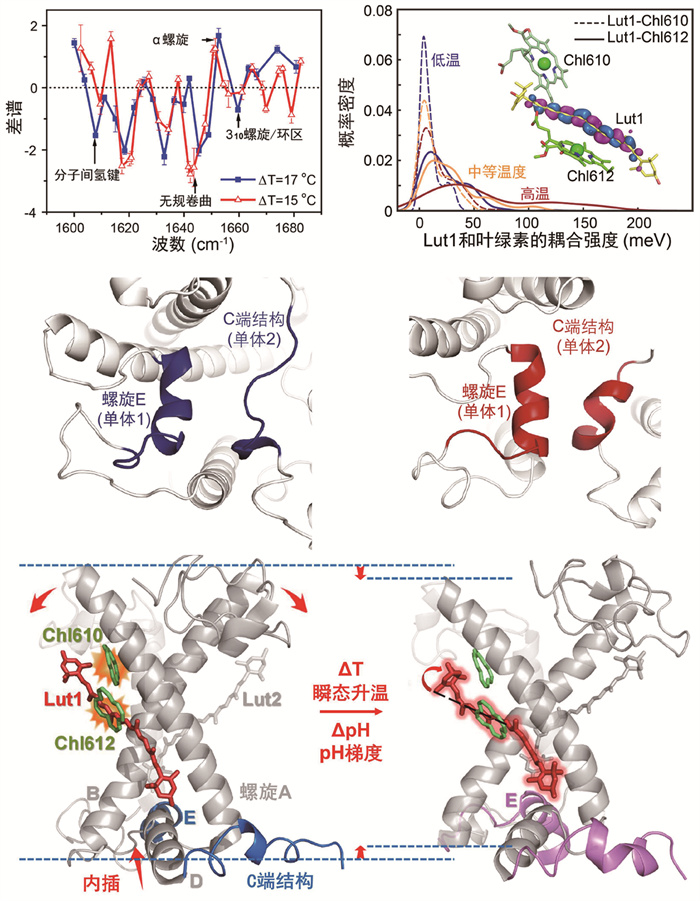
|
图 2 LHCⅡ的T-jump瞬态光谱和分子动力学模拟结果 |
该研究团队还通过全原子分子动力学模拟计算了不同温度、酸度下LHCⅡ的结构状态。模拟结果显示,在升温过程中蛋白质部分结构单元会发生失水,导致结构单元间的疏水作用增强,引起310螺旋E和C端的无规卷曲结构协同转变为α-螺旋(图 2),并引起α-螺旋E和D向疏水核内核插入,从而在原子尺度上阐释了T-jump中观察到的蛋白质二级结构变化。此外,α-螺旋E和D的插膜运动引起的变构效应会驱动交叉排列的跨膜螺旋对A和B以交叉点处的盐桥(Arg70-Glu180、Glu65-Arg185)为铰点发生剪切运动。蛋白质的交叉运动会带动螺旋两侧的一对叶黄素Lut1和Lut2做相应的交叉运动,从而缩短了Lut分子和相邻Chl分子的距离。进一步通过量子化学计算,发现Lut的暗态(S1态)和Chla激发态的电子耦合强度在一定温度范围内也随温度升高而增强(图 2),并且Lut1和Chla612间的耦合强度远大于Lut1和Chla610间的,因此,通过计算不同色素对间的耦合强度,确定了Lut1和Chla612色素对是主要的能量猝灭位点。
2003年,Horton团队[61]在缺乏准确结构信息的时候提出两个Lut分子的剪切运动参与了LHCⅡ在捕光态和NPQ态间的切换,但由于缺乏高分辨率的蛋白结构信息,当时仅限于色素水平的研究。随后2013年Pandit等[58]补充了关于囊腔一侧蛋白构象的内容,认为LHCⅡ状态的转换涉及囊腔一侧结构变化引起的色素激活过程,但是仍未解释蛋白局部构象如何变化从而影响色素构象。2020年,翁羽翔团队通过纳秒时间分辨红外光谱和理论计算提出LHCⅡ的构象变化调控两态转换模型(图 2):热诱导引发的蛋白囊腔一侧的局部结构的变化会导致跨膜螺旋A、B发生剪切运动,然后由蛋白质结构带动色素变化从而改变特定叶黄素和叶绿素之间的距离和耦合强度,使叶绿素的激发态能量可以快速地转移到叶黄素的暗态,再由后者完成能量的耗散。
3 酸度调控LHCⅡ发生两态转换的分子机制光谱和分子动力学模拟结合给出了LHCⅡ在捕光态和光保护态间的动态变构调节机制[59],但是当时还没有相应的结构信息给出不同状态LHCⅡ的构象差异。毕竟眼见为实,处于捕光态和光保护态的LHCⅡ结构能够更直观和令人信服地揭示LHCⅡ通过怎样的构象变化实现功能转换。处于捕光状态LHCⅡ的荧光寿命在4 ns[62-64]左右,而猝灭态LHCⅡ的寿命会缩短至0.1~0.6 ns[65-66]。柳振峰等国内外研究团队[45, 67-68]从2004年起先后从不同高等植物菠菜、豌豆和黄瓜中解析出了LHCⅡ的晶体结构,LHCⅡ晶体由于结晶后的紧密堆积作用荧光寿命会衰减至1 ns左右[55, 69-71],晶体结构无疑对应的是猝灭态LHCⅡ的构象。而冷冻电子显微镜技术(cryo-EM)可以解析溶液状下LHCⅡ的结构,因为这种技术是直接将溶液状态的样品快速冷冻成薄薄一层玻璃态冰,能够在保持样品原本的特征的条件下解析其结构。得益于冷冻电子显微镜技术的快速发展,现在已经可以在原子水平上解析蛋白质结构[72]。2023年,Nature Plants报告了中国科学院物理研究所翁羽翔、丁玮团队和深圳湾实验室高加力团队通过冷冻电子显微镜技术与多态密度泛函理论计算,在原子分子水平上揭示了高等植物捕光天线蛋白LHCⅡ在高效捕光和光保护态之间的切换机制[73]。
调控去垢剂浓度和pH值可以获得捕光态或光保护态的LHCⅡ,瞬态荧光和稳态荧光光谱表明,室温条件下LHCⅡ只有在聚集条件下才会发生荧光猝灭,酸度的增加只在LHCⅡ聚集时才会诱导额外的荧光猝灭。然而,聚集态LHCⅡ不是单颗粒分布,也就无法重构出高分辨率结构。为了解决LHCⅡ在去垢剂溶液中发生荧光猝灭(聚集态)和样品单颗粒分布不可兼得的矛盾,将LHCⅡ组装到纳米膜盘(nanodsic)中,得到LHCⅡ纳米膜盘复合体样品。纳米膜盘由两亲性的膜支架蛋白将一圈双层磷脂包裹形成。聚集态环境给LHCⅡ提供了侧向压力使其结构更加紧凑,有利于与蛋白质构象和主要荧光猝灭色素对间的距离发生协同变化。而纳米膜盘产生的膜压也同样给LHCⅡ提供了一定的侧向压力,因此在保持单颗粒分布的条件下实现了荧光猝灭[52, 74]。瞬态荧光光谱结果表明,中性、酸性条件下的LHCⅡ纳米膜盘复合体相比于溶液中非聚集态LHCⅡ分别有22%、30%的荧光猝灭。
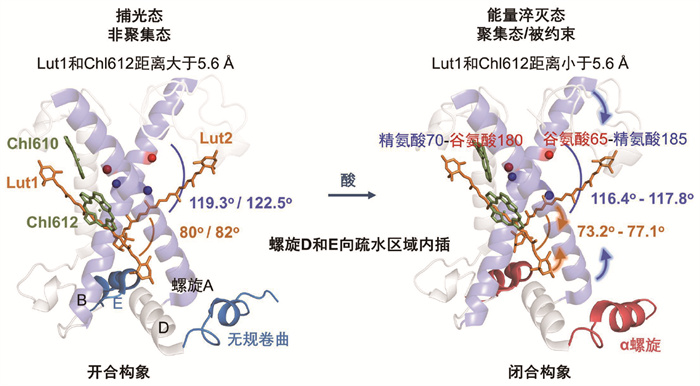
解析中性(pH 7.8)和酸性(pH 5.4)条件下LHCⅡ纳米膜盘复合体和去垢剂溶液中LHCⅡ冷冻电镜结构,得到总共6个高分辨率的LHCⅡ构象(图 3)。在酸性条件下,LHCⅡ纳米膜盘复合体和溶液中LHCⅡ的电镜二维颗粒都能分成两类,这两类颗粒能重构出两种不同的构象。根据LHCⅡ第54位的天冬氨酸和第207位的谷氨酸是否被质子化(图 4),LHCⅡ纳米膜盘复合体和溶液中LHCⅡ都可以分为中性条件下的未质子化结构以及酸性条件下的未质子化和质子化结构。不同的是,质子化构象颗粒的占比从溶液中LHCⅡ的42%增加到LHCⅡ纳米膜盘复合体中的71%,这和LHCⅡ纳米膜盘复合体中更疏水的环境促使酸性氨基酸的pKa值增加更容易被质子化有关[24, 49]。比较发现,所有的未质子化结构具有相同的二级结构,这些结构都对应处于捕光状态LHCⅡ的构象。而酸性条件下的质子化结构相比于非质子化结构,囊腔一侧的310螺旋E转变成了α螺旋E,同时C端的无规卷曲结构转变为短α螺旋(图 4)。有研究结果表明Nex的扭曲状态可以一定程度反映LHCⅡ的猝灭状态[54-55, 71],冷冻电镜结构表明不同构象LHCⅡ中的Nex基本都和晶体结构中一样有一定扭转,并且与LHCⅡ纳米膜盘复合体的质子化构象中Nex的端环相比,未质子化构象有很明显的扭转(图 4)。
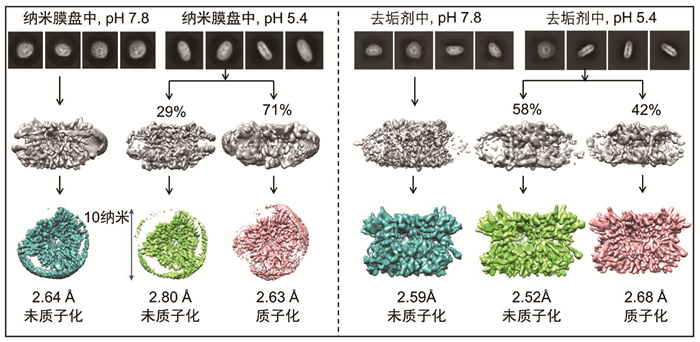
|
图 3 LHCⅡ纳米膜盘复合体和溶液中LHCⅡ在中性和酸性条件下的六个冷冻电镜结构 |
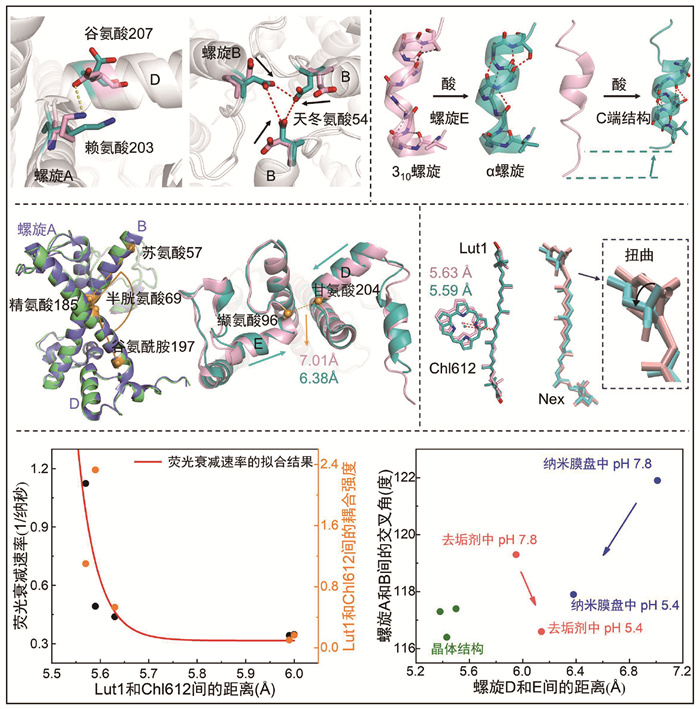
|
图 4 不同构象LHCⅡ中二级结构比较和结构参数间的关系 |
LHCⅡ纳米膜盘复合体中主跨膜螺旋A和B间的夹角从中性条件未质子化构象中的121.9°到质子化构象中减小到了117.9°,而溶液中相应的LHCⅡ中从119.3°减小到了116.6°。也就是说,酸会诱导主跨膜螺旋发生剪切运动。另外,对已有的三种晶体结构和解析出的冷冻电镜结构分析发现,主跨膜螺旋A和B间的夹角变化与两侧的一对叶黄素Lut1和Lut2的夹角的变化呈线性相关。即主跨膜螺旋A和B的剪切运动会带动两侧的Lut1和Lut2色素对发生等幅度的交叉运动,这种蛋白质带动色素构象的运动必定会导致其中色素间距离和耦合强度的变化。比较不同构象中Lut1和Chl612色素间的距离发现,3个LHCⅡ晶体结构中的Lut1和Chl612间的距离最短,分别为5.54 Å、5.43 Å、5.60 Å。而在电镜结构中,去垢剂溶液中LHCⅡ的色素距离酸化后没有变化,分别为5.99 Å和6.0 Å,这和加酸调控后没有荧光猝灭是一致的。另外,在中性条件下,LHCⅡ纳米膜盘复合体中Lut1-Chl612距离减小至5.63 Å,并且酸化后距离进一步减小至5.59 Å。这些结果表明,Lut1-Chl612距离显然还与别的结构因素相关,因为蛋白质和色素的这种剪切运动并不一定导致其距离减小。
比较发现,囊腔一侧的两个短螺旋E和D间的距离在不同状态LHCⅡ中也有差异,晶体结构对应的完全猝灭态中螺旋D和E向蛋白中心疏水区域内插(插膜运动)使得距离最短。LHCⅡ纳米膜盘复合体中螺旋D和E的距离从中性条件未质子化构象中的7.01 Å减小到质子化构象中的6.38 Å,酸诱导螺旋D和E发生内插运动。然而,去垢剂溶液中的LHCⅡ在酸诱导下螺旋D和E间距离反而增加了。因此,螺旋E和D是否往疏水中心内插是LHCⅡ发生荧光猝灭的关键。也就是说,只有当LHCⅡ被约束在纳米膜盘中受到侧向压力时,酸度增加导致的二级结构的变化才能引起螺旋D和E的插膜运动,导致Lut1和Chl612间的距离变短。
为了定量解释LHCⅡ的荧光衰减速率和Lut1-Chl612距离的关系,通过多态密度泛函理论计算了Lut1的S1激发态和Chl612的Qy态的耦合强度。不同条件下实验测得的LHCⅡ的荧光衰减速率和理论计算的Lut1-Chl612耦合强度的变化趋势高度符合(图 4),并且它们相对于Lut1-Chl612距离的关系可以用一个Dexter模型拟合。拟合的结果给出一个临界距离值5.6 Å,大于5.6 Å时Lut1和Chl612通过偶极-偶极相互作用的Förster经典传能共同捕光传能,此时LHCⅡ处于高效捕光状态。小于5.6 Å时Lut1和Chl612通过波函数重叠导致的电子交换的Dexter传能实现Chl的荧光猝灭。而在5.6 Å附近微小的距离变化(0.02 Å)就足以使LHCⅡ从捕光状态转换为能量猝灭态,可见LHCⅡ通过蛋白质动态结构的变化实现Förster和Dexter传能模式间的可逆切换。
基于冷冻电镜实验结果和多态密度泛函理论计算,可以提出LHCⅡ构象变化驱使状态切换的分子机制(图 5),其中的要点可以总结为:(1)提出约束或聚集对LHCⅡ造成的侧向压力是发生荧光猝灭实现光保护的先决条件;(2)通过cryo-EM结构确切地观察到了LHCⅡ在酸诱导下的二级结构变化,囊腔一侧的310螺旋E转变成了α螺旋,同时C端的无规卷曲结构转变为短α螺旋,并且只有在约束或聚集条件下,这样的构象变化才能增强荧光猝灭效应;(3)确认LHCⅡ中的Lut1-Chl612色素对为主要猝灭位点,并且通过实验和理论计算给出了一个临界距离5.6 Å,在该临界值附近微小的距离变化就足以使LHCⅡ从捕光状态转变到猝灭态。文章上线后,Ruban教授为此在Science China Chemistry期刊上发表了评论文章[75],称这个工作具有突破性的启示(ground-breaking revelation),在解开NPQ发生机制的漫长之旅中取得了重大突破,同时他也非常期待这个团队在揭示Zea和PsbS调控LHCⅡ两态转换作用机制上的研究进展。
|
图 5 调控LHCⅡ发生两态转换的主要结构因素 |
高等植物的光合效率还有很大的提升空间,光保护状态到高效捕光状态的切换和太阳光辐照强度的涨落变化相匹配是当前提高光合效率的新途径。尽管目前通过过表达PsbS、VDE和ZEP等三个调控NPQ过程的主要组分,在烟草和大豆中实现了生物量及产量的提高[39-40]。而在拟南芥、土豆等植物中,虽然过表达PsbS、VDE及ZEP也实现了NPQ的快速诱导和恢复,但并没有提高光合作用效率和生物量[76-77]。这表明,要调控NPQ实现光能利用效率的提升,一方面需要加速高光下的NPQ诱导及低光下的NPQ恢复,另一方面需要有效地将NPQ动态调控与光合作用具体改造联系起来。发展一个通用的基于NPQ动态调控改良光能利用效率的分子策略是当前光合作用研究领域最大的科学问题之一。在这个研究方面,以下问题是关键科学问题。第一,需要继续研究NPQ发生的分子机制,尤其是阐明PsbS、叶黄素循环和膜脂组分等因素调控NPQ过程的机制。第二,鉴于光合作用是经过亿万年的进化而形成,其内部的CO2输运、CO2同化及光反应过程之间存在精密的协同运转。如果对NPQ过程进行大幅度优化,必定会对已有的光合作用运行起到重大干扰。这些干扰是否对光合效率的优化有限制作用,以及如何克服这些限制作用,也将成为这个领域发展的关键问题。第三,如何将NPQ动态调控的改良有效转变为光能利用效率的提升进而实现生物量的提升。鉴于叶黄素循环的中间产物环氧玉米黄素与脱落酸(abscisic acid, ABA)的合成共用相同的前体[78],NPQ的改造极有可能会改变ABA代谢及信号,进而影响植物生长与发育。因此,NPQ的动态调控改造可能需要同时协同ABA的相关信号,从而实现光能利用效率的有效提升。
| [1] |
Ruban AV, Wilson S. The mechanism of non-photochemical quenching in plants: localization and driving forces. Plant Cell Physiol, 2021, 62: 1063-72. DOI:10.1093/pcp/pcaa155 |
| [2] |
Ruban AV. Light harvesting control in plants. FEBS Lett, 2018, 592: 3030-9. DOI:10.1002/1873-3468.13111 |
| [3] |
Murchie EH, Niyogi KK. Manipulation of photoprotection to improve plant photosynthesis. Plant Physiol, 2011, 155: 86-92. DOI:10.1104/pp.110.168831 |
| [4] |
Li XP, Gilmore AM, Caffarri S, et al. Regulation of photosynthetic light harvesting involves intrathylakoid lumen pH sensing by the PsbS protein. J Biol Chem, 2004, 279: 22866-74. DOI:10.1074/jbc.M402461200 |
| [5] |
Horton P, Ruban AV, Walters RG. Regulation of light harvesting in green algae. Annu Rev Plant Physiol Plant Mol Biol, 1996, 47: 655-84. DOI:10.1146/annurev.arplant.47.1.655 |
| [6] |
Pinnola A, Bassi R. Molecular mechanisms involved in plant photoprotection. Biochem Soc Trans, 2018, 46: 467-82. DOI:10.1042/BST20170307 |
| [7] |
Niyogi KK. Safety valves for photosynthesis. Curr Opin Plant Biol, 2000, 3: 455-60. DOI:10.1016/S1369-5266(00)00113-8 |
| [8] |
Demmig Adams B, Gilmore AM, Adams WW. Carotenoids.3: in vivo functions of carotenoids in higher plants. FASEB J, 1996, 10: 403-12. DOI:10.1096/fasebj.10.4.8647339 |
| [9] |
Zhu XG, Ort DR, Whitmarsh J, et al. The slow reversibility of photosystem Ⅱ thermal energy dissipation on transfer from high to low light may cause large losses in carbon gain by crop canopies: a theoretical analysis. J Exp Bot, 2004, 55: 1167-75. DOI:10.1093/jxb/erh141 |
| [10] |
Xiao Y, Tholen D, Zhu XG. The influence of leaf anatomy on the internal light environment and photosynthetic electron transport rate: exploration with a new leaf ray tracing model. J Exp Bot, 2016, 67: 6021-35. DOI:10.1093/jxb/erw359 |
| [11] |
Zhu XG, Long SP, Ort DR. What is the maximum efficiency with which photosynthesis can convert solar energy into biomass?. Curr Opin Biotechnol, 2008, 19: 153-9. DOI:10.1016/j.copbio.2008.02.004 |
| [12] |
Zhu XG, Ort DR, Parry M, et al. A wish list for synthetic biology in photosynthesis research. J Exp Bot, 2020, 71: 2219-25. DOI:10.1093/jxb/eraa075 |
| [13] |
Zhu XG, Long SP, Ort DR. Improving photosynthetic efficiency for greater yield. Ann Rev Plant Biol, 2010, 61: 235-61. DOI:10.1146/annurev-arplant-042809-112206 |
| [14] |
Nicol L, Croce R. The PsbS protein and low pH are necessary and sufficient to induce quenching in the light-harvesting complex of plants LHCⅡ. Sci Rep, 2021, 11: 7415. DOI:10.1038/s41598-021-86975-9 |
| [15] |
Goral TK, Johnson MP, Duffy CDP, et al. Light-harvesting antenna composition controls the macrostructure and dynamics of thylakoid membranes in Arabidopsis. Plant J, 2012, 69: 289-301. DOI:10.1111/j.1365-313X.2011.04790.x |
| [16] |
Sacharz J, Giovagnetti V, Ungerer P, et al. The xanthophyll cycle affects reversible interactions between PsbS and light-harvesting complex Ⅱ to control non-photochemical quenching. Nat Plant, 2017, 3: 16225. DOI:10.1038/nplants.2016.225 |
| [17] |
Correa-Galvis V, Poschmann G, Melzer M, et al. PsbS interactions involved in the activation of energy dissipation in Arabidopsis. Nat Plant, 2016, 2: 15225. DOI:10.1038/nplants.2015.225 |
| [18] |
Kiss AZ, Ruban AV, Horton P. The PsbS protein controls the organization of the photosystem Ⅱ antenna in higher plant thylakoid membranes. J Biol Chem, 2008, 283: 3972-8. DOI:10.1074/jbc.M707410200 |
| [19] |
Welc R, Luchowski R, Kluczyk D, et al. Mechanisms shaping the synergism of zeaxanthin and PsbS in photoprotective energy dissipation in the photosynthetic apparatus of plants. Plant J, 2021, 107: 418-33. DOI:10.1111/tpj.15297 |
| [20] |
Petrou K, Belgio E, Ruban AV. pH sensitivity of chlorophyll fluorescence quenching is determined by the detergent/protein ratio and the state of LHCⅡ aggregation. Biochim Biophys Acta, 2014, 1837: 1533-9. DOI:10.1016/j.bbabio.2013.11.018 |
| [21] |
Crouchman S, Ruban A, Horton P. PsbS enhances nonphotochemical fluorescence quenching in the absence of zeaxanthin. FEBS Lett, 2006, 580: 2053-8. DOI:10.1016/j.febslet.2006.03.005 |
| [22] |
Johnson MP, Ruban AV. Arabidopsis plants lacking PsbS protein possess photoprotective energy dissipation. Plant J, 2010, 61: 283-9. |
| [23] |
Fan M, Li M, Liu Z, et al. Crystal structures of the PsbS protein essential for photoprotection in plants. Nat Struct Mol Biol, 2015, 22: 729-35. DOI:10.1038/nsmb.3068 |
| [24] |
Ruban AV, Johnson MP, Duffy CDP. The photoprotective molecular switch in the photosystem Ⅱ antenna. Biochim Biophys Acta, 2012, 1817: 167-81. DOI:10.1016/j.bbabio.2011.04.007 |
| [25] |
Kramer DM, Sacksteder CA, Cruz JA. How acidic is the lumen?. Photosynth Res, 1999, 60: 151-63. DOI:10.1023/A:1006212014787 |
| [26] |
Bonente G, Howes BD, Caffarri S, et al. Interactions between the photosystem Ⅱ subunit PsbS and xanthophylls studied in vivo and in vitro. J Biol Chem, 2008, 283: 8434-45. DOI:10.1074/jbc.M708291200 |
| [27] |
Dominici P, Caffarri S, Armenante F, et al. Biochemical properties of the PsbS subunit of photosystem Ⅱ either purified from chloroplast or recombinant. J Biol Chem, 2002, 277: 22750-8. DOI:10.1074/jbc.M200604200 |
| [28] |
Teardo E, de laureto PP, Bergantino E, et al. Evidences for interaction of PsbS with photosynthetic complexes in maize thylakoids. Biochim Biophys Acta, 2007, 1767: 703-11. DOI:10.1016/j.bbabio.2006.12.002 |
| [29] |
Bergantino E, Segalla A, Brunetta A, et al. Light- and pH-dependent structural changes in the PsbS subunit of photosystem Ⅱ. Proc Natl Acad Sci U S A, 2003, 100: 15265-70. DOI:10.1073/pnas.2533072100 |
| [30] |
Jahns P, Latowski D, Strzalka K. Mechanism and regulation of the violaxanthin cycle: the role of antenna proteins and membrane lipids. Biochim Biophys Acta Bioenerg, 2009, 1787: 3-14. DOI:10.1016/j.bbabio.2008.09.013 |
| [31] |
Demmig B, Winter K, Kruger A, et al. Photoinhibition and zeaxanthin formation in intact leaves-a possible role of the xanthophyll cycle in the dissipation of excess light energy. Plant Physiol, 1987, 84: 218-24. DOI:10.1104/pp.84.2.218 |
| [32] |
Demmig Adams B. Carotenoids and photoprotection in plants: a role for the xanthophyll zeaxanthin. Biochim Biophys Acta, 1990, 1020: 1-24. DOI:10.1016/0005-2728(90)90088-L |
| [33] |
Noctor G, Rees D, Young A, et al. The relationship between zeaxanthin, energy-dependent quenching of chlorophyll fluorescence, and trans-thylakoid pH gradient in isolated chloroplasts. Biochim Biophys Acta, 1991, 1057: 320-30. DOI:10.1016/S0005-2728(05)80143-4 |
| [34] |
Havaux M. Carotenoids as membrane stabilizers in chloroplasts. Trends Plant Sci, 1998, 3: 147-51. DOI:10.1016/S1360-1385(98)01200-X |
| [35] |
Tardy F, Havaux M. Thylakoid membrane fluidity and thermostability during the operation of the xanthophyll cycle in higher-plant chloroplasts. Biochim Biophys Acta, 1997, 1330: 179-93. DOI:10.1016/S0005-2736(97)00168-5 |
| [36] |
Gruszecki WI, Sielewiesiuk J. Galactolipid multibilayers modified with xanthophylls: orientational and diffractometric studies. Biochim Biophys Acta, 1991, 1069: 21-6. DOI:10.1016/0005-2736(91)90099-T |
| [37] |
Ruban AV. Nonphotochemical chlorophyll fluorescence quenching: mechanism and effectiveness in protecting plants from photodamage. Plant Physiol, 2016, 170: 1903-16. DOI:10.1104/pp.15.01935 |
| [38] |
Murchie EH, Ruban AV. Dynamic non-photochemical quenching in plants: from molecular mechanism to productivity. Plant J, 2020, 101: 885-96. DOI:10.1111/tpj.14601 |
| [39] |
Kromdijk J, Glowacka K, Leonelli L, et al. Improving photosynthesis and crop productivity by accelerating recovery from photoprotection. Science, 2016, 354: 857-61. DOI:10.1126/science.aai8878 |
| [40] |
De Souza AP, Burgess SJ, Doran L, et al. Soybean photosynthesis and crop yield are improved by accelerating recovery from photoprotection. Science, 2022, 377: 851-4. DOI:10.1126/science.adc9831 |
| [41] |
Belgio E, Johnson MP, Juric S, et al. Higher plant photosystem Ⅱ light-harvesting antenna, not the reaction center, determines the excited-state lifetime—both the maximum and the nonphotochemically quenched. Biophys J, 2012, 102: 2761-71. DOI:10.1016/j.bpj.2012.05.004 |
| [42] |
Niyogi KK, Shih C, Chow WS, et al. Photoprotection in a zeaxanthin- and lutein-deficient double mutant of Arabidopsis. Photosynth Res, 2001, 67: 139-45. DOI:10.1023/A:1010661102365 |
| [43] |
Ruban AV, Rees D, Pascal AA, et al. Mechanism of delta pH-dependent dissipation of absorbed excitation-energy by photosynthetic membranes. Ⅱ. The relationship between LHCⅡ aggregation in vitro and qe in isolated thylakoids. Biochim Biophys Acta, 1992, 1102: 39-44. DOI:10.1016/0005-2728(92)90062-7 |
| [44] |
Ruban AV, Young AJ, Pascal AA, et al. The effects of illumination on the xanthophyll composition of the photosystem Ⅱ light-harvesting complexes of spinach thylakoid membranes. Plant Physiol, 1994, 104: 227-34. DOI:10.1104/pp.104.1.227 |
| [45] |
Liu ZF, Yan HC, Wang KB, et al. Crystal structure of spinach major light-harvesting complex at 2.72 angstrom resolution. Nature, 2004, 428: 287-92. DOI:10.1038/nature02373 |
| [46] |
Horton P, Wentworth M, Ruban A. Control of the light harvesting function of chloroplast membranes: the LHCⅡ-aggregation model for non-photochemical quenching. FEBS Lett, 2005, 579: 4201-6. DOI:10.1016/j.febslet.2005.07.003 |
| [47] |
Horton P, Ruban AV, Wentworth M. Allosteric regulation of the light-harvesting system of photosystem Ⅱ. Philos Trans R Soc Lond B Biol Sci, 2000, 355: 1361-70. DOI:10.1098/rstb.2000.0698 |
| [48] |
Bassi R, Caffarri S. Lhc proteins and the regulation of photosynthetic light harvesting function by xanthophylls. Photosynth Res, 2000, 64: 243-56. DOI:10.1023/A:1006409506272 |
| [49] |
Navakoudis E, Stergiannakos T, Daskalakis V. A perspective on the major light-harvesting complex dynamics under the effect of pH, salts, and the photoprotective PsbS protein. Photosynth Res, 2022, 156: 163-77. |
| [50] |
Daskalakis V, Papadatos S, Stergiannakos T. The conformational phase space of the photoprotective switch in the major light harvesting complex Ⅱ. Chem Commun, 2020, 56: 11215-8. DOI:10.1039/D0CC04486E |
| [51] |
Daskalakis V, Maity S, Hart CL, et al. Structural basis for allosteric regulation in the major antenna trimer of photosystem Ⅱ. J Phys Chem B, 2019, 123: 9609-5. DOI:10.1021/acs.jpcb.9b09767 |
| [52] |
Son M, Pinnola A, Gordon SC, et al. Observation of dissipative chlorophyll-to-carotenoid energy transfer in light-harvesting complex Ⅱ in membrane nanodiscs. Nat Commun, 2020, 11: 1295. DOI:10.1038/s41467-020-15074-6 |
| [53] |
Mascoli V, Liguori N, Xu P, et al. Capturing the quenching mechanism of light-harvesting complexes of plants by zooming in on the ensemble. Chem, 2019, 5: 2900-12. DOI:10.1016/j.chempr.2019.08.002 |
| [54] |
Ruban AV, Berera R, Ilioaia C, et al. Identification of a mechanism of photoprotective energy dissipation in higher plants. Nature, 2007, 450: 575-8. DOI:10.1038/nature06262 |
| [55] |
Liguori N, Periole X, Marrink SJ, et al. From light-harvesting to photoprotection: structural basis of the dynamic switch of the major antenna complex of plants (LHCⅡ). Sci Rep, 2015, 5: 15661. DOI:10.1038/srep15661 |
| [56] |
Bode S, Quentmeier CC, Liao PN, et al. On the regulation of photosynthesis by excitonic interactions between carotenoids and chlorophylls. Proc Natl Acad Sci U S A, 2009, 106: 12311-6. DOI:10.1073/pnas.0903536106 |
| [57] |
Ilioaia C, Johnson MP, Liao PN, et al. Photoprotection in plants involves a change in lutein 1 binding domain in the major light-harvesting complex of photosystem Ⅱ. J Biol Chem, 2011, 286: 27247-54. DOI:10.1074/jbc.M111.234617 |
| [58] |
Sunku K, de Groot HJM, Pandit A. Insights into the photoprotective switch of the major light-harvesting complex Ⅱ (LHCⅡ): a preserved core of arginine-glutamate interlocked helices complemented by adjustable loops. J Biol Chem, 2013, 288: 19796-804. DOI:10.1074/jbc.M113.456111 |
| [59] |
Li H, Wang Y, Ye M, et al. Dynamical and allosteric regulation of photoprotection in light harvesting complex Ⅱ. Sci China Chem, 2020, 63: 1121-33. DOI:10.1007/s11426-020-9771-2 |
| [60] |
Li D, Li Y, Li H, et al. A Q-switched Ho: YAG laser assisted nanosecond time-resolved T-jump transient mid-IR absorbance spectroscopy with high sensitivity. Rev Sci Instrum, 2015, 86: 053105. DOI:10.1063/1.4921473 |
| [61] |
Wentworth M, Ruban AV, Horton P. Thermodynamic investigation into the mechanism of the chlorophyll fluorescence quenching in isolated photosystem Ⅱ light-harvesting complexes. J Biol Chem, 2003, 278: 21845-50. DOI:10.1074/jbc.M302586200 |
| [62] |
Huyer J, Eckert HJ, Irrgang KD, et al. Fluorescence decay kinetics of solubilized pigment protein complexes from the distal, proximal, and core antenna of photosystem Ⅱ in the range of 10-277 K and absence or presence of sucrose. J Phys Chem B, 2004, 108: 3326-34. DOI:10.1021/jp030944l |
| [63] |
Palacios MA, de Weerd FL, Ihalainen JA, et al. Superradiance and exciton (de)localization in light-harvesting complex Ⅱ from green plants?. J Phys Chem B, 2002, 106: 5782-7. DOI:10.1021/jp014078t |
| [64] |
Moya I, Silvestri M, Vallon O, et al. Time-resolved fluorescence analysis of the photosystem Ⅱ antenna proteins in detergent micelles and liposomes. Biochemistry, 2001, 40: 12552-61. DOI:10.1021/bi010342x |
| [65] |
Van Oort B, van Hoek A, Ruban AV, et al. Aggregation of Light-Harvesting Complex Ⅱ leads to formation of efficient excitation energy traps in monomeric and trimeric complexes. FEBS Lett, 2007, 581: 3528-32. DOI:10.1016/j.febslet.2007.06.070 |
| [66] |
Vasilev S, Irrgang KD, Schrotter T, et al. Quenching of chlorophyll α fluorescence in the aggregates of LHCⅡ: steady state fluorescence and picosecond relaxation kinetics. Biochemistry, 1997, 36: 7503-12. DOI:10.1021/bi9625253 |
| [67] |
Yan H, Zhang P, Wang C, et al. Two lutein molecules in LHCⅡ have different conformations and functions: insights into the molecular mechanism of thermal dissipation in plants. Biochem Biophys Res Commun, 2007, 355: 457-63. DOI:10.1016/j.bbrc.2007.01.172 |
| [68] |
Standfuss R, van Scheltinga ACT, Lamborghini M, et al. Mechanisms of photoprotection and nonphotochemical quenching in pea light-harvesting complex at 2.5A resolution. EMBO J, 2005, 24: 919-28. DOI:10.1038/sj.emboj.7600585 |
| [69] |
van Oort B, Marechal A, Ruban AV, et al. Different crystal morphologies lead to slightly different conformations of light-harvesting complex Ⅱ as monitored by variations of the intrinsic fluorescence lifetime. Phys Chem Chem Phys, 2011, 13: 12614-22. DOI:10.1039/c1cp20331b |
| [70] |
Barros T, Royant A, Standfuss J, et al. Crystal structure of plant light-harvesting complex shows the active, energy-transmitting state. EMBO J, 2009, 28: 298-306. DOI:10.1038/emboj.2008.276 |
| [71] |
Pascal AA, Liu ZF, Broess K, et al. Molecular basis of photoprotection and control of photosynthetic light-harvesting. Nature, 2005, 436: 134-7. DOI:10.1038/nature03795 |
| [72] |
Merk A, Bartesaghi A, Banerjee S, et al. Breaking cryo-EM resolution barriers to facilitate drug discovery. Cell, 2016, 165: 1698-707. DOI:10.1016/j.cell.2016.05.040 |
| [73] |
Ruan M, Li H, Zhang Y, et al. Cryo-EM structures of LHCⅡ in photo-active and photo-protecting states reveal allosteric regulation of light harvesting and excess energy dissipation. Nat Plant, 2023, 9: 1547-57. DOI:10.1038/s41477-023-01500-2 |
| [74] |
Pandit A, Shirzad-Wasei N, Wlodarczyk LM, et al. Assembly of the major light-harvesting complex Ⅱ in lipid nanodiscs. Biophys J, 2011, 101: 2507-15. DOI:10.1016/j.bpj.2011.09.055 |
| [75] |
Ruban AV. Unveiling the atomic-scale transition between light harvesting and photoprotective states in plant photosynthesis. Sci China Chem, 2023, 67: 1375-7. |
| [76] |
Lehretz GG, Schneider A, Leister D, et al. High non-photochemical quenching of VPZ transgenic potato plants limits CO2 assimilation under high light conditions and reduces tuber yield under fluctuating light. J Integr Plant Biol, 2022, 64: 1821-32. DOI:10.1111/jipb.13320 |
| [77] |
Garcia-Molina A, Leister D. Accelerated relaxation of photoprotection impairs biomass accumulation in Arabidopsis. Nat Plant, 2020, 6: 9-12. DOI:10.1038/s41477-019-0572-z |
| [78] |
Wang X, Ren P, Ji L, et al. OsVDE, a xanthophyll cycle key enzyme, mediates abscisic acid biosynthesis and negatively regulates salinity tolerance in rice. Planta, 2022, 255: 6. DOI:10.1007/s00425-021-03802-1 |
 2024, Vol. 36
2024, Vol. 36 

 翁羽翔,中国科学院物理研究所软物质物理实验室研究员。1985年及1988年毕业于华东师范大学化学系,分别获学士和硕士学位。1993年获中国科学院物理所光学博士学位。1994—1999年分别在香港大学和美国Emory大学从事博士后研究,1999年入选中国科学院物理研究所“百人计划”。2009年获国家“杰出青年基金”支持。研究方向为光合系统蛋白质动态结构及生物量子效应研究、光合模拟系统中的超快光谱应用研究。在Nature Plants、Nature Communications、PRL、JACS、Biophysical Journal、Rev Sci Instrum、The Journal of Physical Chemistry Letters、JCP、JPC等学术期刊发表论文百余篇。出版《超快激光光谱原理与技术基础》著作一部
翁羽翔,中国科学院物理研究所软物质物理实验室研究员。1985年及1988年毕业于华东师范大学化学系,分别获学士和硕士学位。1993年获中国科学院物理所光学博士学位。1994—1999年分别在香港大学和美国Emory大学从事博士后研究,1999年入选中国科学院物理研究所“百人计划”。2009年获国家“杰出青年基金”支持。研究方向为光合系统蛋白质动态结构及生物量子效应研究、光合模拟系统中的超快光谱应用研究。在Nature Plants、Nature Communications、PRL、JACS、Biophysical Journal、Rev Sci Instrum、The Journal of Physical Chemistry Letters、JCP、JPC等学术期刊发表论文百余篇。出版《超快激光光谱原理与技术基础》著作一部