(2 中国科学院大学,北京 100049)
(2 University of Chinese Academy of Sciences, Beijing 100049, China)
光合生物(陆地植物、藻类及光合细菌)遍布陆地和海洋,通过光合作用将太阳能转化为人类所需的氧气、食物、能源、材料以及药物。光合作用合成生物学融合了基因组学、基因组编辑与合成技术、计算机科学等多学科背景,开启了一个全新的研究模式。通过设计并制造全新代谢、结构及调控模式,不仅能创建新型光合系统,还为生命科学基础研究提供全新研究材料及视角。同时,通过提高光能转化效率,可以实现作物高产以及生产生物燃料、高附加值化学品和其他有价值的产品。
1 战略规划当前,各国在光合作用合成生物学领域进行了大量投资和布局,旨在推动相应的基础研究、技术开发和应用推广。通过政府资助、研究机构和大学的科研投入,以及私人投资的积极参与,这一领域的研究和应用均取得了显著进展。
1.1 深刻强化光合生物学在解决气候问题中的重要作用随着光合作用系统机理研究的逐步深入,光合作用的人工设计及改良能力进一步增强,利用光合作用合成生物学应对气候变化带来的挑战也成为重要的研究方向。2022年9月,美国工程生物学研究联盟(Engineering Biology Research Consortium, EBRC)在发布的《气候与可持续发展的工程生物学:更清洁未来的研究路线图》(Engineering Biology for Climate & Sustainability: A Research Roadmap for a Cleaner Future)中提出了通过工程化设计改造更加有效的光合作用有机体(植物、藻类、蓝藻)来提高CO2吸收,开发无细胞系统以实现生物人工光合作用等研究目标[1]。2023年3月,美国白宫科技政策办公室(Office of Science and Technology Policy, OSTP)发布了《生物技术和生物制造的宏大目标》(Bold Goals for U.S. Biotechnology and Biomanufacturing),指出生物技术和生物制造在减少温室气体排放、增加碳封存能力方面有巨大前景,如设计与气候变化相关的植物和农业系统,通过工程化改造光合系统等途径提高其碳汇能力[2]。2023年3月,英国环境、食品和乡村事务部颁布《基因技术(精准育种)法案》,允许在英格兰使用包括基因编辑在内的技术,精准、有针对性地改变生物体的遗传密码,从而使植物获得更有利的特性,减少化肥和杀虫剂的使用并增强作物的气候适应能力,这将有助于增强食品供应的弹性,改善自然环境[3]。
1.2 高度聚焦利用光合作用合成生物学增强农业与工业创新目前,超过80%的农业用地种植的是缺乏CO2浓缩机制的C3植物;利用系统模型,鉴定控制C3植物光合效率的限制因子,进而针对性地进行改造,是当前改良光合效率的重要途径[4]。最具代表性的是由比尔和梅林达盖茨基金会(Bill & Melinda Gates Foundation)、粮食和农业基础研究基金会(Foundation for Food and Agriculture Research, FFAR)和英国政府等联合支持的国际研究项目“实现提高净光合效率”(Realizing Increased Photosynthetic Efficiency, RIPE)。该项目致力于提高5种作物的光合效率从而可持续性地增加全球粮食生产力,包括木薯、豇豆、玉米、水稻和大豆;从2012年至今已经获得了1.17亿美元的经费支持[5]。此外,传统农用化工产品如化肥、除草剂、杀虫剂等的使用造成了严重的污染和土壤生态问题。利用工程化改造的微生物及其代谢物取代传统农用化工产品,通过增加叶绿体、增强光合作用等功效,可助力实现农业高质量发展的目标[6]。
同时,光合作用合成生物学研究为化学品和材料的绿色制造开辟了全新的原料和路线,例如利用光合作用生成生物质可以作为原料替代煤炭、石油、天然气等化石能源。2010年8月,美国能源部(Department of Energy, DOE)拨付1.22亿美元专款,在加州建立人工光合作用联合研发中心,加速人工光合作用这项革命性、突破性的能源技术研发进程;2020年,DOE又出资1亿美元启动人工光合作用研究计划,旨在充分利用阳光来生产燃料[7]。2023年,英国研究与创新署(UK Research and Innovation, UKRI)宣布支持48项工程生物学研发活动[8],包括“将蓝藻工程改造为生物太阳能细胞工厂,以实现可扩展的碳捕获利用和储存”等项目。由北欧的高校及产业合作伙伴成立的卓越中心NordAqua旨在开发适合北欧生物经济的生产平台,利用水生光合生物的特性,通过改善光合作用并开发合成生物学工具,创建生产各种燃料和具有经济价值化学品的细胞工厂,为生物基产品的可持续生产开发创新的价值链[9]。
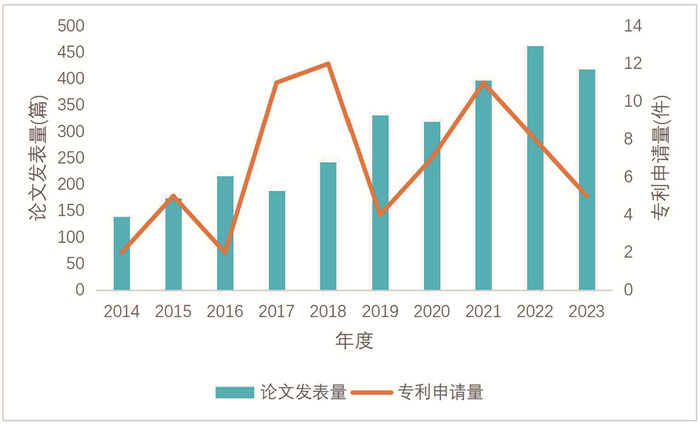
2 研发格局检索Web of Science数据库,获得光合作用合成生物学领域2014-2023年研究论文2 886篇。检索出的论文,不仅包括用合成生物学改造光合作用的相关研究成果,也包括经合成生物学改造后影响光合作用的相关研究成果。并用incoPat专利数据库检索光合作用合成生物学领域专利,获得2014-2023年专利68件(图 1)。
|
检索日期:2024-06-06,数据库更新日期:2024-06-05。检索式为光合作用and合成生物学,专利检索式、检索日期与论文相同。 图 1 2014−2023年光合作用合成生物学领域论文发表与专利申请量趋势 |
从年度发展趋势看,光合作用合成生物学领域论文发表量稳步增长,但申请专利较少,2018年申请最多,之后有所下降,表明该领域仍处于基础研究阶段,技术开发较少。未来我国需要加强研究成果转化和相关技术开发。
中国在光合作用合成生物学领域的研究实力强,论文量、专利申请量都排名第一。相比较而言,我国发表的论文量远高于专利申请量,表明我国虽然开展了很多基础研究,但这些研究可转化成专利技术、可落地的较少;美国的论文量排名第二,但专利申请量较少,仅申请6件专利,排名第4;德国论文量排名第三,10年发表了309篇,但专利申请量仅为1件。值得一提的是,荷兰论文量排名第14位,10年发表了58篇论文,但专利申请量为20件,排名第二(表 1)。
| 表 1 2014−2023年光合作用合成生物学领域论文发表与专利申请量较多的国家 |
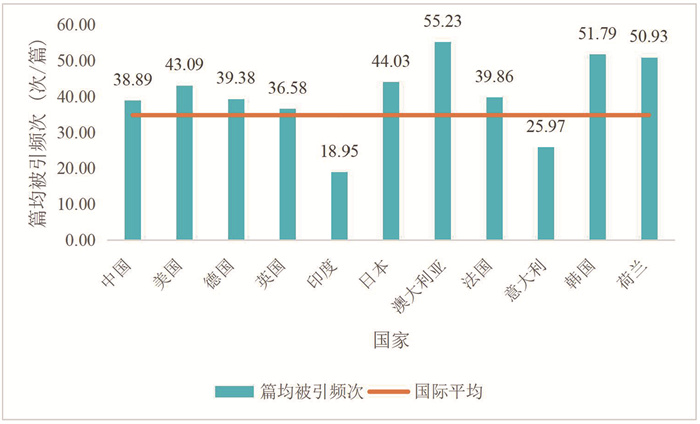
进一步从总被引和篇均被引看各国的研究影响力,发现总被引频次排名前三位的国家与论文量排名前三位的国家相同,都是中国、美国、德国。光合作用合成生物学领域国际平均篇均被引频次为34.81次/篇。与国际平均水平相比,印度和意大利的篇均被引频次低于国际平均水平,其他国家均高于国际平均水平(图 2)。
|
图 2 2014−2023年光合作用合成生物学领域论文发表量较多国家的篇均被引频次与国际平均水平比较 |
从ESI高水平论文及其占比看各国高水平论文发表情况。可以看出,发表ESI高水平论文排名前三位的国家分别是中国、美国、德国,但是ESI高水平论文量占比排名前三位的分别是澳大利亚(8.45%)、韩国(8.25%)和日本(7.32%)。
2014-2023年光合作用合成生物学领域发文量较多的机构有中国科学院、中国农业科学院、密歇根州立大学等。在论文量排名前十位的机构中,3个中国机构,5个美国机构,法国和英国机构各1个;其中美国的机构篇均被引频次都比较高,中国科学院的篇均被引频次也比较高,为48.70次/篇。ESI高水平论文量中国科学院排名第一,为23篇,远高于其他机构,ESI高水平论文量占比也排名第一,高达10.8% (表 2)。
| 表 2 2014−2023年光合作用合成生物学领域发文量排名前10位的机构 |
光合作用合成生物学领域整体专利申请量较少,主要是由于各机构的专利申请量都比较少。专利申请量最多的是帝斯曼公司,其次是牛津大学,排名第三的是美国Nmc公司。我国的浙江大学、深圳大学、中国科学院分子植物科学卓越创新中心、华南农业大学都申请了相关专利(表 3)。
| 表 3 2014−2023年光合作用合成生物学领域重要的专利申请人 |
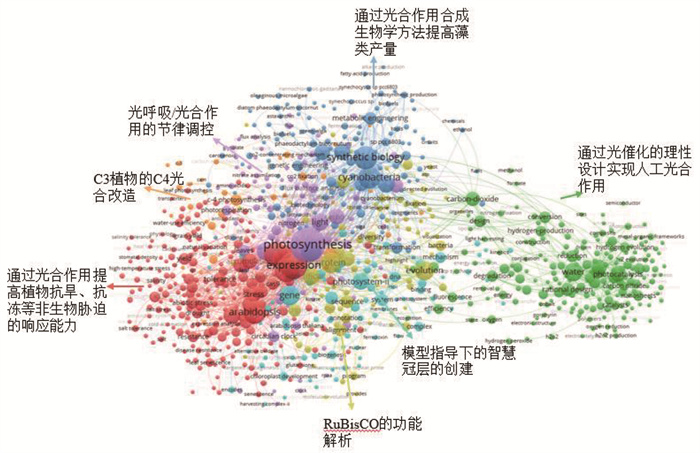
下载该领域2014−2023年的论文1 489篇,利用VOSviewer软件进行关键词聚类分析,获得以下7个光合作用合成生物学领域研究热点(图 3)。
|
利用VOSviewer软件对论文中的关键词进行共现聚类,获得聚类图。不同主题用不同颜色表示,圆点大小表示出现频次的多少,圆点越大,出现频次越多。 图 3 光合作用合成生物学研究热点 |
植物可以通过改变光合作用来感知和适应环境挑战如干旱、高盐和极端天气[10]。例如,在干旱胁迫期间,植物关闭气孔以减少水分散失,并且由于气体交换的减少而抑制光合作用[11]。研究发现,一种叶绿体β-葡萄糖苷酶同工酶Os3BGlu6在水稻的细胞脱落酸(ABA)循环中起作用,水稻Os3BGlu6的破坏导致矮化、叶片ABA含量降低、干旱敏感性、光合作用速率降低和细胞间CO2浓度升高[12]。研究表明,介导冷驯化的关键转录因子C重复结合因子(C-repeat binding factor, CBF)的积累可以提高光敏色素B (phytochrome B, phyB)的稳定性,促进植物的抗冻性[13]。在温度胁迫研究中,油菜通过上调光合基因的表达获得了更高的耐寒性[14]。
3.2 通过光催化的理性设计实现人工光合作用(绿色聚类)利用光催化和光电化学催化CO2还原进行人工光合作用是解决资源、能源和环境问题的一种极具潜力的化学过程。人工光合作用的优点之一是,使用丰富的水作为电子和质子源,将太阳能转化为化学产品。已经开发出单颗粒光催化剂、Z型光催化剂和光电极用于人工光合CO2还原[15];利用纯水、聚光太阳能光和氮化铟镓光催化剂实现9.2% 的高效太阳能制氢(solar-to-hydrogen, STH)[16];建立了光催化CO2还原的完整实验流程,包括催化剂合成和表征、反应器构建、光催化测试和机理探索等[17]。目前,研究人员还通过介孔单晶类TiO2复合催化剂增强制氢和CO2还原的光催化性能[18]。光催化在工业和环境方面具有重要应用潜力,未来也将创建稳定性更高、效率更高的光催化体系[19]。中国科学院天津工业生物技术研究所从头设计出11步主反应的非自然CO2固定与人工合成淀粉新途径,在实验室中首次实现从CO2到淀粉分子的全合成。该研究通过耦合化学催化与生物催化模块体系,创新了高密度能量与高浓度CO2利用的生物过程技术,通过反应时空分离优化,解决了人工途径中底物竞争、产物抑制、热/动力学匹配等问题,扩展了人工光合作用的能力[20]。
3.3 通过光合作用合成生物学方法提高藻类产量(深蓝色聚类)蓝藻是革兰氏阴性光自养原核生物,对地球生态具有重要意义。由于它们可以释放氧气,有成熟的遗传研究体系,因此被设计为微生物研究底盘,支持以CO2为原料的生物燃料和化学品生产。研究人员正在大规模表征和开发用于蓝藻合成生物学应用的遗传调控元件和策略[21]。目前,在包括启动子、sRNA、RBS、核糖开关和CRISPR/Cas9系统在内的遗传工具开发方面取得了重大进展,极大支持了基于蓝藻的生物质生产和产品开发[22]。
用微藻生产生物燃料和其他商品面临的主要瓶颈是藻类生产成本过高。提高微藻的生产能力是解决这个问题的重要方法。目前研究人员主要用合成生物学方法设计微藻株系的下游生产途径,而通过上游光合作用和碳固定代谢的设计及改造以促进生长、提高生产力和产量的研究较少。通过改良天然卡尔文-本森-巴萨姆循环、利用合成替代品等措施,都有望提高CO2同化速率,以提高藻类生产能力[23]。
3.4 RuBisCO的功能解析(黄色聚类)RuBisCO是地球上最丰富的酶,其氨基酸序列和催化参数的变异对生物圈中的碳循环有重大影响。研究RuBisCO结构及其演变过程有助于制定新的RuBisCO遗传改良策略。目前,通过评估RuBisCO Ⅰ、Ⅱ和Ⅲ亚型之间的序列和结构的演变,明确了内在灵活性和残基-残基相互作用,揭示了RuBisCO构象的变化,识别出RuBisCO结构柔韧性的关键氨基酸残基,为其酶促工程提供了重要信息[24]。近来,通过对RuBisCO Ⅰ型酶的演化分析,为采用和巩固Ⅰ型RuBisCO的组装过程提供了全新的进化轨迹[25]。在RuBisCO的优化方面,通过理论计算模拟及人工进化方法,大规模开展新型RuBisCO创制[26-27]。
3.5 光呼吸/光合作用的节律调控(紫色聚类)要实现高产,需要环境因子、昼夜节律与新陈代谢的紧密协同。目前,研究人员阐明了昼夜节律如何调节植物源和汇器官代谢过程、根系渗出过程以及植物与其相关微生物群落互作关系[28]。昼夜节律对植物Lhcb家族基因的表达有显著的影响[29];而光呼吸的转录和翻译后调控与氮和硫代谢之间存在紧密联系[30]。在光呼吸改造方面,近年来取得较大进展。伊利诺伊大学、我国华南农业大学分别已在烟草、水稻中建立了光呼吸支路,并实现了产量的提高[31-32]。
3.6 C3植物的C4光合改造(橙色聚类)鉴于C4光合作用比C3光合作用有更高的光能、水分及氮素利用效率,将C3植物改造成为C4光合作用一直是当前光合作用领域的研究焦点之一。要开展C4改造,一方面需要阐明C4光合高光效背后的结构、细胞及生化特征[33],同时要阐明这些结构背后的遗传调控机制[34-35]。在这个方面,控制C3叶片中维管束鞘细胞激活的转录因子已被发现[36];同时,控制叶脉密度的重要基因也逐渐被挖掘出来[37];C4代谢通路的合成生物学再现也已被测试[38]。
3.7 模型指导下的智慧冠层的创建(天蓝色聚类)冠层光合效率的提升是未来提高光合效率,进而提升作物产量的关键。由于冠层光合的复杂性,利用三维冠层光合系统鉴定冠层光合效率改良靶点成为一条被证明行之有效的途径[39]。利用该方法,鉴定出了优化的RuBisCO催化参数、株型等重要改造策略[40]。目前,基于此理念,通过基因编辑方法改造光信号通路,在玉米中实现了智能冠层,提高了冠层光合效率及产量[41]。
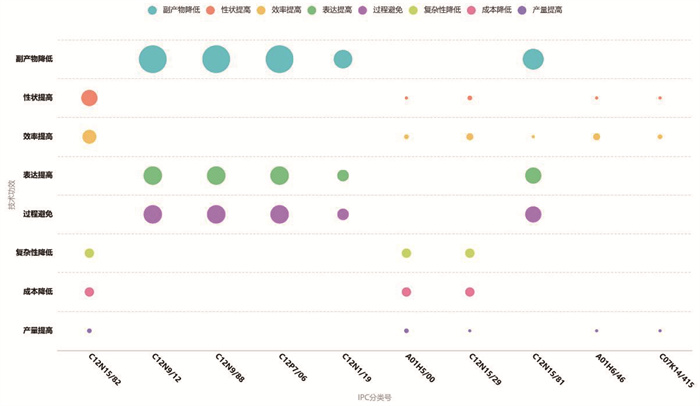
4 专利技术功效矩阵及技术重点 4.1 专利技术功效矩阵光合作用合成生物学领域的专利技术主要是对植物细胞、相关酶或酵母进行基因改造等,其功效主要是副产物降低、目标性状改良、光合效率提高和相关基因的表达量提高等,尤其是副产物降低、表达提高等功效在各类技术分类中比较明显(图 4)。
|
不同的颜色代表不同的技术功效,圆点大小表示专利多少。 图 4 光合作用合成生物学领域主要的专利技术功效矩阵 |
对光合作用合成生物学领域专利进行解读、分析,获得该领域的技术重点。
4.2.1 利用CRISPR/Cas9等基因编辑技术提高水稻等作物的光合作用效率基因编辑技术已经成为通用技术而被广泛使用。研究人员利用CRISPR/Cas9编辑技术提高作物的光合作用效率。例如,利用CRISPR/Cas9转基因技术对水稻DGP1和DGP1B基因进行了编辑,获得的dgp1 dgp1b双突变体植株可以解除红光信号对光合碳代谢及产量的抑制,提高产量(公开号CN116949089A);利用基因编辑技术调控水稻YLR基因进而调控水稻光合作用(公开号CN116769737A);通过CRISPR技术,研究了水稻OsLUT2基因功能丧失后突变体的表型,表明OsLUT2基因对水稻的光保护发挥了重要作用(公开号CN109112150B)等。
4.2.2 通过改造叶绿体基因,提高转基因植物光合作用利用基因工程方法,改造叶绿体基因,可以达到提高植物光合作用的目的。例如,研究人员开发了一种莱茵衣藻人工叶绿体基因组合成组装与功能测试的方法,其利用全化学合成的叶绿体基因组片段,在酵母-细菌系统中,完成叶绿体基因组的全化学从头合成及组装,实现了全化学合成叶绿体基因组的生物学功能(公开号CN115807021A);利用CRISPR/Cas9系统对野生型大豆中的GmTic110基因进行敲除,获得稳定的敲除转基因株系,定向改造了大豆叶绿体发育,提高了大豆的光合作用(公开号CN113736792A)等。
4.2.3 改进光合作用,提高植物固碳效率研究人员通过提高光合作用效率,进而提高植物固碳效果,如开发了一种具有自养能力的底盘细胞,该细胞表达固碳途径,包括固碳酶和其他酶,实现工业化的固碳生物制造(公开号CN114181879A);改进植物和藻类的碳固定系统,包括改善植物和藻类中碳浓缩系统基因各种组合的表达或过量表达等(公开号EP3172327B1)。
4.2.4 改造能编码RuBisCO的核酸序列,提高光合作用效率研究人员开发了一种重组酵母细胞,能功能性表达一种或多种编码RuBisCO及其分子伴侣的核酸序列(公开号WO2019110491A1)等;还开发了少量植物冠层光合速率的计算方法等技术,如用于植物冠层基础研究、农业作物育种领域、衡量栽培措施对植物冠层光合速率影响的一种计算冠层光合速率的方法(公开号CN106295093A)。还对光呼吸代谢通路进行了改造,如研究人员开发的一条光呼吸代谢改造支路及其在C3植物中的应用,该支路包括OsGLO3、OsCAT2与OsOXO3三个蛋白,改造植株表现为光合速率提高、生物量增加、叶绿素增加(公开号CN108440672B)。
5 产业发展格局在“双碳”目标的推动下,二氧化碳的收集与转化利用成为焦点产业;通过光驱动合成生物学构建光合细胞工厂,不仅能有效实现固碳,还能在此过程中生产所需的目标产物或产品,这一技术也因此成为行业关注的热点。
5.1 光合作用合成生物学产业呈现多元化的发展趋势合成生物学技术的发展,使得通过人工设计并构建全新的、具有特定生理功能的生物系统并建立全新生物制造途径成为可能。通过对光合作用合成生物学领域相关企业的梳理与调研发现,对光合作用系统的研究与开发已经不仅仅局限于提高光合作用效率来提高作物产量,还包括了改造光合微生物生产高附加值产品、构建新型微生物底盘生产工业原料及产品、通过光合开展固碳或除碳业务、设计人工光合作用系统用于生产能源燃料等多个应用方向(表 4)。
| 表 4 光合作用合成生物学相关企业列表(例举) |
利用太阳能转化CO2为有用的化学能,光合作用途径的研发有望成为实现碳中和目标的重要手段[42],并在农业、能源、环境和可持续发展等领域带来重大变革。因此,该领域的产业也受到资本关注,许多初创企业获得资本支持。2024年6月,美国初创公司Prolific Machines在B1轮融资中筹集了5 500万美元,使得其总融资达到了8 650万美元;该公司的“光分子生物学”平台利用光来引导细胞行为,可以精确控制基因表达、受体激活和酶活性等生物过程的活跃时间和持续时间。2023年,Living Carbon公司在A轮融资中筹集了2 100万美元,迄今为止获得的总投资达到3 600万美元;公司培育了首个转基因碳捕获杨树品种,该品种杨树光合作用增强,生长速度加快53%,从大气中吸收CO2的同时还具有抗高温性状。Arborea公司与伦敦帝国理工学院合作打造了世界首款生物太阳能叶片:这些叶片上覆盖着微小的植物,比普通的树木更能有效地清除CO2并生产氧气;倘若使用这一技术,仅一棵树的叶面区域就能完成100棵树的工作[43]。英国初创公司Phycobloom利用合成生物学从藻类中生产生物油,由于同一批藻类被重复使用,因此该过程快速且成本低廉;考虑到藻类的生长只需要空气、水和阳光,这项技术还关闭了温室气体排放和燃料生产之间的循环。因此,该初创公司的解决方案降低了运输部门对化石燃料的依赖[44]。
此外,光合微生物(例如微藻、蓝藻等)具有将CO2转化为生物质原材料的能力。通过不断提升藻类底盘细胞的构建效率并优化其生长特性、改进异养培养以及提高目标产物的产量,未来的藻类工程有望从传统的“农业模式”转变为现代化的“工业模式”。全球市场洞察(Global Market Insights)公司发布的一份行业报告显示,预计商业海藻市场在2027年的收入将超过950亿美元[45]。光玥生物通过光合微生物蓝藻的理性设计和多维编辑,开发了近百种“负碳”细胞工厂,不同于依赖糖资源的异养生物制造平台,这种新一代合成生物技术尝试“用空气制造化合物,用回收碳重塑世界”。2023年3月,光玥生物完成近亿元Pre-A轮融资。元育生物以微藻细胞为底盘,打造了基于光合作用单细胞的终极生物智造平台,已完成数项微藻品种的中试水平发酵,即将进入工业生产阶段;2023年8月,元育生物完成了近亿元A轮融资。
6 研发趋势 6.1 提高光合作用效率在未来提高作物/粮食产量中将起到关键作用实现单位面积增产是解决粮食安全、能源安全及生态安全的有效途径。改善光合作用当前被认为是实现粮食产量跃升的主要途径之一。通过理论计算发现,植物将光能转化为生物量的效率仅约1%,光合作用效率还有很大的提升空间[46]。美国伊利诺伊大学厄巴纳-香槟分校的研究团队在大豆植株内过表达参与“光能猝灭机制”的三个基因(即Psbs、VDE及ZEP),提高光合作用在高低光之间的“切换”效率,在田间试验中发现平均增产达24%,最高增产可达33%,而蛋白质和油含量保持不变[47]。该成果表明可以通过工程生物进行光合改造提高产量,从而为粮食安全提供全新途径。
6.2 基于光合作用的可再生能源将成为未来重要的替代能源光合作用能将光能转化为化学能,利用该工程生产生物燃料,为人类提供全新洁净能源,并为能源安全提供可行路径。与其他替代能源形式相比,基于光合作用的生物能源具有高效率、维护容易、低能耗维持高效运行、可存储、安全性高、不产生温室效应气体等诸多优点[48]。例如,利用藻类进行生物燃料生产已经成为生物能源领域的研究热点。美国《2015-2020战略研究报告》提出,到2050年,生物质能源将在整个能源消耗中占25%~33%[49]。美国能源部持续在生物质利用和生物质能开发方面给予资助,涉及藻类固碳、生物质催化转化、生物燃料和可再生化学品的生物精炼、生物燃料电池开发,以及废弃物转化利用等多个相关领域。
6.3 挖掘光合作用的碳固定潜力将有助于实现“双碳”目标2020年9月22日,我国在第七十五届联合国大会上宣布力争2030年前CO2排放力达到峰值,努力争取2060年前实现碳中和目标。每年约有2 580亿吨CO2经由光合作用而固定为有机物,合成生物学的快速发展则赋予了光合作用效率提升、CO2转化和利用的更大可能。近几年,模式光合底盘、光合生物改造关键技术、光合作用驱动的CO2转化、光合系统的人工设计与异源重构等方面的研究发展迅速;同时,构建人工光合、固碳系统使其具备固定和转化CO2的能力也成为研究和产业开发的热点方向[50]。总体而言,利用光合作用和合成生物学技术提升CO2固定和转化效率,既是应对气候变化的重要手段,也是推动绿色经济发展的关键路径。随着研究的不断深入和技术的不断进步,人工光合与固碳系统有望在未来充分发挥潜力,为实现粮食安全、能源安全及碳中和做出重要贡献。
| [1] |
EBRC. Engineering biology for climate & sustainability: a research roadmap for a cleaner future[EB/OL]. [2024-06-15]. https://ebrc.org/focus-areas/roadmapping/engineering-biology-for-climate-sustainability-september-2022/
|
| [2] |
OSTP. Bold goals for U.S. biotechnology and biomanu-facturing [EB/OL]. (2023-03)[2024-06-15]. https://www.whitehouse.gov/wp-content/uploads/2023/03/Bold-Goals-for-U.S.-Biotechnology-and-Biomanufacturing-Harnessing-Research-and-Development-To-Further-Societal-Goals-FINAL.pdf
|
| [3] |
UK Parliament. Genetic Technology (Precision Breeding) Act 2023[EB/OL]. (2023-03-27)[2024-06-15]. https://bills.parliament.uk/bills/3167
|
| [4] |
林敏. 农业生物育种技术的发展历程及产业化对策. 生物技术进展, 2021, 11: 405-17. |
| [5] |
RIPE[EB/OL]. [2024-06-15]. https://ripe.illinois.edu/objectives/our-story
|
| [6] |
应汉杰, 柳东, 王振宇, 等. 工业生物制造与"碳中和"目标探讨. 合成生物学, 2024. DOI:10.12211/2096-8280.2023-075 |
| [7] |
DOE. Department of Energy to provide $100 million for solar fuels research[EB/OL]. (2020-02-19)[2024-06-15]. https://www.energy.gov/articles/department-energy-provide-100-million-solar-fuels-research
|
| [8] |
UKRI. £13.5 million for 48 engineering biology R & D projects[EB/OL]. (2024-03-14)[2024-06-15]. https://www.ukri.org/news/13-5-million-for-48-engineering-biology-rd-projects/
|
| [9] |
NordAqua[EB/OL]. [2024-06-15]. https://nordaqua.fi/about/our-aims/
|
| [10] |
Zhang Y, Xu J, Li R, et al. Plants' response to abiotic stress: mechanisms and strategies. Int J Mol Sci, 2023, 24: 10915. DOI:10.3390/ijms241310915 |
| [11] |
Shinozaki K, Yamaguchi-Shinozaki K. Functional genomics in plant abiotic stress responses and tolerance: from gene discovery to complex regulatory networks and their application in breeding. Proc JPN Acad Ser B Phys Biol Sci, 2022, 98: 470-92. DOI:10.2183/pjab.98.024 |
| [12] |
Wang C, Chen S, Dong Y, et al. Chloroplastic Os3BGlu6 contributes significantly to cellular ABA pools and impacts drought tolerance and photosynthesis in rice. New Phyto, 2020, 226: 1042-54. DOI:10.1111/nph.16416 |
| [13] |
Jiang B, Shi Y, Peng Y, et al. Cold-induced CBF-PIF3 interaction enhances freezing tolerance by stabilizing the phyB thermosensor in Arabidopsis. Mol Plant, 2020, 13: 894-906. DOI:10.1016/j.molp.2020.04.006 |
| [14] |
Yuan L, Zheng Y, Nie L, et al. Transcriptional profiling reveals changes in gene regulation and signaling transduction pathways during temperature stress in wucai (Brassica campestris L.). BMC Genom, 2021, 22: 687. DOI:10.1186/s12864-021-07981-9 |
| [15] |
Yoshino S, Takayama T, Yamaguchi Y, et al. CO2 reduction using water as an electron donor over heterogeneous photocatalysts aiming at artificial photosynthesis. Acc Chem Res, 2022, 55: 966-77. DOI:10.1021/acs.accounts.1c00676 |
| [16] |
Zhou P, Navid IA, Ma Y., et al. Solar-to-hydrogen efficiency of more than 9% in photocatalytic water splitting. Nature, 2023, 613: 66-70. DOI:10.1038/s41586-022-05399-1 |
| [17] |
Fang S, Rahaman M, Bharti J, et al. Photocatalytic CO2 reduction. Nat Rev Methods Primers, 2023, 3: 61. DOI:10.1038/s43586-023-00243-w |
| [18] |
Hamukwaya SL, Zhao Z, Hao H., et al. Enhanced photocatalytic performance for hydrogen production and carbon dioxide reduction by a mesoporous single-crystal-like TiO2 composite catalyst. Adv Compos Hybrid Mater, 2022, 5: 2620-30. |
| [19] |
Hassaan MA, El-Nemr MA, Elkatory MR, et al. Principles of photocatalysts and their different applications: a review. Top Curr Chem (Cham), 2023, 381: 31. DOI:10.1007/s41061-023-00444-7 |
| [20] |
Cai T, Sun HB, Qiao J, et al. Cell-free chemoenzymatic starch synthesis from carbon dioxide. Science, 2021, 373: 1523-7. DOI:10.1126/science.abh4049 |
| [21] |
Wang F, Gao Y, Yang G. Recent advances in synthetic biology of cyanobacteria for improved chemicals production. Bioengineered, 2020, 11: 1208-20. DOI:10.1080/21655979.2020.1837458 |
| [22] |
Rai KK, Rai R, Singh S, et al. Synthetic biology tools in cyanobacterial biotechnology: recent developments and opportunities[M]//Singh UB, Rai JP, Sharma AK. Re-visiting the rhizosphere eco-system for agricultural sustainability. Singapore: Springer, 2022: 181-203
|
| [23] |
Naduthodi MIS, Claassens NJ, D'Adamo S, et al. Synthetic biology approaches to enhance microalgal productivity. Trends Biotechnol, 2021, 39: 1019-36. DOI:10.1016/j.tibtech.2020.12.010 |
| [24] |
Camel V, Zolla G. An insight of RuBisCO evolution through a multilevel approach. Biomolecules, 2021, 11: 1761. DOI:10.3390/biom11121761 |
| [25] |
Liu AK, Kaeser B, Chen LX, et al. Deep-branching evolutionary intermediates reveal structural origins of form Ⅰ rubisco. Curr Biol, 2023, 33: 5316-25.e3. DOI:10.1016/j.cub.2023.10.053 |
| [26] |
Zhu XG, Portis Jr AR, Long SP. Would transformation of C3 crop plants with foreign Rubisco increase productivity? A computational analysis extrapolating from kinetic properties to canopy photosynthesis. Plant Cell Environ, 2004, 27: 155-65. DOI:10.1046/j.1365-3040.2004.01142.x |
| [27] |
Gionfriddo M, Rhodes T, Whitney SM. Perspectives on improving crop Rubisco by directed evolution. Semin Cell Dev Biol, 2024, 155: 37-47. DOI:10.1016/j.semcdb.2023.04.003 |
| [28] |
de Barros Dantas LL, Eldridge BM, Dorling J, et al. Circadian regulation of metabolism across photosynthetic organisms. Plant J, 2023, 116: 650-68. DOI:10.1111/tpj.16405 |
| [29] |
Hu ZH, Zhang N, Qin ZY, et al. Circadian rhythm response and its effect on photosynthetic characteristics of the Lhcb family genes in tea plant. BMC Plant Biol, 2024, 24: 333. DOI:10.1186/s12870-024-04958-0 |
| [30] |
Aroca A, García-Díaz I, García-Calderón M, et al. Photorespiration: regulation and new insights on the potential role of persulfidation. J Exp Bot, 2023, 74: 6023-39. DOI:10.1093/jxb/erad291 |
| [31] |
South PF, Cavanagh AP, Liu HW, et al. Synthetic glycolate metabolism pathways stimulate crop growth and productivity in the field. Science, 2019, 363: eaat9077. DOI:10.1126/science.aat9077 |
| [32] |
Shen BR, Wang LM, Lin XL, et al. Engineering a new chloroplastic photorespiratory bypass to increase photosynthetic efficiency and productivity in rice. Mol Plant, 2019, 12: 199-214. DOI:10.1016/j.molp.2018.11.013 |
| [33] |
Liu Q, Teng S, Deng C, et al. SHORT ROOT and INDETERMINATE DOMAIN family members govern PIN-FORMED expression to regulate minor vein differentiation in rice. Plant Cell, 2023, 35: 2848-70. DOI:10.1093/plcell/koad125 |
| [34] |
Sage RF, Zhu XG. Exploiting the engine of C4 photosynthesis. J Exp Bot, 2011, 62: 2989-3000. DOI:10.1093/jxb/err179 |
| [35] |
Zhao H, Wang Y, Lyv AM, et al. Two major metabolic factors for an efficient NADP-malic enzyme type C4 photosynthesis. Plant Physiol, 2022, 189: 84-98. DOI:10.1093/plphys/kiac051 |
| [36] |
Wang P, Khoshravesh R, Karki S, et al. Re-creation of a key step in the evolutionary switch from C3 to C4 leaf anatomy. Curr Biol, 2017, 27: 3278-87.e76. DOI:10.1016/j.cub.2017.09.040 |
| [37] |
Dong W, Chang T, Dai H, et al. Creating a C4-like vein pattern in rice by manipulating SHORT ROOT and auxin levels. Sci Bull (Beijing), 2023, 68: 3133-6. DOI:10.1016/j.scib.2023.10.005 |
| [38] |
Ermakova M, Arrivault S, Giuliani R, et al. Installation of C4 photosynthetic pathway enzymes in rice using a single construct. Plant Biotechnol J, 2021, 19: 575-88. DOI:10.1111/pbi.13487 |
| [39] |
Zhu XG, Song QF, Ort DR. Elements of a dynamic systems model of canopy photosynthesis. Curr Opin Plant Biol, 2012, 15: 237-44. DOI:10.1016/j.pbi.2012.01.010 |
| [40] |
Zhu XG, Ort DR, Parry MAJ, et al. A wish list for synthetic biology in photosynthesis research. J Exp Bot, 2020, 71: 2219-25. DOI:10.1093/jxb/eraa075 |
| [41] |
Tian J, Wang C, Chen F, et al. Maize smart-canopy architecture enhances yield at high densities. Nature, 2024, 632: 576-84. DOI:10.1038/s41586-024-07669-6 |
| [42] |
朱新广, 王佳伟, 韩斌. 植物碳汇系统与中国碳中和之路. 科学通报, 2023, 68: 12-7. |
| [43] |
张倩. 洁净空气触动每个人的心弦. 中国环境报, 2019-06-07(05)
|
| [44] |
Phycobloom[EB/OL]. [2024-06-15]. https://www.phycobloom.com/science
|
| [45] |
预计到2027年商业海藻市场价值将超过950亿美元[EB/OL]. (2023-06-15)[2024-06-15]. https://nyncj.huizhou.gov.cn/zwzc/xwzx/gjyw/content/post_5009244.html
|
| [46] |
张立新, 卢从明, 彭连伟, 等. 利用合成生物学原理提高光合作用效率的研究进展. 生物工程学报, 2017, 33: 486-93. |
| [47] |
De Souza AP, Burgess SJ, Doran L, et al. Soybean photosynthesis and crop yield are improved by accelerating recovery from photoprotection. Science, 2022, 377: 851-4. DOI:10.1126/science.adc9831 |
| [48] |
朱新广, 熊燕, 阮梅花, 等. 光合作用合成生物学研究现状及未来发展策略. 中国科学院院刊, 2018, 33: 1239-48. |
| [49] |
Bauen A, Berndes G, Junginger M, et al. Bioenergy: a sustainable and reliable energy source. A review of status and prospects[EB/OL]. [2024-06-15]. https://publications.tno.nl/publication/34627904/P1i42V/b10011.pdf
|
| [50] |
杨文强, 林荣呈, 端木德强, 等. 近10年光合作用领域若干重要研究进展. 植物生理学报, 2024, 60: 211-47. |
 2024, Vol. 36
2024, Vol. 36 

 刘晓,中国科学院上海营养与健康研究所生命科学信息中心副研究馆员,主要从事合成生物学及相关领域的战略情报研究,主持和参与了科技部、国家自然科学基金委- 中国科学院学部、上海市科委等多项合成生物学领域的战略研究和软科学研究项目,为国家和区域的合成生物学发展提供决策参考
刘晓,中国科学院上海营养与健康研究所生命科学信息中心副研究馆员,主要从事合成生物学及相关领域的战略情报研究,主持和参与了科技部、国家自然科学基金委- 中国科学院学部、上海市科委等多项合成生物学领域的战略研究和软科学研究项目,为国家和区域的合成生物学发展提供决策参考