随着细胞治疗技术的不断发展和临床研究的不断深入,细胞治疗产品研发热度迅速提升,在治疗癌症、遗传性疾病、器官损伤、罕见病等领域展示出巨大的应用潜力[1],已然成为全球科技与产业竞争的重要“新赛道”。截至2024年8月,根据医药魔方数据库统计,全球细胞治疗相关产品在研管线数6 437个,中国1 948个,位列第2。到2024年底,全球累计有105个细胞与基因疗法药物上市,中国共有5款产品获批上市[2]。研究数量的迅速攀升和使用风险的不确定使得监管机构和医疗机构面临巨大压力。
在我国,以上市注册为目的的细胞治疗产品,需遵循《药物临床试验质量管理规范》,按注册类药品管理法规进行临床试验和注册申报工作,属于注册临床试验(industry-sponsored clinical trial, IST)管辖范畴。而不以上市为目的,研究出发点是基于前期研究基础开展早期临床探索,用于回答某些科学问题或验证科学假设的情况下,我国允许由医疗机构研究者发起干细胞或体细胞临床研究,属于研究者发起的临床研究(investigator-initiated trial, IIT)管辖范畴。清华大学陈晓媛团队对2021年3月前注册/备案的953项细胞治疗研究分析显示,2017年以后,细胞治疗领域IIT研究数量是2017年之前的2.4倍,是IST研究数量的12.6倍[3]。
目前,我国细胞治疗IIT研究的国家监管及医疗机构管理体系建设尚未完全成熟。按照规定,此类研究立项和实施管理主要由医疗机构承担,并对研究风险负主要责任,而学术及伦理审查作为细胞治疗临床研究立项审核的关键步骤,面临前所未有的压力。相比传统创新药,细胞治疗产品更具复杂性,在药学研究(产品质量稳定性较差)、非临床研究(药效、药代动力学、毒理学动物实验数据外推存在局限性并受多种因素影响)、产品制备和储存(起始原材料来源多样、采集和制备工艺复杂、质量研究和控制难度大、运输和储存条件要求高)、有效性(CAR-T治疗缓解后的复发率>50%[4]、实体瘤效果不佳)上均存在不同程度的风险和不确定性。而目前的管理体系缺乏对细胞治疗学术及伦理审查标准的详细规定,容易出现对非临床研究评估、方案设计评估、风险获益评估及知情同意审查不充分的风险。
因此,本文以医疗机构发起的细胞治疗临床研究项目为研究重点,围绕国家监管、医疗机构管理及伦理审查提出若干建议,以期助力细胞治疗临床研究的规范开展。
1 国内外细胞治疗产品监管体系现状及对我国的启示 1.1 中国细胞治疗产品监管现状中国细胞治疗产品行业的监管大致经历了三个阶段。2015年以前处于起步发展阶段,细胞治疗以第三类医疗技术准入管理,缺乏专门的针对性法规,对细胞治疗产品的定义、分类、研发、临床试验、生产、审批等环节的规定较为模糊和分散。2015年到2021年为市场探索阶段,2015年《干细胞临床研究管理办法(试行)》发布[6],允许医疗机构开展以疾病预防或治疗为目的的干细胞临床研究,前提是医疗机构需完成干细胞项目资质备案,以及通过机构审核立项的项目需在国家卫健委备案,并且完成备案的项目在研究结束后,如需申请药品注册临床试验,可将已获得的临床研究结果作为技术性申报材料提交并用于药品评价。2017年《细胞治疗产品研究与评价技术指导原则》(试行)发布[7],为按“药品”管理的活细胞治疗产品的风险控制、药学研究、非临床研究、临床研究提供了统一的技术标准和规范框架,改变了此前行业内标准不统一、操作不规范的局面。这使得细胞治疗企业和研究机构在产品研发过程中有了明确的方向和遵循的准则,有助于提高细胞治疗产品的质量和安全性,促进整个细胞治疗行业的健康、有序发展。2021年国家卫健委发布的《医疗卫生机构开展研究者发起的临床研究管理办法(试行)》规定[8],非产品研制的体细胞临床研究参照《干细胞临床研究管理办法(试行)》管理[6],进一步为细胞治疗领域临床研究的开展提供了政策层面的指导。自此,我国细胞治疗研究既允许开展以注册上市为目的的IST研究,也允许开展早期临床探索性的IIT研究(图 1)。2021年是我国“细胞治疗元年”,第一个CAR-T产品阿基伦赛获批上市,我国细胞治疗产品进入规范监管阶段。2023年8月18日,中国医药生物技术协会受国家卫健委科教司委托,发布《体细胞临床研究工作指引(试行)》[9],这是首个专门针对体细胞临床研究的普适性规范性文件。截至目前,国家药监局药审中心已发布了30多项相关技术指导原则,初步形成了覆盖研发、注册、生产和上市后全生命周期的监管体系。
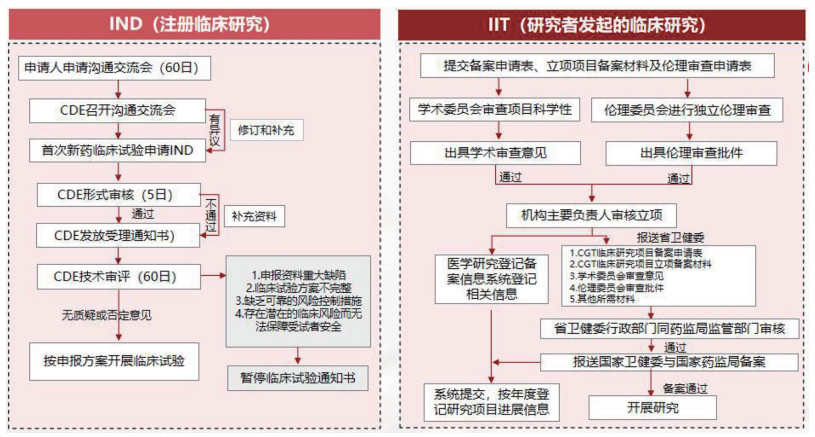
|
图 1 中国细胞治疗产品临床研究的管理 |
在美国,细胞与基因治疗药品被归类为人体细胞、组织及基于细胞和组织的产品(human cells, tissues, and cellular and tissue-based products, HCT/Ps)。监管机构为美国食品药品管理局(Food and Drug Administration, FDA),FDA下设的生物制品评价与研究中心(Center for Biologics Evaluation and Research, CBER)专门设立了先进疗法办公室(Office of Tissues and Advanced Therapies, OTAT),负责组织、细胞和基因治疗产品的审评与批准。为了应对细胞治疗产品快速增长带来的需求,2022年,FDA将OTAT重组并更名为治疗产品办公室(Office of Therapeutic Products, OTP),以扩充人员规模并提升专业能力[10]。
FDA采用“法规-监管-指导原则”三级监管体系[11]。2005年发布的《人体细胞和组织产品的管理规定》为HCT/Ps的监管提供基础,提出根据“是否为最小限度操作、是否同源使用、是否与其他药品或产品结合使用以及是否对身体产生系统性影响”将HCT/Ps分为高风险产品与低风险产品进行管理。低风险产品只需在FDA备案登记,无需递交新药临床试验申请; 高风险产品作为药品或生物制品进行监管,需要通过新药研究申请(investigational new drug, IND)进行临床试验,递交生物制品上市许可申请(biologic license application, BLA)并接受上市前许可审批及上市后监管。2016年,《21世纪治愈法案》首次提出“再生医学先进疗法”概念,对认定为先进疗法的产品,FDA将对其提供加速审评的保障政策,并加强与研发企业的沟通交流。此外,FDA针对细胞治疗产品全生命周期出台了多项指南,以期从国家层面规范细胞治疗产品的技术开发、临床研究等。
1.3 欧盟细胞治疗产品监管体系现状欧盟将体细胞治疗产品、组织工程产品和基因治疗产品统一归为先进治疗产品(advanced therapy medicinal products, ATMPs),按药品进行监管,所有上市销售的ATMPs须经过欧盟委员会的集中审批。其管理主要依照药品、器械以及ATMPs的监管政策。2007年,欧盟发布《先进技术治疗医学产品法规》(Regulation (EC) 1394/2007)条例,为ATMPs提供了总体法律框架。欧盟成立了先进疗法委员会(CAT),负责对ATMPs进行技术审评,并要求该类产品必须遵循集中审评程序。考虑到ATMPs的特殊性,在正式上市审批前,需先提交产品分类申请,由CAT对提交的ATMPs进行技术审评,并将审评意见提交至人用医药产品委员会(CHMP)。CHMP基于审评意见提出上市许可建议,最终由欧盟委员会(EC)作出具有约束力的决定,适用于所有成员国[12]。为支持ATMPs的开发,欧洲药品管理局已经建立了较为完备的支持体系,例如开展科学咨询和方案协助,罕见病药品认定,ATMPs分类支持,微、小、中型企业质量和非临床数据的认证以及系列减费措施[1]。
1.4 日本细胞治疗产品监管体系现状日本对细胞治疗、基因治疗和组织工程产品等再生医学产品实行独立监管,采用“双轨制”管理模式:通过《再生医学安全法》管理再生医学技术的临床研究和自由诊疗,由厚生劳动省(Ministry of Health, Labour and Welfare, MHLW)负责; 通过《药品、医疗器械和其他医疗产品法》管理以产品上市为目的的再生医学产品,由医药品医疗器械综合机构(PMDA)负责[5]。
根据《再生医学安全法》[13],日本对再生医学产品按照风险高低试行分类审批的制度。高风险产品指未在人体实施的胚胎干细胞、诱导多能干细胞、基因修饰细胞等,医疗机构提交申请后,需要经由特别认定的再生医学委员会审批,并由MHLW下设的健康科学审议会审议; 中风险产品是指经体外特殊处理,且已改变原有生物特性的自体细胞,经由特别认定的再生医学委员会审批,向MHLW提交; 低风险产品是指未经体外特殊处理,并且是自体或者同源性细胞,经由再生医学委员会审批,向MHLW提交。上述产品在申请开始临床研究前需要同时满足细胞产品生产设备认证、研究者专业资质等要求,并在日本临床试验注册处(Japan Registry of Clinical Trials, JRCT)登记。
与欧美等国相比,日本对再生医学产品的监管较为灵活,允许IIT数据用于支持产品“有条件”批准上市。以溶瘤病毒疗法Delytact为例,2021年日本基于两项IIT数据批准其用于治疗复发性胶质母细胞瘤,一项IIT为东京大学的关键性试验,另一项为队列研究,为产品上市提供重要支持。这种依托IIT数据推动再生医学产品上市的方式,体现了日本监管体系在填补难治性疾病和临床空白领域上的独特优势。截至2023年,日本已有3款再生医学产品通过IIT数据支持上市[14]。
综上所述,不同国家和地区对于细胞治疗产品的监管体系有所不同。从审批上市和临床应用角度看,总体分为两类监管模式路径:一是由药品监督管理部门负责监管,按照风险等级分类管理,典型代表如美国、欧盟等; 二是由医疗卫生管理部门审核批准在医疗机构临床应用,而上市流通产品则按照药品管理,典型代表是日本。
1.5 我国医疗卫生机构发起的细胞治疗临床研究监管的问题及建议对比美国、欧盟和日本,我国细胞治疗产品的监管体系与日本最为相似,且在按“药品”管理条线上已有明确的法律法规及细致的指导原则,但在细胞治疗IIT研究管理上存在以下不足:(1)缺乏细胞治疗产品IIT研究数据如何支持申请注册临床试验或用于药品注册申报的详细全面的指导细则; (2)医疗机构层面缺乏细胞治疗产品药学研究、非临床研究、上市后监管等方面的专业咨询委员会; (3)未根据产品风险大小实施差异化管理。在不同风险等级产品的风险描述、分类标准、监管方式、支持措施方面仍缺乏相关监管政策和具体指导原则。对此,从国家政策及监管体系建设层面,我们提出以下建议。
(1) 制定允许IIT数据用于支持细胞治疗产品开展注册临床试验或“有条件”批准上市的细则。我国细胞治疗领域IIT研究数量已迎来爆发时刻,为提升IIT研究实施质量及规范性,更好地发挥IIT数据价值,建议参考《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》[15]中关于干细胞备案临床研究用于药品注册审评的必要条件及日本模式,制定允许IIT数据用于支持产品“有条件”批准上市的细则。例如,对于工艺成熟且质量已达稳定的细胞治疗产品,若其IIT临床研究合规性和数据完整性符合GCP要求,且IIT研究结果提示该产品有较好的有效性和安全性,建议建立适当的沟通渠道加速注册临床试验的审批; 而在满足上述要求的前提下,若该产品的目标适应证为罕见病或难治性疾病,则可考虑参照日本模式,允许IIT数据支持细胞治疗产品“有条件”批准上市。
(2) 优化监管机构职能与协同合作。进一步明确国家药品监督管理局(NMPA)、国家卫生健康委员会(NHC)等相关监管部门在细胞治疗“IIT研究”管理条线的职责分工,避免职能交叉和监管空白。建立高效的协调机制,加强部门间信息共享与沟通协作,如定期召开联合会议、建立信息共享平台等,确保细胞治疗产品临床研究从研究机构到产品上市全过程监管的连贯性和一致性。
(3) 为医疗机构及企业人员提供培训和指导。建议卫健委细胞治疗备案评审专家为医疗机构、细胞治疗产品研发企业提供咨询和培训服务,提高相关人员对细胞治疗技术原理、工艺流程、质量控制、安全性评估等方面的理解和判断能力。同时,支持省级、国家级层面的细胞治疗临床研究领域专家在医疗机构立项审核时即介入细胞治疗研究项目的评审,从而提升项目的评审质量和缩短项目立项时间。
(4) 对细胞治疗产品按风险分级管理。参考日本依据风险程度对再生医学产品分类管理的经验,结合中国细胞治疗技术发展现状和趋势,进一步细化细胞治疗产品分类。明确不同风险等级细胞治疗产品的定义、适用范围、审批流程和监管要求,使监管更具针对性和科学性。例如,对于风险较低、已在临床应用中积累一定经验且疗效相对明确的细胞治疗技术,可以简化备案流程,但加强研究过程中的质量监控; 对于高风险、创新性强的细胞治疗产品,则严格备案流程,确保安全性和有效性评估充分。
2 医疗机构细胞治疗临床研究管理体系建设 2.1 医疗机构开展细胞治疗临床研究的基本要求医疗机构在开展细胞治疗临床研究前,需要按照《干细胞临床研究管理办法(试行)》(2015)及《体细胞临床研究工作指引(试行)》(2023)要求(以下简称“管理办法”),在国家卫生健康委员会完成机构材料备案,同时在医学研究登记备案信息系统中完成备案材料上传。目前,细胞治疗临床研究仅允许在三级甲等医院开展,且与研究疾病相关的专业应在国家药品监督管理局完成临床试验机构备案或获得批准,以及医院需要具备与开展研究相适应的能力。此外,考虑到细胞治疗产品的特殊性,医疗机构还需建立独立的细胞治疗产品临床研究质量管理体系及审计体系,以及与细胞治疗研究相适应的学术委员会和伦理委员会,以保障细胞治疗研究的顺利开展。
2.2 建立院内细胞治疗临床研究全流程管理制度拟开展细胞治疗临床研究的医疗机构,应当按管理办法要求,建立院内细胞治疗临床研究管理制度。细胞治疗临床研究的管理可由医院科研处/临床研究中心/药物临床试验机构承担。项目管理部门在接收到细胞治疗临床研究申请后,按照管理办法要求,在3个工作日内对材料进行形式审查,审查要点应当包括研究者及合作单位资质、经费来源、材料完整性及准确性。对于通过形式审查的项目,项目管理部门应当尽快组织学术委员会进行会议审查及伦理审查,通过后需在医学研究登记备案信息系统进行备案。在研究实施过程中,项目管理部门应当协调质量受权人对细胞治疗产品进行放行检验。鉴于细胞治疗产品风险的不确定性较高,临床研究质控部门应当加强过程管理,建议研究每入组1例即向项目管理部门报告1例,必要时项目管理部门可协同学术及伦理委员会进行核查,核查要点以GCP要求为准。有条件的机构也可邀请第三方专业机构进行监察,以保证研究的规范性。此外,医疗机构应当鼓励和支持项目管理人员和学术委员会及伦理委员会委员积极参与细胞治疗临床研究相关的培训,以提升细胞治疗临床研究的管理及审查质量。
2.3 建立全面的细胞治疗临床研究风险管理制度建议从以下方面进行细胞治疗临床研究风险管理:一是在研究方案设计时即考虑可能发生的重要的潜在风险,并制定相应处理预案,如体细胞临床研究要考虑细胞因子释放综合征(cytokine release syndrome, CRS)、免疫效应细胞相关神经毒性综合征(immune effector cell-associated neurotoxicity syndrome, ICANS)、遗传毒性等,干细胞临床研究还应当考虑体内异常增殖、成瘤性和宿主抗移植物反应等; 二是从产品质量控制、细胞治疗临床研究实施等角度制定完善的风险管理计划,企业研发人员、医疗机构质量受权人、研究者、项目管理人员都应当参与其中; 三是购买长期的、足以覆盖细胞治疗研究可能发生的所有不良事件的临床研究保险; 四是与企业建立风险共担机制,在签订合作协议时即明确双方在不良事件处理上的责任与义务。
2.4 细胞治疗临床研究不良事件的处理研究团队人员发现研究参与者损害事件后,应当立即采取必要的医疗救治措施,确保研究参与者得到及时、适当的治疗。如果损害严重,应立即启动研究方案中规定的应急预案,联系相关医疗团队或专科医生进行救治,并在规定时间内报告医院伦理委员会和相关部门。医院伦理委员会、项目管理部门及其他相关部门应组织专家对损害事件进行调查,明确损害原因、责任认定及损害程度。保险覆盖范围内的赔偿由保险公司根据保险合同进行赔付; 超出保险覆盖范围的赔偿由医院与合作单位根据损害原因调查结果、责任认定情况等进行协商。
3 提升细胞治疗临床研究学术及伦理审查能力 3.1 学术审查 3.1.1 研究者资质、研究团队和条件审查研究人员资质审核时应当关注负责人职称是否正高、是否具有GCP培训证书、是否有相关研究经验,以及研究团队是否具备开展细胞治疗临床研究的条件; 需要有来源合法,相对稳定、充分的研究经费,研究经费应当覆盖与本研究相关的所有费用,包括但不限于住院费、检查费、化验费、营养费、不良事件治疗费用等。
3.1.2 合作企业资质及细胞治疗产品相关材料审查学术委员会在合作企业资质及产品相关材料审查过程中,需要密切关注合作企业是否具备与细胞治疗产品制备相适应的设施设备和人员,是否建立符合《药品生产质量管理规范》(Good Manufacturing Practice, GMP)基本原则的细胞制备质量保证体系。此外,也要对产品的生产工艺及质量标准进行审查,具体包括以下几方面。①是否具有明确的生产规模、工艺流程、质控策略、工艺验证等; 对于有基因修饰的细胞产品,是否具有基因修饰/改造载体制备的工艺流程图、关键工艺控制点及控制措施; 对于干细胞产品,要特别关注细胞系/库的建立与检定,以及诱导分化工艺的详细流程、关键质量控制点和去除未分化细胞的策略。②产品原材料、辅料、包装材料清单是否满足质量控制要求,商业来源培养基需提供组成成分及相关质量合格证明,对制备过程中引入外源致病微生物的风险进行相关检测和质量控制。③是否对产品的生产工艺和质量工艺开展研究,制定质量标准及放行标准。④是否对容器和密闭系统进行安全性评估和相容性研究。⑤是否提供具备相关资质的第三方检测单位出具的质量检测报告。⑥产品过程追溯与不合格品处理是否合理且完善。
3.1.3 非临床研究报告审查非临床研究报告是开展临床研究的重要依据,具体审查内容需要关注以下方面。
非临床研究设计的风险导向性与个性化评估:即非临床研究方案是否依据产品特性,例如细胞来源、基因修饰、生产工艺及临床用途等进行差异化设计,研究设计要遵循“具体问题具体分析”原则,并确保受试物与拟临床样品的一致性; 若使用动物源替代品,需审查其与人源细胞在组织获取程序、生长动力学、表型功能、终产品配方等关键属性的可比性数据,以支持结果外推至人体的科学性。
动物模型的选择评估:体细胞产品非临床研究动物模型的选择需确认动物模型在生理学/解剖学上与人体具有可比性,且通过免疫抑制策略(如免疫缺陷动物、人源化模型或免疫豁免部位给药)解决人源细胞的免疫排斥问题; 对于作用持久或机制复杂的产品,应验证是否采用疾病动物模型模拟病理环境。给药途径需最大程度模拟临床方案,特殊给药装置需与临床一致。干细胞产品非临床研究应选择对人源干细胞及其分化后细胞的生物学反应与预期的人体反应相似的动物,并考虑所选动物对人源干细胞的免疫耐受性,以及动物的解剖学和病理生理学特征与拟定适应证人群的相似性; 涉及基因修饰的细胞产品,还应考虑动物对目的基因或基因表达产物的敏感性、表达产物在动物体内的生物学效应。
非临床研究内容的审查:药效学应通过可靠方法验证基本治疗机理,确定生物学效应标志物; 药代动力学须动态追踪细胞在体内的分布、迁移、归巢、定植、存活与消亡的动态过程,并阐述方法的科学性。对于干细胞产品,其药代动力学研究应特别关注长期存活情况、生物分布特征(尤其是在非靶组织的滞留情况),以及体内分化或去分化的可能性与后果; 对于基因修饰/改造的细胞,需对目的基因的存在、表达,以及表达产物的生物学作用进行必要的研究,以体现基因修饰/改造的体内生物学效应; 对于采用基因编辑技术制备的基因修饰细胞产品,应进行体外在靶和脱靶活性评估,以确定修饰酶或向导RNA对靶基因序列的特异性。
安全性评价:需符合药物非临床研究质量管理规范(GLP)(非GLP部分需说明其合理性及对结果可靠性的影响),涵盖安全药理(中枢神经/心血管/呼吸系统影响)、单次给药毒性(观察时间应覆盖细胞或细胞效应的存续时间)、重复给药毒性(包含临床拟用剂量范围和最大可行剂量,观察指标需包含形态学和功能学指标,如异常增生/免疫反应)。对于干细胞产品,必须开展专门的成瘤性和致瘤性实验,评估其体内成瘤风险,包括未分化细胞自发成瘤和促瘤作用的评估; 对于基因修饰细胞产品需进行转基因表达产物的风险评估及插入突变风险评估; 对于基因编辑细胞,需重点评估基因编辑工具的体内残留、免疫原性及脱靶效应带来的独特毒性。
最后,需确认风险闭环管理:即非临床结果是否转化为临床风险控制措施,例如临床研究方案中起始剂量的确定、安全性监测重点、针对性的随访计划等。
3.1.4 研究方案的设计与实施评估在研究方案审查过程中,应审慎考量研究立题依据、研究设计、干预手段、研究参与者入排标准、结局指标及风险管理措施等内容。立题依据:需充分考虑细胞治疗产品的设计原理、作用机制、目标适应证概述及产品在目标适应证中的潜在优势与临床定位等,研究的开展需兼顾社会价值(如所研究疾病目前无有效的治疗方法或现有治疗方法不可及或所研究产品明显优于现有治疗手段等)和科学性(包括临床前研究结果可靠性、细胞制备和质控、研究的设计等)的评估。研究设计部分应当按照PICOs原则进行逐个审查:研究对象一般应当是标准二线治疗失败的患者,若研究对象为儿童或青少年人群,则在开展研究前,应获得同一研究产品来自成人的安全性和耐受性数据。剂量设置:细胞治疗产品的剂量制定需要考虑产品的特定属性,如细胞类型和来源、转导效率、单个细胞的载体平均拷贝数和细胞活力、效价和生物学活性等。在方案审查时需要格外注意细胞治疗产品的给药方式、剂量及间隔是否有详细的论证依据(例如参考临床前研究报告或其同类型产品)。首次用于人体的细胞治疗产品通常建议采用单次给药方案,但若有证据提示安全性风险较低且多次给药可能增加活性时,也可进行多次给药。为避免多个研究参与者同时暴露而出现安全性风险,应间隔给药,间隔期的选择一般基于非临床研究中急性或亚急性毒性的发生情况、细胞在体内的活性持续时间和(或)既往类似产品在人体中的应用经验。对于像瘤内注射、单采这样复杂的给药程序,建议研究团队提供书面的SOP和培训,提高操作人员的熟练度,减少个体差异。对于特殊的操作步骤,如细胞单采、制备和回输,需要关注整个过程给研究参与者带来的风险,包括单采技术的培训、管理和告知,制备失败如何处理,以及细胞输入过程中相应的预处理和急性不良反应的管理。对照设置:一般情况下,探索性研究以观察安全性为主,但如果合并用药可能影响研究产品的不良反应观察,或者在早期探索性研究中初步观察产品活性,可考虑设置对照。结局指标设置:探索性研究中主要结局指标为安全性和耐受性,例如CRS、ICANS,长期或迟发性不良反应,外源基因随机整合到细胞基因组形成插入突变,导致成瘤性和恶性转化等; 次要结局指标可以是有效性,包括体内活性和临床终点相关的指标。临床疗效终点指标的设置要能直接反映临床获益,且其评价标准须与适应证相关的诊疗指南或临床共识保持一致,可考虑采用包含临床症状改善或生活质量提高的复合终点,或增加免疫相关的临床疗效评估方法,帮助准确评估临床疗效,但通常不作为支持上市的主要依据。临床终点还应关注疗效的持续时间,应长期随访以获得缓解持续时间(during of response, DOR)、中位无进展生存期(progression free survival, PFS)、总生存期(overall survival, OS)等反映产品有效性持续时间的指标。风险管理措施:应对细胞产品质量控制、临床研究质量控制、不良事件处理预案等进行审查。
3.2 伦理审查要点细胞治疗产品的伦理审查应先行确认学术委员会审查结果,而后对以下要点进行评估。
3.2.1 风险/获益评估伦理审查委员会应按要求对研究风险获益、研究风险的性质程度与发生概率、风险管控措施等进行讨论和评估。
风险评估:细胞治疗临床研究风险的评估首先应当重点关注来自供体的组织或细胞采集过程是否符合伦理要求,以及对供体遗传及感染性疾病筛查的过程要求等; 其次,审查产品自身的潜在不良反应,如免疫排斥、移植物抗宿主病、细胞的植入、CRS、ICANS、致瘤性、促瘤性等; 此外,也要对研究疾病的严重程度、伴随治疗需要等进行评估。对于上述风险,应当对下述内容进行严格审查:(1)细胞来源、细胞产品制备、细胞运输和储存条件、细胞产品的放行标准、冻存后复苏的质量检测; (2)细胞治疗技术的临床前研究结果的可靠性; (3)治疗疾病指征的把控和研究对象的选择; (4)细胞治疗的常见不良反应和研究干预措施导致的其他不良反应; (5)研究过程中的研究参与者安全和研究质量管理; (6)试验性治疗结束后研究参与者的长期跟踪随访; (7)研究数据长期储存并可追溯等。
获益评估:临床前药效学研究或同类型产品临床研究结果或作用机制角度提示确有可能获益,且所研究疾病目前无有效的治疗方法或现有治疗方法不可及,从产品作用特点、疾病严重性和病情进展等多个因素综合考虑,并且获益应优于其他可及的治疗手段。
3.2.2 治疗疾病指征和研究参与者的选择细胞治疗产品一般有长期效应,而且可能涉及侵入性给药,临床试验一般不纳入健康研究参与者。通常来说,肿瘤早期临床试验的受试人群会选择标准治疗失败的晚期患者,但细胞治疗通常对疾病负荷较低、自身免疫功能较好的患者疗效更好、安全性更高。因此,无论是中国CDE还是美国FDA的指南,都提示细胞治疗早期临床试验通常但不是必须选择疾病严重的晚期患者。在某些情况下,如果产品在前期的研究中显示安全性可控,而且病情较轻的患者获益潜力更高,那么甚至可以选择辅助治疗期的患者来开展早期的临床试验。细胞治疗早期临床试验的研究参与者选择需要谨慎进行,对于预期毒性大、制备周期短、发挥效应快的产品,一般选择标准治疗失败的晚期患者; 反之,预期较安全、制备周期长、发挥效应慢的产品,可以考虑早期病情较轻的患者。
3.2.3 研究参与者招募只有确认在基于充分的科学性理由,并能从中获益时,研究参与者才被招募。研究机构不得发布或变相发布细胞治疗临床研究广告,建议可由非主诊或主管医生进行招募,整个招募过程应公平公正地开展。
3.2.4 知情同意在确认知情同意书应包含我国相关法规指南要求的基本要素之外,应着重充分告知的信息包括但不限于:(1)研究风险,包括细胞治疗的常见不良反应、其他干预措施的潜在不良反应等; (2)风险的应急处理预案; (3)医疗保护措施; (4)研究结束后对研究参与者继续提供试验性治疗的计划安排等。
应确认知情同意书用通俗易懂的语言告知研究参与者所参加研究的目的、意义、内容、预期获益和潜在风险等信息,不应使用诱导性语言,应使用客观数据对前期研究的疗效和安全性进行表述,并应对涉及弱势群体的研究项目采取保护措施。
伦理审查委员会可对细胞治疗类高风险研究的知情同意过程开展实地访查,确保研究参与者充分理解和知晓研究相关具体信息,充分了解研究风险,自愿选择是否参加研究。
3.2.5 参与者的医疗和保护措施细胞治疗产品毒性的管理有其特殊性。细胞治疗具有免疫原性和长期效应,即便检测方法还未建立,也应当留取血液标本监测免疫反应; 还应该通过血液甚至活检组织的基因表达、生物标志物等药效学指标评估细胞治疗的持续性效应。细胞治疗需关注迁移性、异位组织形成、异常细胞活动等问题。此外,还要关注细胞因子风暴、脱靶反应等特殊毒性。因此,从伦理审查角度,细胞治疗的早期临床试验需要制定非常严格的风险管控预案,甚至研究暂停的标准,以便进行及时的风险评估。在审查研究参与者的医疗与保护措施时,须特别关注因研究引发的损害、残疾或死亡情况,确保有保险和(或)赔偿计划,同时对因研究目的而未提供标准治疗的理由、补偿和支付计划的合理性进行重点审查。
3.2.6 过程管理的审查要点研究过程中的定期跟踪审查频率宜增加,必要时采取完成1例即向伦理审查委员会报告; 应提醒研究者在研究过程中如发生严重不良事件和偏离事件等,应按要求及时报告相关部门和委员会; 应确认研究结束后对研究参与者进行长期随访监测,评价细胞治疗临床研究的长期安全性和有效性。若在随访中发现问题,研究者应及时报告机构学术和伦理审查委员会,并及时进行医学处理。
4 小结细胞治疗领域IIT研究数量迅速攀升的背后,一方面是新兴行业快速崛起带来的机遇和创新动力,另一方面细胞治疗产品使用风险的不确定性也使监管机构、临床研究管理部门和伦理审查部门面临巨大压力。本研究为监管部门、细胞治疗临床研究管理部门、伦理审查部门在医疗机构发起细胞治疗研究的管理提出了若干实操建议,以期推动细胞治疗领域IIT研究项目管理能力和审查质量的提升,确保细胞治疗产品生产符合GMP,研究质量符合GCP,为细胞治疗产品申请注册临床试验提供高质量证据,加速细胞治疗产品上市前审评。在此研究基础上,未来仍需积极探索细胞治疗领域IIT研究管理路径和模式,更好助力该领域临床研究的项目管理及伦理审查能力建设,强化医保、卫健、药监等政府部门,产业界,临床研究机构与前沿技术之间的互信互认,打通技术向应用实践转化的壁垒,从而更好服务细胞治疗生物医药产业的良性快速发展。
| [1] |
王广基, 王越, 李洁, 等. 国外细胞治疗产品监管体系介绍及对我国的启示. 中国食品药品监管, 2023(09): 6-13. |
| [2] |
ASGCT. Gene, Cell, & RNA Therapy Landscape Report [EB/OL]. [2025-05-14]. https://www.asgct.org/publications/landscape-report/2024
|
| [3] |
Yin C, Gao J, Li G, et al. Gene and cell therapies in China: booming landscape under dual-track regulation. J Hematol Oncol, 2022, 15: 139. DOI:10.1186/s13045-022-01354-9 |
| [4] |
Lu C, Xu J, Mei H. The mechanisms and salvage treatment strategies underlying positive relapse following CD19 CAR-T cell therapy in B-acute lymphoblastic leukemia. Zhonghua Xue Ye Xue Za Zhi, 2024, 45: 970-6. |
| [5] |
上海市经济和信息化委员会, 上海市健康委员会, 上海市科学技术委员会. 关于印发《上海市促进基因治疗科技创新与产业发展行动方案(2023-2025年)》的通知[EB/OL]. (2023-09-19)[2025-04-30]. https://www.shanghai.gov.cn/nw12344/20230919/156c4c9972bf402ab8e6b0e70ab93383.html.
|
| [6] |
国家卫生计生委, 食品药品监督总局. 关于印发干细胞临床研究管理办法(试行)的通知[EB/OL]. (2015-07-20)[2025-04-30]. http://www.nhc.gov.cn/qjjys/s3581/201508/28635ef99c5743e294f45e8b29c72309.shtml
|
| [7] |
国家食品药品监督总局. 《细胞治疗产品研究与评价技术指导原则》[EB/OL]. (2017-12-18)[2025-04-30]. https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20171222145101557.html
|
| [8] |
国家卫生健康委. 医疗卫生机构开展研究者发起的临床研究管理办法(试行) [EB/OL]. [2025-04-30]. https://www.cqcdc.org/index.php?a=shows&catid= 2260&id=2852
|
| [9] |
国家卫生健康委. 关于体细胞临床研究工作指引(征求意见稿)公开征求意见的公告[EB/OL]. (2023-05-09)[2025-04-30]. https://www.nhc.gov.cn/wjw/yjzj/202305/809ba0c508b84279aef7c1fb47ecf2a9.shtml
|
| [10] |
赵培培, 温宝书. 国内外细胞和基因治疗药品监管研究. 中国药物警戒, 2024, 21: 1019-24. |
| [11] |
FDA. Parl271-human cells, tisses, and cellular and tissue-based peodacts[EB/OL]. [2025-04-30]. https://www.ecfr.Gov/curenttitle-2l/chapter-Ⅰ/subchapser-Ⅰ/part-1271
|
| [12] |
European Union. Regulation (EC) No 1394/2007 of the European Parliament and of the Council of 13 November 2007 on Advanced Therapy Medicinal Products and Amending Directive 2001/83/EC and Regulation (EC) No 726/2004[EB/OL]. (2007-10-12)[2025-04-30]. https://eur-lex.europa.eu/eli/reg/2007/1394/oj
|
| [13] |
厚生劳动省. 再生医療等の安全性の確保等に関する法律(平成25年11月27日法律第85号)[EB/OL]. [2025-04-30]. https://www.mhlw.go.jp/web/t_doc?dataId=80ab3649&dataType=0&pageNo=1
|
| [14] |
谢金平, 王艺霏, 杨伊凡, 等. 美欧日细胞和基因治疗产品IIT和IST管理制度的关联性研究及对我国的启示. 中国食品药品监管, 2024(09): 90-103. |
| [15] |
国家药监局药审中心. CDE发布《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》[EB/OL]. (2023-06-21)[2025-04-30]. https://www.cde.org.cn/main/news/viewInfoCommon/f82a0fee1e625a1a3834a93cee3836c7
|
 2025, Vol. 37
2025, Vol. 37 

 伍蓉,社会医学与卫生事业管理研究员。1989年毕业于原上海医科大学公共卫生学院,同年进入复旦大学附属华山医院工作,现任华山医院副院长。2005年受WHO资助赴美国西部伦理委员会(WIRB)培训,同年赴哈佛大学进行医院管理培训。牵头制定上海市地方标准《涉及人的生物医学研究伦理审查规范》(DB31/T899-2015),在全市二三级医疗机构伦理委员会推广实施。现兼任中华医学会医学伦理学分会副主委、全国应用伦理专业学位研究生教育指导委员会委员、上海市医学伦理学会副会长、上海市研究型医院学会临床研究伦理专委会主委、上海市市级医院伦理协作审查联盟主任、上海市女医师协会常务理事以及上海市静安区人大代表等社会和学术职务。已获荣誉:作为第一位获奖者荣获1999年明治乳业生命科学管理奖; 2001年复旦大学十大医务青年; 2009年复旦大学“三八红旗手”; 2009、2010、2012年上海市科技与成果管理先进工作者; 2012年复旦大学“医学科研管理特别贡献奖”; 2015年上海医学会专科委员会优秀主任委员; 2017年上海医学伦理学会学术带头人
伍蓉,社会医学与卫生事业管理研究员。1989年毕业于原上海医科大学公共卫生学院,同年进入复旦大学附属华山医院工作,现任华山医院副院长。2005年受WHO资助赴美国西部伦理委员会(WIRB)培训,同年赴哈佛大学进行医院管理培训。牵头制定上海市地方标准《涉及人的生物医学研究伦理审查规范》(DB31/T899-2015),在全市二三级医疗机构伦理委员会推广实施。现兼任中华医学会医学伦理学分会副主委、全国应用伦理专业学位研究生教育指导委员会委员、上海市医学伦理学会副会长、上海市研究型医院学会临床研究伦理专委会主委、上海市市级医院伦理协作审查联盟主任、上海市女医师协会常务理事以及上海市静安区人大代表等社会和学术职务。已获荣誉:作为第一位获奖者荣获1999年明治乳业生命科学管理奖; 2001年复旦大学十大医务青年; 2009年复旦大学“三八红旗手”; 2009、2010、2012年上海市科技与成果管理先进工作者; 2012年复旦大学“医学科研管理特别贡献奖”; 2015年上海医学会专科委员会优秀主任委员; 2017年上海医学伦理学会学术带头人