(2 北京大学前沿交叉学科研究院,定量生物学中心,北京 100871)
(2 Center for Quantitative Biology, Academy for Advanced Interdisciplinary Studies, Peking University, Beijing 100871, China)
细胞因子是一类由免疫细胞和基质细胞分泌的小分子蛋白,它通过自分泌、旁分泌或内分泌的通讯方式在免疫应答、炎症反应和组织稳态维持中发挥核心作用[1-3]。从分子机制层面来看,细胞因子信号通路的激活依赖于其与特异性受体的结合,主要涉及三类受体家族:I型细胞因子受体(如白细胞介素2受体)、Ⅱ型细胞因子受体(如干扰素γ受体)和TNF受体超家族。其中,I/Ⅱ型受体通常不具有内源性激酶活性,需依赖JAK (Janus激酶)家族蛋白进行信号转导。当细胞因子与受体结合后,诱导受体二聚化或寡聚化,进而激活JAK并促使受体胞内段的酪氨酸残基磷酸化,进而招募并激活STAT,活化的STAT形成同源或异源二聚体后转位至细胞核,调控靶基因表达(如促炎因子、抗凋亡蛋白等)[4, 5]。除JAK-STAT外,细胞因子还可激活MAPK、PI3K-Akt等通路,形成复杂的信号网络。人体中有超过200种细胞因子存在,其与下游激活信号的复杂组合是其在人体内生理功能多样性的核心基础[6, 7]。
细胞因子受体的人工设计技术一直是生物医药研发的前沿与热点。然而,细胞因子信号种类繁多,其下游的信号转导网络高度复杂,且往往涉及多种细胞类型之间的相互作用,使得其生理效应展现出多效、非线性的模式[8-11]。因此,尽管细胞因子是美国食品药品监督管理局(FDA)批准的第一类肿瘤免疫治疗药物,干扰素(IFN)-α于1986年获批,白细胞介素(IL)-2于1992年获批,但其研发及应用面临诸多障碍。细胞因子调节着一个具有多能性、多源性、多终端性和多模态性的复杂信号网络,容易产生各种副作用,且治疗窗口狭窄,这使得天然细胞因子在历史上除了极少数情况外,都不适合作为药物候选[12, 13]。
随着人们对细胞因子-受体相互作用的结构原理和信号转导机制的深入了解,通过蛋白质工程和合成免疫学手段对细胞因子信号进行人工改造已成为一种越来越可行且强大的方法。通过蛋白质从头设计、构建融合蛋白、对受体进行模块化重组、设计核酸类细胞因子类似物以及构建合成细胞因子线路(cytokine signaling circuit)等方式,将有望延长细胞因子的半衰期,提高其亲和力与靶向性,以及下游生理反应的可编程性(programmability)(图 1)。在本文中,我们将探讨设计、构建和改进细胞因子及受体的通用策略,并特别强调了合成细胞因子与受体系统以及构成的合成网络在治疗应用方面的不断拓展,以及当前在临床转化过程中所面临的挑战。
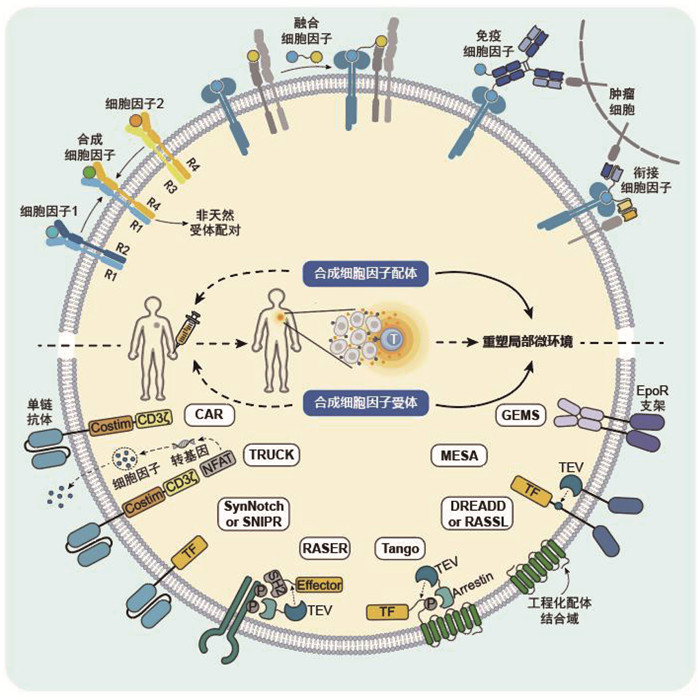
|
通过改造细胞因子信号,为免疫细胞(特别是T细胞)赋予更持久的杀伤与增殖潜能,以及对免疫抑制微环境更好的抵抗能力。对细胞因子信号系统的改造可以分为改造配体、改造受体、设计核酸细胞因子类似物和改造信号线路四类。 图 1 细胞因子信号系统的合成生物学改造 |
细胞因子作为天然免疫调节分子,因其调控免疫细胞活化、增殖和分化的能力备受关注[14-16]。为克服天然细胞因子在临床应用中的局限,细胞因子人工改造技术应运而生,包括将细胞因子与功能蛋白融合、结构域优化、从头设计细胞因子等技术。本文将该类非天然细胞因子统称为合成细胞因子。以下从细胞因子-抗体融合蛋白(cytokine-antibody fusion protein)、双特异性受体激动剂(bispecific cytokine receptor agonist)及合成类似物(synthetic cytokine mimics)三个方面,综述其设计与应用进展。
2.1 细胞因子-抗体融合蛋白传统细胞因子在体内的靶向性不足和半衰期过短的问题制约了相关药物的临床应用。为了克服这些技术难题,研究者将细胞因子与抗体的结构域进行融合,设计出独特的细胞因子-抗体融合蛋白。通过将细胞因子与抗体的Fv段融合,可以将细胞因子递送至肿瘤微环境,增强抗肿瘤免疫反应并降低全身毒性(图 2A)。如抗4-1BB-IL-15融合蛋白通过耗竭调节性T细胞(Treg细胞)和扩增CD8 T细胞来改善肿瘤控制[17];LH01 (抗PD-L1抗体与IL-15复合体)克服了PD-L1阻断治疗的耐药性,其延长的半衰期和肿瘤靶向能力也使其在冷肿瘤和耐药肿瘤治疗中具有巨大潜力[18];αPD1-mIL12mut2通过抗PD-1抗体顺式递送IL-12,靶向PD-1+ CD8+ T细胞,在小鼠肿瘤模型中显著抑制肿瘤生长[19]。这些融合蛋白通过精准靶向和半衰期优化,显著提升了抗肿瘤疗效和安全性。
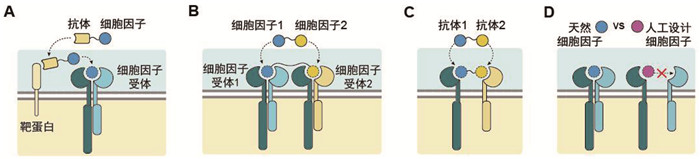
|
A:构建抗体-细胞因子融合蛋白,实现对特定细胞的选择性激活;B:将不同细胞因子进行串联,从而激活天然条件下不存在的下游信号组合;C:利用多效价抗体诱导细胞因子受体的聚集,产生全新的信号激活谱;D:通过从头设计细胞因子蛋白,定量调控其与受体蛋白的亲和力 图 2 合成细胞因子信号配体的设计 |
另一方面,将细胞因子与抗体Fc段融合可显著延长半衰期(从几小时至数周)。例如,SumIL-2通过突变IL-2与Fc融合,选择性激活CD8+ T细胞而非Treg细胞,这种靶向设计不仅可提高治疗效果,还降低了全身毒性[20]。Nemvaleukin通过环状置换IL-2与IL-2Rα (白细胞介素-2受体α亚基)链融合,优先激活记忆CD8+ T细胞和NK细胞[21]。在III期ARTISTRY-7 (NCT05092360)试验中,单独使用该药物或与pembrolizumab联合使用均可改善铂类耐药卵巢癌(PROC)和其他晚期肿瘤患者的预后[22]。Fc-IL-4[23]与IL-10-Fc[24]融合蛋白通过增强细胞代谢能力实现长期疗效。
2.2 双特异性细胞因子受体激动剂上文将细胞因子与抗体结构域融合的技术手段,虽然可以增强细胞因子的特异性或延长其半衰期,但其产生的信号仍然是传统的天然细胞因子信号。而双特异性细胞因子受体激动剂通过诱导非天然受体二聚,可以产生有别于天然信号的独特下游激活谱(图 2B)。例如斯坦福大学K.Christopher Garcia课题组提出的Synthekine设计,通过将不同细胞因子与受体的结合界面进行串联,人工重构出新型细胞因子,从而诱导产生天然不存在的受体二聚形式,扩展了细胞因子的功能[25, 26]。此外,也有研究者直接将两种细胞因子整体进行串联,比如IL4-10融合蛋白(70 kDa的糖基化二聚体)能够促进IL-4和IL-10受体形成更大范围的聚集,相比同时施加两种细胞因子产生更显著的协同效应,用于调节神经炎症反应,突破单一细胞因子局限[27]。IL-7-IL-15融合蛋白在小鼠模型中比单一细胞因子表现出更高的抗肿瘤活性,得益于更长的半衰期和差异化免疫效应[28]。此类设计通过重塑信号通路,为神经炎症和肿瘤治疗提供了创新策略。
2.3 合成细胞因子类似物通过串联细胞因子结构域的手段可以人为设计细胞因子下游信号激活谱,但其仍然依赖于天然细胞因子来源的基本元件。而合成细胞因子类似物通过突变筛选、定向进化或从头设计等方式,可以更加定制化地调控受体二聚体的几何结构以优化信号转导,从而弥补天然细胞因子缺陷(图 2C)。例如,通过噬菌体展示技术筛选的IL-7Rα (白细胞介素-7受体α亚基)和γc受体亚基结合肽段,组装成异源二聚体以延长其半衰期并显著扩增干细胞样记忆T细胞,具有较低的免疫原性[29]。Baker团队[30]利用计算设计开发新型IL-2和IL-15模拟物(Neo-2/15),结构上异于天然IL-2和IL-15,但特异性结合IL-2受体βγc异二聚体(IL-2Rβγc),避免与IL-2Rα和IL-15Rα (白细胞介素-15受体α亚基)相互作用,在多种癌症模型中展现更优的疗效和更低的毒性。这些类似物通过结构创新和精准信号调控,为癌症免疫治疗提供了高效低毒的新选择。
以上工作表明,通过合成生物学手段对细胞因子配体进行改造,可以有效改善传统细胞因子疗法靶向性差、半衰期短、易引发全身毒性等问题。但人工设计细胞因子蛋白目前仍面临一定挑战:首先,全新从头设计的蛋白质可能具有免疫原性,距离临床水平的应用仍有较大差距;其次,通过将细胞因子与抗体结合来提高靶向性的方法常面临靶标选择的问题,如何选择高度特异性的靶标选择性地激活某一特定类型的细胞,目前领域内仍罕有公论;最后,由于细胞因子受体的激活机制复杂,涉及受体二聚/多聚、受体蛋白的取向,甚至胞内JAK/STAT激活识别特异性的问题,设计新型细胞因子、人为创造新的受体激活组合往往需要高通量的筛选而非简单理性设计,耗时冗长,难以进行规模化的推广。因此,后续研究通过设计核酸类细胞因子模拟物、人工改造细胞因子受体、设计细胞因子调控线路等方式进一步拓展对细胞因子信号系统的改造能力。在接下来的小节中,我们将对这三类技术手段分别进行概述。
3 核酸类细胞因子模拟物近年来,核酸适配体(aptamer)作为新型分子识别工具,成为开发具有类细胞因子功能的分子替代工具与技术。与传统融合蛋白药物相比,核酸适配体展现出显著优势:其完全化学合成的特性避免了免疫原性风险,具有优异生物安全性;独特的分子结构赋予其卓越的热稳定性与可逆变性能力,在复杂生理环境中仍能保持结构完整性[31]。此外,适配体可通过固相合成实现标准化生产,批次间差异极小,并支持灵活的功能化修饰而不影响活性。这些特性结合核酸分子的可编程性,使适配体能够通过理性设计构建多功能复合体系,精准改造细胞因子信号激活谱[32]。这一独特优势为后续信号调控和治疗奠定了坚实基础,引领了精准医学的新方向。一般而言,核酸适配体通过指数富集配体系统进化(SELEX)技术获得,首先筛选靶向特定受体的单链寡核苷酸(20~60 nt),进而利用分子工程构建单价、二价以及多价复合结构,以模拟细胞因子的功能[33]。以下将对三类核酸适配体及其临床应用场景分别进行论述(表 1)。
| 表 1 核酸适配体细胞因子模拟物设计与应用 |
单价适配体是核酸类细胞因子模拟物最简单的形式。由于细胞因子信号的激活必须依赖两种或两种以上受体的二聚和多聚,单价适配体不能满足要求,因此其应用场景多为通过与受体单链的竞争性结合从而抑制相关信号的激活。在肿瘤免疫治疗中,智能响应型适配体递送系统为免疫检查点阻断疗法(ICB)带来了新思路。Zhang等[34]针对CTLA-4/B7以及PD-1/PD-L1通路设计了响应性双靶点DNA水凝胶。Wu等[35]则针对新型免疫检查点唾液酸结合免疫球蛋白样凝集素-15 (Siglec-15)开发了适配体介导的阻断策略(Ap-ICB)。通过阻断Siglec-15与T细胞互作,激活T细胞并在转移性乳腺癌小鼠模型显著提升CD8+ T细胞浸润量及抑制肿瘤转移,为克服ICB耐药性提供了新方案(图 3F)。
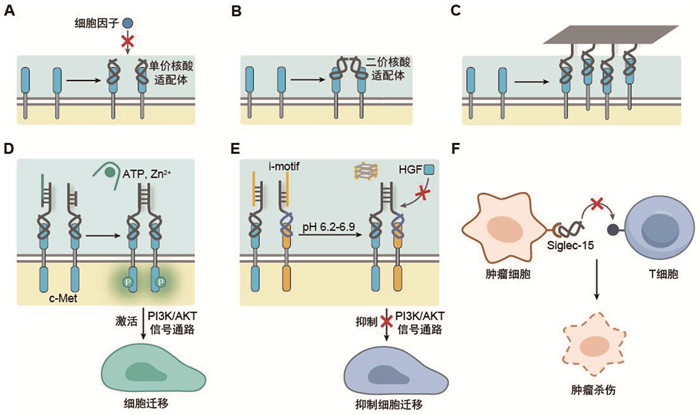
|
A:基于单价适配体阻断细胞因子信号;B:基于二价适配体模拟细胞因子的生物功能;C:基于DNA折纸的适配体纳米阵列实现人工诱导的受体信号激活;D:基于DNA纳米机器实现多种外部信号触发的受体信号激活;E:基于细胞外pH(epH)驱动的DNA纳米装置阻断HGF/c-Met信号通路,抑制肿瘤转移;F:基于核酸适配体的免疫检查点Siglec-15阻断策略用于癌症免疫治疗 图 3 基于核酸适配体编程细胞因子信号 |
通过将多个单价适配体进行耦合,研究者可以构建二价乃至多价的核酸适配体,从而执行诱导激活细胞因子下游信号的功能。例如,Ueki等[36, 37]构建的二价适配体能精确模拟HGF功能并特异性激活FGFR1 (图 3A、3B)。在组织再生医学领域,适配体的功能模拟特性展现出独特的病理微环境重建能力。Zhu等[38]设计的环状DNA激动剂(cDA),通过持续激活MET受体并增强血管生成,结合透明质酸凝胶显著加速了糖尿病溃疡小鼠模型的伤口愈合和血管形成。Cong等[39]开发了一种基于二价适体的EGFR信号DNA激动剂,在体内有效缓解溃疡性结肠炎,展现出优异的组织修复调控能力。在多价适配体方面,Wang等[40]开发的DOTA纳米阵列则可编程调控RTK寡聚化,实现人工信号激活(图 3C)。随着技术进步,适配体组装策略已从同源多聚化向异源协同方向演进。研究者们通过设计多价适配体(如二价、三特异性复合物),实现了对受体信号通路的协同调控及多靶点免疫激活,显著提升了抗肿瘤等治疗效果[41, 42]。
3.3 利用动态适配体实现环境依赖性响应核酸适配体在精准治疗领域的突破性进展为肿瘤免疫治疗、组织再生医学及自身免疫疾病管理提供了全新可能性。为克服传统静态激活策略因信号持续输出导致的脱靶效应,动态响应型核酸适配体应运而生,开创了“环境适应-按需激活”的调控新机制。Nie团队开发了一种基于DNA纳米机器的受体非遗传改造策略,通过DNA纳米技术赋予细胞膜表面受体对化学小分子、离子[43]、气体分子[44]、机械力响应性[45]等外部信号的响应性(图 3D)。Chen等[46]利用核酸适体识别和DNA逻辑驱动细胞膜受体组装,实现了活细胞内源性膜受体的可编程化调控。Yuan等[47]开发了一种细胞外pH(epH)驱动的DNA纳米装置,通过酸性环境诱导的动态变构重组,促进c-Met和TfR寡聚化,阻断HGF/c-Met信号通路以抑制肿瘤转移(图 3E)。这些动态调控技术的突破,不仅提升了信号调控的时空精准性,也为疾病治疗中的靶向干预提供了新策略。
核酸适配体通过精准复现受体激活机制与动态调控系统的智能设计,正推动精准医学从“替代治疗”到“超越天然”的新阶段(图 3F)。核酸适配体技术在精准医学领域展现巨大潜力,但其技术路径本身也存在一定问题,主要受限于筛选效率低、体内稳定性不足、脱靶效应、生产成本高、临床转化缓慢及跨学科整合难度等瓶颈。SELEX筛选耗时长,复杂靶点亲和力优化困难;适配体易被核酸酶降解,递送效率低;多价结构设计虽增强功能,却可能引发非特异性信号激活;复杂结构的化学合成成本高,规模化生产面临挑战;临床验证数据匮乏,监管要求严格。未来需通过高通量筛选技术、新型递送载体、动态调控优化、成本控制、临床研究加速及跨学科协作,突破这些限制,推动适配体成为复杂疾病治疗的主流工具。
4 重组细胞因子信号受体的人工设计细胞因子疗法的创新需突破配体与受体的双重限制。传统基于细胞因子的改造虽通过模块化改造改善了部分性能,但仍面临免疫原性增强和治疗窗口狭窄的挑战[48]。近年来,研究重心逐渐转向细胞因子受体的人工改造,基于其信号多效性和复杂性,人工设计主要可分为自激活受体(self-activating receptors)、正交化受体(orthogonal receptors)和信号转换受体(signal converting receptors)三大类。这些策略通过精准调控信号通路,为免疫治疗和再生医学提供了新的可能性。
4.1 具有自激活能力的重组细胞因子受体自激活受体通过分子内相互作用绕过天然配体依赖,从而实现持续稳定的下游信号激活,旨在为免疫细胞提供独立于外源细胞因子的增殖支持(图 4B)。Shum等[49]通过在IL-7受体跨膜段引入二硫键形成共价链接,构建了一种持续激活的IL-7同源二聚受体,该受体使CAR-T细胞无需外源IL-7即可自主增殖,显著提升其在体内低IL-2环境中的长期抗肿瘤能力。类似地,Zhu等[50]将跨膜突变技术应用于IL-21受体,实现在无外源IL-21的情况下激活STAT3信号通路。这种设计使TCR-T细胞表现出更强的扩增能力和杀伤效果,同时保持初始分化状态和较低的耗竭水平。
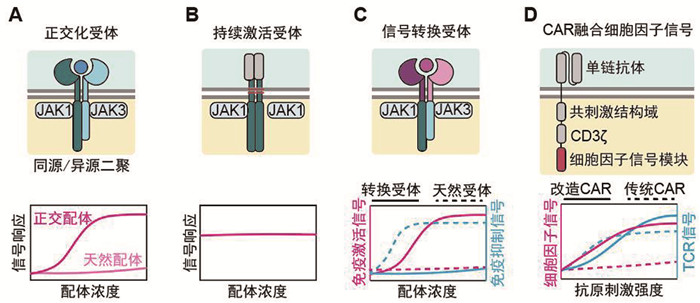
|
A:构建正交化受体,使细胞因子信号的激活独立于天然配体;B:在跨膜段通过二硫键形成共价链接的持续激活受体,使下游信号持续存在;C:构建信号转换受体,将免疫抑制性细胞因子的下游信号转为免疫激活信号;D:将细胞因子受体的信号模块直接串联在CAR分子上,使细胞因子信号与抗原信号偶联 图 4 重组细胞因子信号受体的设计类型 |
为进一步扩展设计灵活性,Bell等[51]利用亮氨酸拉链EE/RR系统替换异源二聚体受体的胞外域,开发出ZipRs受体,能够持续激活JAK/STAT信号通路。ZipRs整合了γc家族受体(如IL-2R、IL-7R、IL-21R和IL-12R)的胞内信号域,显著提升CAR-T细胞的抗肿瘤效果,同时避免了过度增殖和系统性毒性。其模块化设计支持适配多种受体家族,为优化免疫细胞疗法提供了通用平台。此外,Righi等[52]开发了一种新型重组受体(dFab_CCR),通过将细胞因子受体的跨膜和胞内结构域与抗体IgG1的CH1和轻链恒定区(KLC)融合,实现受体异源二聚化和组成性信号激活。dFab_CCR在IL-2、IL-18和GM-CSF受体等家族中表现出普适性,与CAR共表达时显著提升了CAR-T细胞的扩增能力、持久性和抗肿瘤活性。这些自激活受体的多样化设计展示了其在增强免疫细胞功能和适应性方面的潜力,为后续正交化调控奠定了技术基础。
4.2 正交化激活的重组细胞因子受体虽然自激活受体能够促进工程化免疫细胞的体内增殖与生存,但其持续信号激活往往会导致功能不可控和安全隐患。因此,另一种技术手段是通过设计正交化受体-配体对实现可控激活(图 4A)。该设计的核心在于构建仅响应人工配体的受体,避免内源性信号干扰。Garcia团队[53]开发的正交化IL-2/IL-2Rβ系统(ortho-hIL-2/hIL-2Rβ)是代表性案例,通过将IL-2Rβ的His134突变为Asp和将Try135突变为Phe,破坏与野生型IL-2的结合界面,但保留与人工orthoIL-2的结合能力。该系统选择性激活表达ortho-hIL-2Rβ的CAR T细胞,减少对野生型T细胞的非特异性刺激,从而降低毒性。在小鼠白血病模型中,ortho-hIL-2显著提高了CAR T细胞的扩增和疗效,甚至在低剂量或复发性治疗中表现出挽救潜力[54]。基于此,Kalbasi等[55]进一步设计了正交IL-9受体,通过增强STAT3信号激活和记忆表型形成,提升CAR-T或TCR-T细胞的长期抗肿瘤效果。此外,研究者通过将细胞因子受体胞外段改造成单链抗体并结合特定抗原激活,筛选出促进造血干细胞增殖的信号域组合[56]。正交化系统的精准控制特性,不仅提高了治疗的安全性和特异性,还为个性化免疫细胞调控提供了新工具。
4.3 利用重组受体调控内源细胞因子信号无论是引入持续信号或正交信号,对受体进行改造的主要目的都是摆脱对天然细胞因子的依赖,因此,这些改造的对象主要是受体的胞外和跨膜结构域。与此相对地,研究者还可以对受体的胞内段进行改造,设计信号转换受体。这种受体旨在通过改变天然细胞因子对下游信号的激活种类或强度,从而逆转肿瘤免疫抑制微环境(图 4C)。早期研究聚焦于IL-4受体改造,如Leen等[57]将IL-4受体胞外段与IL-7受体胞内段嵌合,Zhou等[58]将其与IL-15受体胞内段嵌合,Wang等[59]将其与IL-21受体胞内段嵌合,将IL-4的免疫抑制信号转化为激活信号,显著改善T细胞抗肿瘤效果。类似地,也有研究者将GM-CSF受体胞内段替换为IL-18受体胞内段,进一步提升CAR-T细胞的持久杀伤能力[60]。基于类似理念,模块化细胞外传感器架构(modular extracellular sensor architecture, MESA)[61]和通用细胞外分子传感器平台(generalized extracellular molecule sensor, GEMS)[62]进一步扩展了信号调控的灵活性。最后,还有研究者将IL-2R胞内信号域与anti-CD19 CAR融合,构建新型嵌合CAR分子,在抗原刺激时激活STAT5信号,增强T细胞的生存和抗肿瘤效能[63]。Sakunrangsit等[64]则设计了携带短链IL7Rα胞质结构域(IL7R-S)的B7H3 CAR-T细胞,展现出优异的性能(图 4D)。
重组细胞因子信号受体的发展标志着合成免疫学的新篇章。自激活受体提供持续信号支持,正交化系统实现精准调控,信号转换受体拓展了信号通路的可塑性。这些技术已展现出从实验室到临床的转化潜力。然而需要指出的是,当前对于细胞因子受体的改造工作较为缺乏系统性,在不同的应用场景下,最优的细胞因子受体设计往往差异较大。持续信号激活与诱导信号激活之间孰优孰劣,当与不同的CAR-T共刺激结构域组合时,是否又会有不同的输出效果,回答这些问题需要深刻而定量地理解T细胞信号网络的设计原理,目前领域内尚无定论。此外,目前学界对于细胞因子受体的改造大多只将受体分成胞内/胞外两个基本单元,进而对这两个单元进行突变或重组。特别是对于受体胞内段,其往往存在着多个不同的信号蛋白结合基序,这些基序的重新排列组合是否扩大下游信号的可编程范围,进而优化CAR-T细胞的表现,目前虽然有部分工作做了初步尝试,但相关研究仍然处于起步阶段。随着蛋白质理性设计和大规模建库筛选与AI辅助分析的深度融合,下一代重组受体有望实现“按需定制”的细胞行为调控,为免疫治疗与再生医学带来革命性突破。
5 合成细胞因子信号线路的人工设计在前几节的内容中,我们对人工设计细胞因子受体、配体以及核酸类细胞因子模拟物的相关进展进行了概述。虽然这些工作在一定程度上可以解决当前细胞因子相关疗法面临的临床困境,但其改造对象还处于信号网络相当上游的层次。要实现复杂细胞行为的全面编程,需进一步聚焦于细胞因子下游调控网络的系统性设计。这主要包括改造细胞因子信号下游的基因表达输出、重编程细胞因子的分泌逻辑,以及利用细菌、新型材料等介质调控免疫细胞间的通讯网络等(表 2)。
| 表 2 合成细胞因子信号线路设计与应用 |
天然细胞因子信号下游主要是JAK/STAT信号通路,也包括PI3K、MAPK通路等。相关信号通路下游调控着成百上千功能基因的表达水平,因此对上游配体或受体的改造往往牵一发而动全身,难以做到针对某些关键功能基因的表达进行精确调节。为克服这一技术瓶颈,合成生物学家可以在细胞中引入人工设计的基因线路,构建新的基因调控关系。一个典型的例子是Schwarz等[61]利用前文介绍的MESA系统设计的信号调控线路。该线路可以使T细胞感知VEGF并触发IL-2分泌,将免疫抑制信号转化为免疫激活反应,展现了人工受体在重塑细胞功能中的突破性潜力(图 5A)。在自身免疫疾病领域,合成线路通过感知炎症信号(如TNF-α)按需生产抗炎分子(如TNF-α抗体),从而实现精准调控(图 5D)[65]。此外,近期研究者设计的合成膜内蛋白水解受体(synthetic intramembrane proteolysis receptor, SNIPR)作为SynNotch的进阶版本[66, 67],可感知肿瘤微环境中TGF-β或VEGF等信号并诱导CAR分子的表达。SNIPR的高度可定制化确保了抗肿瘤特异性,同时降低脱靶毒性,在动物模型中展现出高效且安全的治疗效果[66]。其模块化设计允许灵活调整信号域组合,适配多种治疗场景,标志着信号调控从单一通路向多维网络的跃迁(图 5C)。类似地,可编程抗原门控G蛋白偶联工程受体(programmable antigen-gated G-protein-coupled engineered receptors, PAGERs)通过响应用户定义的抗原(如生长因子、细胞因子和趋化因子),驱动多样化的细胞功能[68]。PAGERs的灵活性使其可适配多种信号输入,显著扩展了信号转导的应用范围。基于这些新型工程化受体平台的细胞因子信号线路将有望进一步优化信号转导的精确性,为构建复杂功能网络奠定了基础,预示着合成细胞因子系统向系统化、集成化方向的演进。
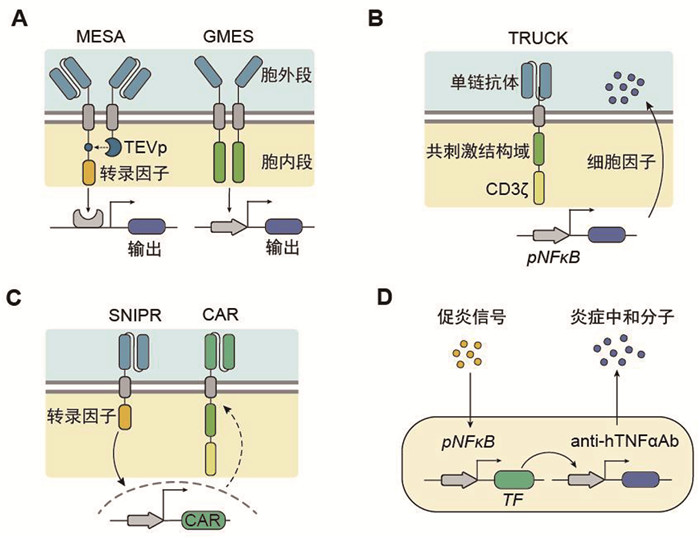
|
A:构建通用型细胞因子信号受体平台,可以实现对下游转录系统“即插即用”式的激活;B:构建抗原信号诱导的细胞因子分泌线路;C:构建受细胞因子信号诱导的CAR表达系统;D:构建可响应外界促炎信号,并依据信号强度分泌中和分子(抗体)的基因线路 图 5 细胞因子信号线路的设计与应用 |
细胞因子一方面作为外界刺激调控免疫细胞的行为,另一方面,许多免疫细胞也会在响应外界刺激时分泌种类各异的细胞因子。因此,通过构建合成线路,研究者不仅可以重编程细胞因子下游特定基因的表达,还可以重编程特定刺激条件下细胞因子本身的分泌模式。
最经典的条件依赖性细胞因子释放通常依赖于抗原刺激,利用CAR分子下游转录因子(如NFAT、NF-κB等)对应地诱导启动子表达细胞因子,从而提升CAR-T的功能持久性。例如,通过整合IL-15、IL-2[69]、IL-21、IL-7和IL-23[70]等细胞因子,合成线路可以有效促进CAR-T细胞的存活、增殖及长期抗肿瘤活性。重定向通用细胞因子杀伤T细胞(T cells redirected for universal cytokine-mediated killing, TRUCK)系统利用内源性IFN-γ启动子诱导表达IL-15,显著增强CAR-T细胞的抗肿瘤活性(图 5B)[71]。类似地,IL-12[72]、IL-18[73]和IL-36[74]的条件性表达可逆转肿瘤微环境的免疫抑制状态,营造有利于肿瘤杀伤的微环境。
此外,条件性表达趋化因子进一步优化了T细胞的归巢和渗透能力。CCL-19与IL-7的组合尤为有效。CCL-19吸引T细胞和树突状细胞,IL-7增强其存活和功能[75]。7×19 CAR-T细胞在临床前模型中展现出更强的肿瘤渗透能力和抗肿瘤活性。临床试验(NCT03258047)显示其诱导患者中位总生存期超过2年,且安全性可控[76]。这些抗原依赖性释放线路通过精准调控细胞因子表达,不仅提升了治疗特异性,还为克服实体瘤治疗难题提供了新策略,连接了信号调控与临床转化的桥梁。
5.3 基于非哺乳动物细胞的细胞因子信号线路为了实现对细胞因子通讯网络的精确调控与改造,除了直接向免疫细胞本身导入基因线路之外,还可以通过引入其他生物和非生物的介质对细胞因子信号通讯进行重编程。比如,许多研究利用厌氧细菌偏好在肿瘤微环境内部定植的特性,令细菌分泌具有免疫激活功能的细胞因子,如IL-2[77]、IL-18[78]等,从而提升T细胞的抗肿瘤活性。改造的沙门氏菌利用白细胞介素-10受体(IL-10R)的“迟滞非线性”特性,通过调控IL-10水平实现免疫逃逸与抗肿瘤效应的双重作用[79]。该设计诱导肿瘤相关巨噬细胞产生IL-10以躲避中性粒细胞吞噬,同时刺激耗竭CD8+ T细胞的增殖和活化,在小鼠模型中有效清除肿瘤并抑制转移。
跨学科研究进一步推动了肠道微生物群与细胞因子工程的融合。例如分泌IL-10的工程乳酸菌通过调控NF-κB通路,在动物模型中有效缓解结肠炎[80-82]。除细菌以外,研究者还可以利用具有生物活性的新型材料调控免疫细胞群体对细胞因子信号的应答,如通过3D生物打印技术构建RGD修饰的PLLA支架或IL-4功能化的仿生支架,优化骨损伤再生和免疫微环境重建[83]。这些可编程网络通过整合多学科技术,不仅提升了治疗精准性,还为癌症、炎症性疾病和组织再生提供了全新解决方案。
最后,需要指出的是,尽管合成细胞因子信号线路通过配体优化、受体工程和可编程网络设计为免疫治疗、组织再生及自身免疫疾病管理提供了突破性工具,其发展仍面临显著挑战。信号重编程的复杂性使SynNotch、MESA、SNIPR等模块化系统的设计与优化耗时且技术门槛高,通用性受限。在体内环境下,合成线路易受生理干扰,导致稳定性不足或脱靶效应,抗原依赖性释放可能引发非特异性免疫反应。复杂信号网络的系统性设计对计算模拟和实验验证要求极高,当前人工智能辅助设计的预测精度和泛化能力尚待提升。规模化生产成本高昂,工程菌和复杂受体的临床转化面临监管障碍和长期安全性验证难题。未来需优化模块化平台、增强体内稳定性、开发高效计算工具并加速临床研究,以突破这些瓶颈,推动合成细胞因子线路在精准医学中的广泛应用。
6 当前挑战与未来展望 6.1 现有技术的局限性从配体设计、受体改造到合成细胞因子线路,人工设计细胞因子信号系统如今已越来越成为免疫治疗领域一个富有前景的发展方向。利用合成生物学手段,人们可以提升或改变细胞因子的靶向能力,定制细胞因子的信号动力学和激活谱,甚至重构细胞因子下游基因调控关系和细胞因子的分泌逻辑。这些技术路径对细胞因子信号的改造相较于传统生物学而言具有更精确、更定量、更系统的特点,是系统生物学、合成生物学与传统免疫学交叉融合的范例(图 6)。
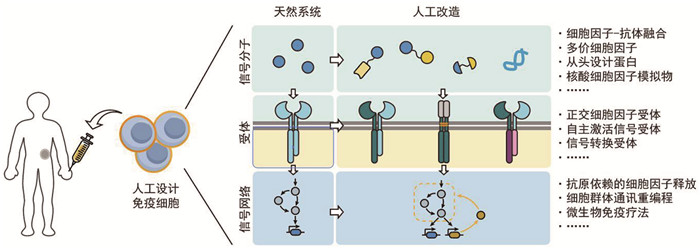
|
图 6 人工设计细胞因子系统的整体流程图 |
然而,尽管目前领域内相关研究已经取得了长足的进步,现有的技术路径仍然面临多种艰巨而复杂的挑战,距离临床应用仍然有较大距离。对于蛋白质类药物而言,首先,新合成的蛋白质必然面临免疫原性的问题;其次,人体内免疫细胞分型复杂、表面标志物的表达谱差异巨大,如何选择特异性的靶点使合成细胞因子靶向特定细胞目前还较依赖于逐一试错;再次,新型细胞因子蛋白或核酸适配体的设计与构建目前仍需高通量筛选获得,时间周期长,试错成本高,难以进行规模化推广。
对于工程化改造的活细胞药物而言,无论是单一改造受体,还是引入新的调控线路,目前大多数研究中采用的是基于慢病毒的转染系统,目的片段在基因组中的插入位置具有随机性,可能带来如细胞癌变等无法预知的安全隐患。工程化改造的细胞普遍缺乏有效的安全开关,特别是对于持续激活型的工程化细胞而言,容易造成细胞在体内的不可控扩增,从而带来安全问题。此外,工程化改造细胞成本高昂,向哺乳动物细胞中导入多个基因往往面临阳性率较低的问题,体内基因递送系统需要克服安全性和靶向性等挑战。这些因素都制约了工程化改造细胞的临床应用。
最后,目前所有对细胞因子信号的改造手段都需要进一步提升其系统性。例如,无论通过合成配体或合成受体,许多研究者都试图对细胞因子下游信号激活谱进行更加定量而精确的操控。然而,何种信号组合对免疫细胞的活性是“有益”的,信号组合、激活强度和动力学如何影响细胞下游的功能表型,目前相关的定量生物学研究仍然较为缺乏。这导致大量研究只能局限于其关注的个例情况进行单独优化,难以进行横向的比较、归纳提炼统一的调控规律和设计原理。细胞因子由免疫细胞分泌、免疫细胞接收,其所构成的非线性细胞间通讯网络在系统生物学层面上尚有大量未被阐明的调控逻辑,单独引入某一特定基因线路对通讯网络整体的影响是未知的,因而其后续推广也面临重重阻碍。为克服这些挑战,需要结合单细胞组学、动力学建模、高通量时序分析等多种前沿方法,结合理论分析,深化对于细胞因子信号网络的系统级认识,从而为人工设计提供更加坚实的基础。
6.2 临床转化现状与挑战合成细胞因子技术已在临床试验中取得初步进展。SumIL-2通过突变型IL-2与抗体Fc段融合,选择性激活CD8+ T细胞而非Treg细胞,显著降低毒性并延长半衰期。在I/Ⅱ期试验中,SumIL-2针对黑色素瘤和肾细胞癌的疾病控制率(disease control rate, DCR)超50%,但对“冷肿瘤”疗效有限,部分患者出现轻至中度细胞因子释放综合征。Nemvaleukin通过环状置换IL-2与IL-2Rα融合,优先激活记忆CD8+ T细胞和NK细胞。在Ⅲ期ARTISTRY-7试验中(NCT05092360),单药或联合pembrolizumab治疗铂类耐药卵巢癌,客观缓解率约15%,DCR超60%,但剂量依赖性毒性及实体瘤深层渗透问题仍需优化。7×19 CAR-T细胞通过抗原诱导的IL-7和CCL19表达增强T细胞归巢和持久性,在Ⅰ期试验中治疗复发/难治性大B细胞淋巴瘤,中位总生存期超2年,部分患者完全缓解,但实体瘤疗效和生产成本问题限制其推广。
细胞因子与CAR-T联合的临床试验进一步拓展了应用前景。IL-15装甲CD19 CAR-T在I期试验(NCT03721068)治疗B细胞淋巴瘤,客观缓解率约60%,但高剂量组有短暂骨髓抑制。IL-12分泌型MUC-16 CAR-T在Ⅰ期试验(NCT02498912)治疗复发性卵巢癌,DCR约50%,需优化剂量以降低发热等副作用。IL-18装甲CAR-T在I期试验(NCT04684563)针对实体瘤,DCR约55%,但20%患者出现轻度肝毒性。核酸适配体与CAR-T联合也取得进展,如靶向核仁素的AS1411在I/Ⅱ期试验(NCT00881244)联合CD19 CAR-T治疗急性髓系白血病,DCR约35%,但疗效受患者异质性影响。靶向CXCL12的NOX-A12在I/II期试验(NCT03168139)联合CAR-T治疗结直肠癌,DCR约50%,需优化剂量以降低肝毒性。这些试验表明,合成细胞因子联合CAR-T可显著增强抗肿瘤活性,但CRS、组织渗透和生产成本等问题需进一步解决。
以上初步临床试验结果表明,脱靶效应、肿瘤微环境复杂性、高昂的生产成本、监管标准缺失及患者个体化差异是制约合成细胞因子疗法进一步推广的主要挑战。未来,AI驱动的蛋白质设计、多模态联合疗法、DNA折纸等新型递送系统以及监管创新将加速技术优化,推动合成细胞因子疗法成为精准医学的核心支柱,为癌症、自身免疫病和再生医学提供解决方案。
6.3 展望合成细胞因子信号系统作为合成免疫学的关键领域,正从分子优化向系统化、智能化网络迈进,标志着精准医学的新纪元。这些突破不仅克服了天然细胞因子的局限,还通过跨学科融合为肿瘤免疫治疗、自身免疫疾病和再生医学提供了革命性工具。
未来,合成细胞因子系统将向智能化、自主化的治疗平台演进,通过整合AI辅助设计、智能纳米结构递送和生物材料介导的信号调控,构建能够适应动态微环境的治疗网络。通过深度学习预测蛋白质界面并结合定向进化策略,可开发高特异性、多功能受体-配体对,显著降低非特异性激活风险。例如,先进的结构预测模型[84]可与高通量筛选技术结合,设计出响应特定微环境信号(如pH或代谢物)的正交受体。这种方法通过定制疾病特异性激活模式,提升治疗特异性并减少非特异性免疫反应。另一方面,DNA折纸技术可构建模块化纳米载体,实现细胞因子或适配体的时空控释。例如,pH响应型DNA纳米装置可在酸性肿瘤微环境中精准释放IL-12,增强局部免疫激活,同时降低系统毒性[47]。通过整合响应生化或物理信号的智能纳米材料,可进一步实现治疗载荷的靶向递送与动态调控的协同优化[85]。功能化的3D生物材料支架(如IL-4修饰支架)通过模拟免疫微环境,调控细胞因子信号以促进组织再生[86]。未来可通过嵌入传感器和反馈回路,开发自适应支架,实现基于微环境变化的动态信号调控。此类智能生物材料平台在复杂组织修复中具有显著的再生潜力。
合成细胞因子疗法有望成为继抗体药物和细胞疗法之后的第三大生物治疗支柱,通过AI、纳米技术和生物材料的深度融合,将实现从“替代治疗”到“超越天然”的跨越,为精准化、个性化医疗开辟全新路径。跨学科协作和产业化生态的完善,将加速推进这一技术从实验室向临床的转化,重塑癌症、自身免疫疾病和再生医学的治疗范式。
| [1] |
Akdis M, Aab A, Altunbulakli C, et al. Interleukins (from IL-1 to IL-38), interferons, transforming growth factor β, and TNFα: receptors, functions, and roles in diseases. J Allergy Clin Immunol, 2016, 138: 984-1010. |
| [2] |
Liongue C, Sertori R, Ward AC. Evolution of cytokine receptor signaling. J Immunol, 2016, 197: 11-8. |
| [3] |
Cui A, Huang T, Li S, et al. Dictionary of immune responses to cytokines at single-cell resolution. Nature, 2024, 625: 377-84. |
| [4] |
Spangler JB, Moraga I, Mendoza JL, et al. Insights into cytokine-receptor interactions from cytokine engineering. Annu Rev Immunol, 2015, 33: 139-67. |
| [5] |
Philips RL, Wang Y, Cheon H, et al. The JAK-STAT pathway at 30:much learned, much more to do. Cell, 2022, 185: 3857-76. |
| [6] |
Murray PJ. The JAK-STAT signaling pathway: input and output integration. J Immunol, 2007, 178: 2623-9. |
| [7] |
O'Shea JJ, Murray PJ. Cytokine signaling modules in inflammatory responses. Immunity, 2008, 28: 477-87. |
| [8] |
Altan-Bonnet G, Mukherjee R. Cytokine-mediated communication: a quantitative appraisal of immune complexity. Nat Rev Immunol, 2019, 19: 205-17. |
| [9] |
Wong HS, Park K, Gola A, et al. A local regulatory T cell feedback circuit maintains immune homeostasis by pruning self-activated T cells. Cell, 2021, 184: 3981-97 e22. |
| [10] |
Hart Y, Reich-Zeliger S, Antebi Yaron E, et al. Paradoxical signaling by a secreted molecule leads to homeostasis of cell levels. Cell, 2014, 158: 1022-32. |
| [11] |
Polonsky M, Rimer J, Kern-Perets A, et al. Induction of CD4 T cell memory by local cellular collectivity. Science, 2018, 360: eaaj1853. |
| [12] |
Schimpl A, Berberich I, Kneitz B, et al. IL-2 and autoimmune disease. Cytokine Growth Factor Rev, 2002, 13: 369-78. |
| [13] |
Boyman O, Surh CD, Sprent J. Potential use of IL-2/anti-IL-2 antibody immune complexes for the treatment of cancer and autoimmune disease. Expert Opin Biol Ther, 2006, 6: 1323-31. |
| [14] |
Leonard WJ, Lin JX. Strategies to therapeutically modulate cytokine action. Nat Rev Drug Discov, 2023, 22: 827-54. |
| [15] |
Hashimoto M, Araki K, Cardenas MA, et al. PD-1 combination therapy with IL-2 modifies CD8+T cell exhaustion program. Nature, 2022, 610: 173-81. DOI:10.3969/j.issn.0253-9608.2022.03.001 |
| [16] |
Mendes-Correa M, Nunez M. Management of HIV and hepatitis virus coinfection. Expert Opin Pharmacother, 2010, 11: 2497-516. |
| [17] |
Cai Y, Han Z, Shen J, et al. Concurrent intratumoural T (reg) cell depletion and CD8+T cell expansion via a cleavable anti-4-1BB-interleukin-15 fusion protein. Nat Biomed Eng, 2025, 9: 952-66. |
| [18] |
Shi W, Lv L, Liu N, et al. A novel anti-PD-L1/IL-15 immunocytokine overcomes resistance to PD-L1 blockade and elicits potent antitumor immunity. Mol Ther, 2023, 31: 66-77. |
| [19] |
Zou Z, Shen J, Xue D, et al. Anti-PD-1 cis-delivery of low-affinity IL-12 activates intratumoral CD8+T cells for systemic antitumor responses. Nat Commun, 2024, 15: 4701. |
| [20] |
Sun Z, Ren Z, Yang K, et al. A next-generation tumor-targeting IL-2 preferentially promotes tumor-infiltrating CD8+T-cell response and effective tumor control. Nat Commun, 2019, 10: 3874. |
| [21] |
Lopes JE, Fisher JL, Flick HL, et al. ALKS 4230:a novel engineered IL-2 fusion protein with an improved cellular selectivity profile for cancer immunotherapy. J Immunother Cancer, 2020, 8: e000673. |
| [22] |
Vaishampayan UN, Muzaffar J, Winer I, et al. Nemvaleukin alfa, a modified interleukin-2 cytokine, as monotherapy and with pembrolizumab in patients with advanced solid tumors (ARTISTRY-1). J Immunother Cancer, 2024, 12: e010143. |
| [23] |
Feng B, Bai Z, Zhou X, et al. The type 2 cytokine Fc-IL-4 revitalizes exhausted CD8+T cells against cancer. Nature, 2024, 634: 712-20. |
| [24] |
Guo Y, Xie YQ, Gao M, et al. Metabolic reprogramming of terminally exhausted CD8+T cells by IL-10 enhances anti-tumor immunity. Nat Immunol, 2021, 22: 746-56. |
| [25] |
Moraga I, Spangler JB, Mendoza JL, et al. Synthekines are surrogate cytokine and growth factor agonists that compel signaling through non-natural receptor dimers. eLife, 2017, 6: e22882. |
| [26] |
Yen M, Ren J, Liu Q, et al. Facile discovery of surrogate cytokine agonists. Cell, 2022, 185: 1414-30.e19. |
| [27] |
Eijkelkamp N, Steen-Louws C, Hartgring SA, et al. IL4-10 fusion protein is a novel drug to treat persistent inflammatory pain. J Neurosci, 2016, 36: 7353-63. |
| [28] |
Song Y, Liu Y, Hu R, et al. In vivo antitumor activity of a recombinant IL7/IL15 hybrid cytokine in mice. Mol Cancer Ther, 2016, 15: 2413-21. |
| [29] |
Dower WJ, Park AI, Bakker AV, et al. A mechanistically novel peptide agonist of the IL-7 receptor that addresses limitations of IL-7 cytokine therapy. PLoS One, 2023, 18: e0286834. |
| [30] |
Silva DA, Yu S, Ulge UY, et al. De novo design of potent and selective mimics of IL-2 and IL-15. Nature, 2019, 565: 186-91. DOI:10.7537/marsnsj170919.22 |
| [31] |
Yan Y, Chang D, Xu Y, et al. Engineering a ligase binding DNA aptamer into a templating DNA scaffold to guide the selective synthesis of circular DNAzymes and DNA aptamers. J Am Chem Soc, 2023, 145: 2630-7. |
| [32] |
Ramaswamy V, Monsalve A, Sautina L, et al. DNA aptamer assembly as a vascular endothelial growth factor receptor agonist. Nucleic Acid Ther, 2015, 25: 227-34. |
| [33] |
Ali MH, Elsherbiny ME, Emara M. Updates on aptamer research. Int J Mol Sci, 2019, 20: 2511. |
| [34] |
Zhang R, Lv Z, Chang L, et al. A responsive DNA hydrogel containing poly‐aptamers as dual‐target inhibitors for localized cancer immunotherapy. Adv Funct Mater, 2024, 34: 2401563. |
| [35] |
Wu Q, Wei X, Chen F, et al. Aptamer-assisted blockade of the immune suppressor sialic acid-binding immunoglobulin-like Lectin-15 for cancer immunotherapy. Angew Chem Int Ed Engl, 2023, 62: e202312609. |
| [36] |
Ueki R, Ueki A, Kanda N, et al. Oligonucleotide-based mimetics of hepatocyte growth factor. Angew Chem Int Ed Engl, 2016, 55: 579-82. |
| [37] |
Ueki R, Atsuta S, Ueki A, et al. DNA aptamer assemblies as fibroblast growth factor mimics and their application in stem cell culture. Chem Commun (Camb), 2019, 55: 2672-5. |
| [38] |
Zhu J, Wang M, Li Z, et al. Engineering a circular DNA agonist to activate MET signaling for promoting angiogenesis and regeneration of diabetic ulcer. Chem Eng J, 2025, 505: 159074. |
| [39] |
Cong Y, Liu K, Huang Z, et al. A bivalent aptamer-based DNA agonist for EGFR signaling effectively alleviates ulcerative colitis in vivo. ACS Chem Biol, 2024, 19: 1280-90. |
| [40] |
Wang M, Yang D, Lu Q, et al. Spatially reprogramed receptor organization to switch cell behavior using a DNA origami-templated aptamer nanoarray. Nano Lett, 2022, 22: 8445-54. |
| [41] |
Liu K, Cong Y, Luo X, et al. Utilizing bivalent aptamers as first DNA agonist to activate RTKs heterodimer of different families. Chin Chem Lett, 2025, 36: 109839. |
| [42] |
Chen J, Chi H, Wang C, et al. Programmable circular multispecific aptamer-drug engager to broadly boost antitumor immunity. J Am Chem Soc, 2024, 146: 34311-23. |
| [43] |
Li H, Wang M, Shi T, et al. A DNA-mediated chemically induced dimerization (D-CID) nanodevice for nongenetic receptor engineering to control cell behavior. Angew Chem Int Ed Engl, 2018, 57: 10226-30. |
| [44] |
Xie X, Nan H, Peng J, et al. Hydrogen sulfide-triggered artificial DNAzyme switches for precise manipulation of cellular functions. Angew Chem Int Ed Engl, 2024, 63: e202410380. |
| [45] |
Yang S, Wang M, Tian D, et al. DNA-functionalized artificial mechanoreceptor for de novo force-responsive signaling. Nat Chem Biol, 2024, 20: 1066-77. |
| [46] |
Chen S, Xu Z, Yang W, et al. Logic-gate-actuated DNA-controlled receptor assembly for the programmable modulation of cellular signal transduction. Angew Chem Int Ed Engl, 2019, 58: 18186-90. |
| [47] |
Yuan K, Meng HM, Sun H, et al. An (e) pH-driven DNA nanodevice for impeding metastasis in vivo by selectively blocking cell signaling. Natl Sci Rev, 2025, 12: nwae471. |
| [48] |
Deckers J, Anbergen T, Hokke AM, et al. Engineering cytokine therapeutics. Nat Rev Bioeng, 2023, 1: 286-303. |
| [49] |
Shum T, Omer B, Tashiro H, et al. Constitutive signaling from an engineered IL7 receptor promotes durable tumor elimination by tumor-redirected T cells. Cancer Discov, 2017, 7: 1238-47. |
| [50] |
Zhu W, Zhang Z, Chen J, et al. A novel engineered IL-21 receptor arms T-cell receptor-engineered T cells (TCR-T cells) against hepatocellular carcinoma. Signal Transduct Target Ther, 2024, 9: 101. |
| [51] |
Bell M, Lange S, Sejdiu BI, et al. Modular chimeric cytokine receptors with leucine zippers enhance the antitumour activity of CAR T cells via JAK/STAT signalling. Nat Biomed Eng, 2024, 8: 380-96. |
| [52] |
Righi M, Gannon I, Robson M, et al. Enhancing CAR T-cell therapy using Fab-based constitutively heterodimeric cytokine receptors. Cancer Immunol Res, 2023, 11: 1203-21. |
| [53] |
Sockolosky JT, Trotta E, Parisi G, et al. Selective targeting of engineered T cells using orthogonal IL-2 cytokine-receptor complexes. Science, 2018, 359: 1037-42. |
| [54] |
Zhang Q, Hresko ME, Picton LK, et al. A human orthogonal IL-2 and IL-2Rβ system enhances CAR T cell expansion and antitumor activity in a murine model of leukemia. Sci Transl Med, 2021, 13: eabg6986. |
| [55] |
Kalbasi A, Siurala M, Su LL, et al. Potentiating adoptive cell therapy using synthetic IL-9 receptors. Nature, 2022, 607: 360-5. |
| [56] |
Ishizuka S, Lai CY, Otsu M, et al. Designing motif-engineered receptors to elucidate signaling molecules important for proliferation of hematopoietic stem cells. ACS Synth Biol, 2018, 7: 1709-14. |
| [57] |
Leen AM, Sukumaran S, Watanabe N, et al. Reversal of tumor immune inhibition using a chimeric cytokine receptor. Mol Ther, 2014, 22: 1211-20. |
| [58] |
Zhou Y, Farooq MA, Ajmal I, et al. Co-expression of IL-4/IL-15-based inverted cytokine receptor in CAR-T cells overcomes IL-4 signaling in immunosuppressive pancreatic tumor microenvironment. Biomed Pharmacother, 2023, 168: 115740. |
| [59] |
Wang Y, Jiang H, Luo H, et al. An IL-4/21 inverted cytokine receptor improving CAR-T cell potency in immunosuppressive solid-tumor microenvironment. Front Immunol, 2019, 10: 1691. |
| [60] |
Lange S, Sand LGL, Bell M, et al. A chimeric GM-CSF/IL18 receptor to sustain CAR T-cell function. Cancer Discov, 2021, 11: 1661-71. |
| [61] |
Schwarz KA, Daringer NM, Dolberg TB, et al. Rewiring human cellular input-output using modular extracellular sensors. Nat Chem Biol, 2017, 13: 202-9. |
| [62] |
Scheller L, Strittmatter T, Fuchs D, et al. Generalized extracellular molecule sensor platform for programming cellular behavior. Nat Chem Biol, 2018, 14: 723-9. |
| [63] |
Kagoya Y, Tanaka S, Guo T, et al. A novel chimeric antigen receptor containing a JAK-STAT signaling domain mediates superior antitumor effects. Nat Med, 2018, 24: 352-9. |
| [64] |
Sakunrangsit N, Khuisangeam N, Inthanachai T, et al. Incorporating IL7 receptor α signaling in the endodomain of B7H3-targeting chimeric antigen receptor T cells mediates antitumor activity in glioblastoma. Cancer Immunol Immunother, 2024, 73: 98. |
| [65] |
Smole A, Lainšček D, Bezeljak U, et al. A synthetic mammalian therapeutic gene circuit for sensing and suppressing inflammation. Mol Ther, 2017, 25: 102-19. |
| [66] |
Piraner DI, Abedi MH, Duran Gonzalez MJ, et al. Engineered receptors for soluble cellular communication and disease sensing. Nature, 2025, 638: 805-13. |
| [67] |
Zhu I, Liu R, Garcia JM, et al. Modular design of synthetic receptors for programmed gene regulation in cell therapies. Cell, 2022, 185: 1431-43.e16. |
| [68] |
Kalogriopoulos NA, Tei R, Yan Y, et al. Synthetic GPCRs for programmable sensing and control of cell behaviour. Nature, 2025, 637: 230-9. |
| [69] |
Allen GM, Frankel NW, Reddy NR, et al. Synthetic cytokine circuits that drive T cells into immune-excluded tumors. Science, 2022, 378: eaba1624. |
| [70] |
Ma X, Shou P, Smith C, et al. Interleukin-23 engineering improves CAR T cell function in solid tumors. Nat Biotechnol, 2020, 38: 448-59. |
| [71] |
Ma L, Zhang K, Xu J, et al. Building a novel TRUCK by harnessing the endogenous IFN-γ promoter for cytokine expression. Mol Ther, 2024, 32: 2728-40. |
| [72] |
Chmielewski M, Kopecky C, Hombach AA, et al. IL-12 release by engineered T cells expressing chimeric antigen receptors can effectively muster an antigen-independent macrophage response on tumor cells that have shut down tumor antigen expression. Cancer Res, 2011, 71: 5697-706. |
| [73] |
Chmielewski M, Abken H. CAR T cells releasing IL-18 convert to T-Bet (high) FoxO1(low) effectors that exhibit augmented activity against advanced solid tumors. Cell Rep, 2017, 21: 3205-19. |
| [74] |
Li X, Daniyan AF, Lopez AV, et al. Cytokine IL-36γ improves CAR T-cell functionality and induces endogenous antitumor response. Leukemia, 2021, 35: 506-21. |
| [75] |
Adachi K, Kano Y, Nagai T, et al. IL-7 and CCL19 expression in CAR-T cells improves immune cell infiltration and CAR-T cell survival in the tumor. Nat Biotechnol, 2018, 36: 346-51. |
| [76] |
Lei W, Zhao A, Liu H, et al. Safety and feasibility of anti-CD19 CAR T cells expressing inducible IL-7 and CCL19 in patients with relapsed or refractory large B-cell lymphoma. Cell Discov, 2024, 10: 5. |
| [77] |
Tumas S, Meldgaard TS, Vaaben TH, et al. Engineered E. coli Nissle 1917 for delivery of bioactive IL-2 for cancer immunotherapy. Sci Rep, 2023, 13: 12506. |
| [78] |
Yang S, Sheffer M, Kaplan IE, et al. Non-pathogenic E. coli displaying decoy-resistant IL18 mutein boosts anti-tumor and CAR NK cell responses. Nat Biotechnol, 2024. DOI:10.1038/s41587-024-02418-6 |
| [79] |
Chang Z, Guo X, Li X, et al. Bacterial immunotherapy leveraging IL-10R hysteresis for both phagocytosis evasion and tumor immunity revitalization. Cell, 2025, 188: 1842-57.e20. |
| [80] |
Sokol H, Pigneur B, Watterlot L, et al. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients. Proc Natl Acad Sci U S A, 2008, 105: 16731-6. |
| [81] |
Steidler L, Hans W, Schotte L, et al. Treatment of murine colitis by Lactococcus lactis secreting interleukin-10. Science, 2000, 289: 1352-5. |
| [82] |
Steidler L, Neirynck S, Huyghebaert N, et al. Biological containment of genetically modified Lactococcus lactis for intestinal delivery of human interleukin 10. Nat Biotechnol, 2003, 21: 785-9. |
| [83] |
Karami D, Srivastava A, Ramesh R, et al. Investigating cancerous exosomes'effects on CD8+T-cell IL-2 production in a 3D unidirectional flow bioreactor using 3D printed, RGD-functionalized PLLA scaffolds. J Funct Biomater, 2022, 13: 30. |
| [84] |
Jumper J, Evans R, Pritzel A, et al. Highly accurate protein structure prediction with AlphaFold. Nature, 2021, 596: 583-9. |
| [85] |
Wang H, Luo D, Wang H, et al. Construction of smart stimuli-responsive DNA nanostructures for biomedical applications. Chemistry, 2021, 27: 3929-43. |
| [86] |
Liu X, Gaihre B, Park S, et al. 3D-printed scaffolds with 2D hetero-nanostructures and immunomodulatory cytokines provide pro-healing microenvironment for enhanced bone regeneration. Bioactive Materials, 2023, 27: 216-30. |
 2025, Vol. 37
2025, Vol. 37 

 魏平,中国科学院深圳先进技术研究院合成生物学研究所研究员、博士生导师,合成生物学研究所副所长,细胞与基因线路设计中心主任。2007年于北京大学定量生物学中心获博士学位;2008年至2013年,于美国加州大学旧金山分校(UCSF)从事博士后研究;2013年至2021年,于北京大学定量生物学中心担任PI研究员;2021年起,加入中国科学院深圳先进技术研究院合成生物学研究所。主要研究方向为定量合成生物学、基因线路设计、细胞与基因治疗技术等。2014年入选中组部青年千人计划。2016年获得国家自然科学基金优秀青年项目资助。任中国生物工程协会合成生物学专委会委员、中国医药生物技术协会合成生物技术分会委员会委员
魏平,中国科学院深圳先进技术研究院合成生物学研究所研究员、博士生导师,合成生物学研究所副所长,细胞与基因线路设计中心主任。2007年于北京大学定量生物学中心获博士学位;2008年至2013年,于美国加州大学旧金山分校(UCSF)从事博士后研究;2013年至2021年,于北京大学定量生物学中心担任PI研究员;2021年起,加入中国科学院深圳先进技术研究院合成生物学研究所。主要研究方向为定量合成生物学、基因线路设计、细胞与基因治疗技术等。2014年入选中组部青年千人计划。2016年获得国家自然科学基金优秀青年项目资助。任中国生物工程协会合成生物学专委会委员、中国医药生物技术协会合成生物技术分会委员会委员