恶性肿瘤是全球第二大死因,统计数据显示近年来肿瘤发生率和死亡率均在增加[1]。2022年,全球新发癌症病例近2 000万例,死亡病例近1 000万例,其中发病前5位的恶性肿瘤分别为肺癌(12.4%)、乳腺癌(11.5%)、结直肠癌(9.6%)、前列腺癌(7.3%)和胃癌(4.9%),均为实体瘤;据预测,到2050年,全球将新增3 500万例癌症患者[2]。实体瘤的侵袭性生长、免疫抑制微环境及异质性导致传统化疗、放疗难以根治。嵌合抗原受体T细胞(chimeric antigen receptor T-cell, CAR-T)疗法在血液肿瘤中表现卓越,例如靶向分化簇19 (cluster of differentiation 19, CD19)的CAR-T疗法[3]或者靶向CD19和分化簇20 (cluster of differentiation 20, CD20)的双特异性CAR-T疗法[4, 5]对于治疗B细胞淋巴瘤都有很高的客观缓解率(objective response rate, ORR),并且部分患者长期没有肿瘤复发。然而,实体瘤治疗中CAR-T疗效仍然受限,主要原因包括缺乏高特异性且广泛表达的肿瘤相关抗原、肿瘤微环境中免疫抑制因子的影响以及肿瘤组织屏障对细胞渗透的阻碍等[6, 7]。
在CAR-T等免疫疗法受限的背景下,如何实现对肿瘤特异性靶点的精准识别,并对肿瘤免疫微环境进行有效重塑,已成为实体瘤治疗亟待突破的关键方向[8]。大量研究表明,许多关键的肿瘤标志物分布于细胞内部,例如肿瘤特异性表达的转录因子(transcription factors, TFs)[9]、微小RNA (microRNA, miRNA)[10]、异常信号通路组分及剪接因子突变等[11]。这些胞内信号无法被传统免疫细胞表面抗原识别机制捕捉,严重限制了靶向策略的精准度。为应对这一挑战,基于人工合成基因线路的基因治疗,正在为实体瘤治疗提供全新的治疗策略。合成生物学利用工程学思想,通过将模块化、标准化的生物学元件合理组装,并结合计算建模与人工智能优化,构建能感应肿瘤标志物且具有杀伤肿瘤效能的人工合成基因线路[12]。借助“与”“或”“非”等逻辑门结构,人工合成基因线路能够整合肿瘤内源启动子、miRNA表达谱及信号通路异常等多维信号,实现多输入判断与高特异性杀伤,从而显著提升肿瘤治疗的安全性与适用范围[13]。
溶瘤病毒凭借天然肿瘤趋向性和免疫激活能力,成为实体瘤基因治疗的重要策略[14]。溶瘤病毒的发展始于20世纪初偶然观察到的病毒感染后肿瘤消退现象,20世纪50年代进入系统研究阶段,科学家尝试利用减毒病毒直接杀伤肿瘤,但受限于安全性及杀伤效果[15, 16];21世纪初,基因工程推动第一代溶瘤病毒诞生,如2004年重组人5型腺病毒注射液(recombinant human adenovirus type 5 injection, H101)在中国获批用于头颈癌治疗。2015年,美国食品药品监督管理局(Food and Drug Administration, FDA)批准首款基因工程改造的Ⅰ型单纯疱疹病毒(talimogene laherparepvec, T-VEC)用于黑色素瘤,其通过裂解肿瘤细胞释放抗原并表达粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF),激活系统性抗肿瘤免疫[17]。然而,野生型病毒存在脱靶风险,简单修改的溶瘤病毒靶向性不强,疗效单一,无法适应实体瘤治疗的复杂需求[18]。近年来,研究将人工合成基因线路与溶瘤病毒相结合,开发“智能溶瘤病毒”,可被肿瘤内部标志物或肿瘤特异性环境精准触发病毒复制和治疗基因表达,并通过光遗传学或小分子系统实现时空特异性调控,显著提高其特异性与安全性。
本文首先综述靶向实体瘤的人工合成基因线路设计原理(图 1),随后探讨人工合成基因线路在溶瘤病毒中的应用及其临床转化进展。其次,介绍溶瘤病毒与免疫检查点抑制剂、CAR-T疗法和放疗的联合治疗策略。最后,展望智能溶瘤病毒的临床转化前景:目前仍需克服载体容量受限、系统性递送效率低以及宿主预存免疫干扰等关键挑战;未来可通过人工智能辅助优化病毒设计,结合干细胞或纳米载体等提升系统性递送效率,并利用人源化动物模型进行系统验证,以加速智能溶瘤病毒的临床应用进程。
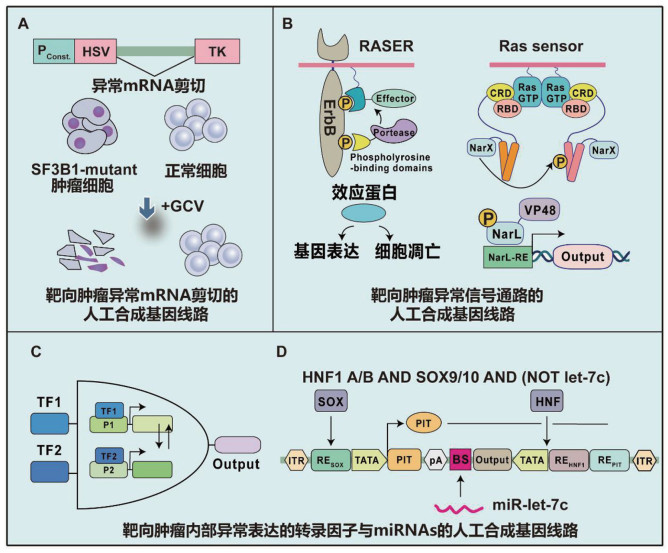
|
(A)靶向肿瘤异常mRNA剪切的人工合成基因线路;(B)靶向肿瘤异常信号通路的人工合成基因线路;(C、D)靶向肿瘤内部异常表达的转录因子(TFs)与miRNAs的人工合成逻辑基因线路。 图 1 靶向肿瘤内部生物标志物的人工合成基因线路 |
研究报道多种肿瘤内存在异常表达的TFs与miRNAs[19],基于此设计的人工合成基因线路可以提升肿瘤治疗的特异性,目前利用肿瘤特异性转录因子响应启动子的基因治疗策略已有部分进入临床评估阶段。例如,H19启动子可在超过30种恶性肿瘤中被特异性激活,而在健康组织中沉默。基于此特性设计开发的H19启动子驱动白喉毒素A表达基因系统[20],已在膀胱癌患者中开展Ⅱ期临床试验(NCT03719300、NCT01878188),进行单药或与卡介苗联合治疗[21, 22]。此外,使用肿瘤特异性表达的前内皮素-1启动子直接在肿瘤细胞中驱动肿瘤坏死因子受体1-FAS死亡受体(tumor necrosis factor receptor 1-FAS, TNFR1-FAS) 表达。该受体与肿瘤微环境中大量存在的肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)结合后可导致其受体活化,诱导肿瘤血管内皮细胞发生凋亡,抑制肿瘤血管生成,从而达到杀伤肿瘤的目的。目前该系统已被用于治疗卵巢癌,并进入Ⅱ期临床试验 [23]。尽管Ⅲ期临床试验(NCT03398655)未达预期终点,但与紫杉醇联用可以提升治疗效果[24]。
然而,天然启动子含有多种转录因子结合位点(transcription factor binding sites, TFBSs),易在正常细胞中脱靶激活。相比之下,合成启动子通过理性设计,在最小核心启动子上游整合特定TFBS串联重复序列,可显著增强肿瘤选择性。例如,卵巢癌特异性人工合成启动子S(E2F1)p与S(cMYC)p的激活强度及肿瘤选择性均显著优于天然肿瘤特异性启动子SSX1p和H2A1p,凸显其精准治疗价值[25]。
肿瘤特异性miRNA异常表达也是肿瘤关键的生物标志物[26, 27]。例如,用于识别特定癌细胞的特异性miRNA响应线路:当检测到细胞miR-21/miR-17-30a上调和miR-141/miR-142(3p)/miR-146a下调时,该人工合成基因线路将识别该细胞为宫颈癌细胞,从而激活促凋亡蛋白Bax (Bcl-2-associated X protein)表达,介导肿瘤细胞凋亡[28]。此外,可编程miRNA响应平台(programmable miRNA-responsive platform, PROMITAR)可以实现单个环状RNA响应miRNA进行下游基因表达调控,环状RNA具有更高的半衰期和稳定性,使得基因表达效果更好,调控倍数更高[29]。
1.2 靶向肿瘤剪接因子突变的人工合成基因线路研究发现,肿瘤细胞剪接因子易发生突变:剪接因子3B亚基1 (splicing factor 3B subunit 1, SF3B1)基因在环形铁粒幼细胞性骨髓增生异常综合征(myelodysplastic syndromes with ring sideroblasts, MDS-RS)和慢性淋巴细胞白血病中的突变频率极高[30, 31];U2AF1 (U2 small nuclear RNA auxiliary factor 1)则在MDS-RS患者中经常发生突变[32]。此类突变可导致分支点识别异常,诱发隐蔽剪接位点激活,产生肿瘤特异性转录本。基于此分子病理特征,North等[33]开发了剪切突变依赖性人工合成基因线路(图 1A):通过工程化合成内含子(synthetic intron),使其在特殊突变细胞中高效剪接,而在野生型细胞中因分支点序列亲和力不足处于未剪接状态。该研究通过高通量筛选8 878种内含子变体,确定最优长度并整合突变响应型5' 剪接位点增强子。当其人工合成基因线路分别被导入正常和肿瘤细胞中:工程化合成内含子在肿瘤细胞中高效剪切,进而驱动HSV-TK表达,在更昔洛韦(ganciclovir, GCV)处理下,选择性杀伤SF3B1突变的乳腺癌、葡萄膜黑素瘤和胰腺癌细胞系,而基因型正常的野生型细胞则未被杀伤。在MDS-RS患者来源异种移植模型中,该疗法显著降低肿瘤负荷且未诱发肝毒性,证实了其靶向剪接因子突变肿瘤的特异性与安全性。
1.3 靶向肿瘤异常信号通路的人工合成基因线路癌细胞在持续活化的异常信号通路驱动下,呈现区别于正常细胞的恶性表型,其特征包括失控性增殖、凋亡抵抗及侵袭迁移能力增强,这些过程共同构成肿瘤发生发展的核心分子基础[34, 35]。基于此类病理特征,研究者通过合成生物学策略构建了可特异性感知胞内致癌信号通路的基因线路(图 1B)。
例如,响应异常表皮生长因子受体家族成员ErbB (erythro-blastic leukemia viral oncogene homolog)信号通路的效应因子释放系统(rewiring of aberrant signaling to effector release, RASER),是专为ErbB信号通路过度激活的肿瘤而设计的[36]。该系统包含两个工程化融合蛋白:其一是将治疗效应蛋白(如凋亡诱导剂)与膜锚定磷酸酪氨酸结合结构域(phosphotyrosine-binding domain, PTB)进行融合表达,效应蛋白和PTB之间包含丙型肝炎病毒非结构蛋白3 (hepatitis C virus non-structural protein 3, HCV NS3) 蛋白酶切割位点;其二是将PTB与HCV NS3蛋白酶进行融合表达。在ErbB过度激活的癌细胞中,磷酸化受体同时招募两个融合蛋白,促使NS3蛋白酶精准切割效应蛋白释放位点,导致效应蛋白释放,促使细胞凋亡或驱动CRISPR/Cas9介导的GM-CSF表达,实现肿瘤特异性杀伤与肿瘤微环境重塑的双重疗效。
除此之外,受体酪氨酸激酶(receptor tyrosine kinase, RTK)/小GTP酶信号开关蛋白(Rat sarcoma viral oncogene homolog, RAS)信号通路的异常激活常导致细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)的持续过度激活,这是多种恶性肿瘤的共同特征[37]。针对RAS信号通路的致癌激活,研究者开发了基于RAS结合域和工程化硝酸盐感应激酶(nitrate sensor kinase, NarX)的人工合成基因线路。该设计利用CRAF蛋白的RAS结合域/半胱氨酸富集域(RAS-binding domain and cysteine-rich domain, RBD-CRD)特异性识别鸟苷三磷酸(guanosine triphosphate, GTP)结合态的活性RAS,进而触发NarX/NarL双组分系统磷酸化级联反应,最终激活下游治疗基因转录表达,实现对RAS信号通路异常活化肿瘤的高精度识别与治疗干预[38]。
除此之外,也有研究者创新性地开发了ERK依赖性自杀基因疗法,其核心策略是将治疗蛋白,比如单纯疱疹病毒胸苷激酶(herpes simplex virus thymidine kinase, HSV-TK)或酵母胞嘧啶脱氨酶(yeast cytosine deaminase, yCD)的稳定性与ERK磷酸化活性偶联。在RTK/RAS高活性肿瘤细胞中,ERK介导的治疗蛋白磷酸化可阻止其降解,实现蛋白积累;而在ERK活性正常的细胞中,治疗蛋白迅速分解。该设计通过利用组成型强病毒启动子驱动治疗基因高拷贝表达,同时依赖ERK对蛋白稳定性的翻译后调控维持肿瘤选择性。当联合给药如GCV或5-氟胞嘧啶时,累积的治疗蛋白可将其转化为细胞毒性物质,从而特异性杀伤癌细胞。系列体内外实验证实,此策略在保留正常细胞活力的前提下,可高效清除RTK/RAS驱动型肿瘤细胞[39]。
1.4 实体瘤基因治疗中的人工合成逻辑线路人工合成基因线路通过整合逻辑线路设计来显著提升肿瘤靶向特异性,其核心在于利用肿瘤生物标志物协同判断以降低脱靶风险:目前开发的双启动子与门(AND gate)系统采用至少两种肿瘤特异性启动子(图 1C),如端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)与生存素(survivin)启动子,分别控制酵母转录因子Gal4的DNA结合域和激活域,仅当二者在癌细胞中共同表达时才能组装为功能性转录因子,进而驱动HSV-TK表达,在结肠癌细胞中实现选择性杀伤[40];进一步地,Liu等[41, 42]基于CRISPR-Cas9系统构建CRISPReader平台,通过两种膀胱组织特异性启动子:尿血小板溶素Ⅱ (uroplakin Ⅱ, UPⅡ)启动子与尿血小板溶素Ⅲ (Uroplakin Ⅲ, hUPⅢ)启动子,组合驱动Cas9表达,同时由肿瘤相关miR-21调控,形成“UPⅡ AND hUPⅢ AND NOT miR-21”逻辑计算,在膀胱癌细胞中特异性表达。
除此之外,Angelici等[43]设计了肝细胞癌(hepa- tocellular carcinoma, HCC)靶向线路(图 1D),采用腺相关病毒(adeno-associated virus, AAV)载体递送感知肝细胞核因子1α/β (hepatocyte nuclear factor 1 alpha/beta, HNF1A/B)、肿瘤标志物SOX9/SOX10及抑癌miRNA let-7c的人工合成基因线路,构建HNF1A/B AND SOX9/SOX10 AND (NOT let-7c)逻辑门,在小鼠HCC模型中特异性诱导HSV-TK表达并联合GCV治疗,显著抑制肿瘤生长且未损伤正常肝功能。
2 人工合成基因线路构建与智能溶瘤病毒溶瘤病毒因其天然的肿瘤趋向性及免疫激活能力,已成为治疗实体瘤的一种重要基因治疗策略。然而,野生型病毒常面临脱靶风险和疗效单一等局限,因此近年来,研究者尝试将人工合成基因线路与溶瘤病毒相结合,开发具备肿瘤特异性响应与肿瘤杀伤能力的“智能溶瘤病毒”。
据上述描述,肿瘤细胞与正常细胞在转录因子、miRNAs、剪切突变、信号过度活化、微环境等方面均有所不同[44-46],据此可构建肿瘤特异性响应的基因线路,并将其上载至溶瘤病毒,提高其肿瘤靶向特异性。如溶瘤腺病毒CNHK300,这是人端粒酶逆转录酶启动子(human telomerase reverse transcriptase promoter, PhTERT)调控腺病毒早期区域1A (early region 1A protein, E1A)表达的溶瘤腺病毒,其在端粒酶高表达肝癌细胞中特异性复制并造成杀伤[47]。其他如乏氧诱导因子1α (hypoxia-inducible factor 1-alpha, HIF-1α)[48-50]、乳酸受体G蛋白偶联受体81 (G protein- coupled receptor 81, GPR81)等已经用于设计人工基因线路并具有肿瘤特异性[51, 52],将来有望应用于溶瘤病毒调控。
除了单个信号响应的基因线路,整合多信号输入可以提升溶瘤病毒治疗特异性,例如AND门设计需同时识别两种肿瘤标志物方可触发病毒复制,NOT门设计则通过抑制性信号规避正常组织毒性。其中,谢震课题组[53]于2019年构建了特异性靶向肝癌细胞的溶瘤腺病毒。该研究首先构建了响应肝癌特异性启动子与miRNA (miR-199a/b-3p、miR-142和miR-21)的逻辑线路,并将其装载至溶瘤腺病毒中用于调控腺病毒复制以及免疫因子表达(图 2)。实验显示,该病毒在肝癌模型肿瘤组织特异性高表达,显著降低了传统溶瘤病毒的脱靶风险,且联合免疫检查点抑制剂治疗可进一步抑制转移灶生长。
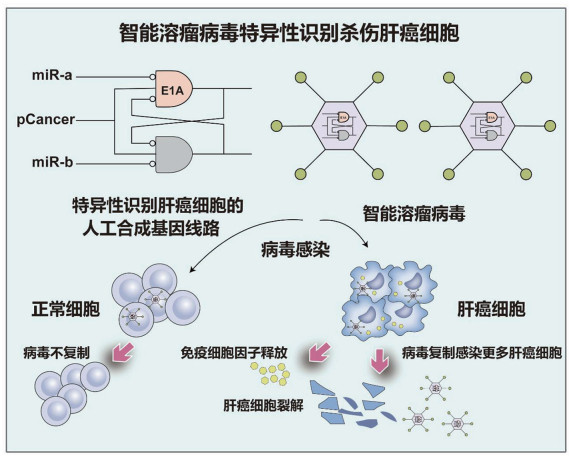
|
人工合成逻辑线路经溶瘤病毒递送进入肿瘤细胞,通过识别肿瘤特异性TF及miRNA,激活E1A以及免疫细胞因子的表达,触发腺病毒在肝癌细胞中选择性复制和表达免疫因子。病毒的选择性复制导致肿瘤细胞裂解,新生的腺病毒感染其他肝癌细胞,以提升溶瘤病毒的治疗效果。免疫因子表达则促使机体调动免疫反应,对肿瘤进行进一步的杀伤。智能溶瘤腺病毒在正常细胞中不复制,无杀伤能力。 图 2 智能溶瘤病毒特异性识别杀伤肝癌细胞 |
除了肿瘤内部的特异性信号,溶瘤病毒中装载外源信号分子可控的人工合成基因线路,可实现外源添加光或者小分子调控溶瘤病毒活性或行为。例如单纯疱疹病毒G47Δ-KR,在该病毒基因组中插入编码光敏蛋白KillerRed (KR)的基因,在局部光照下KR被光激发后产生活性氧,氧化损伤细胞膜/细胞器从而直接诱导肿瘤细胞死亡[49]。通过小分子诱导系统可以调控目的蛋白(病毒相关复制蛋白或免疫因子)的表达,现有的如雷帕霉素诱导系统利用FK506结合蛋白-雷帕霉素结合结构域(FK506-binding protein-FKBP-rapamycin binding domain, FKBP-FRB)二聚化系统驱动细胞免疫因子表达[51-54]。除了小分子诱导二聚化系统外,研究还利用强力霉素(Dox)和对异丙基苯甲酸(Cumate)调控基因转录表达系统,实现小分子调控溶瘤痘苗病毒的病毒复制蛋白D13L、SARS-CoV-2刺突糖蛋白 (病毒蛋白,刺激免疫作为疫苗)、呼肠孤病毒融合蛋白(细胞毒性蛋白)、免疫细胞因子(白介素-12、白介素-2和白介素-18)等(图 3),以显著提升溶瘤病毒治疗的精准性与安全性[50]。
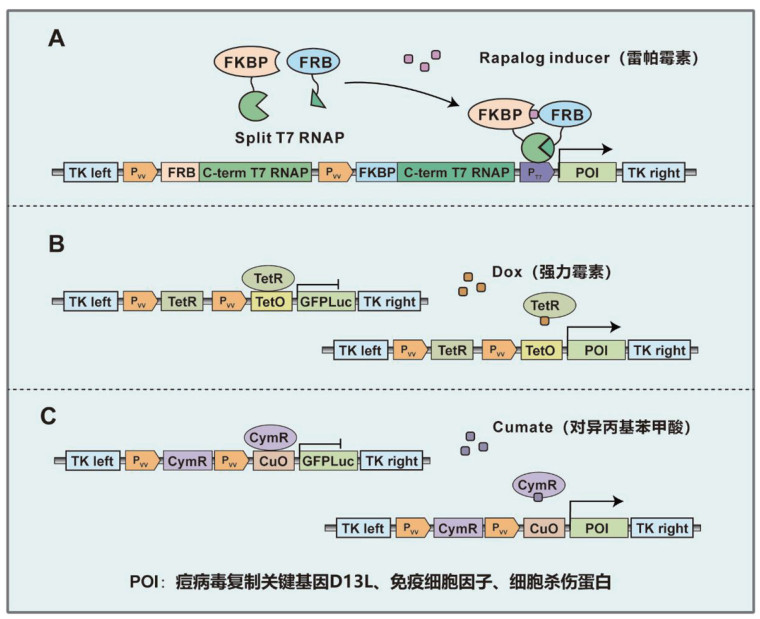
|
(A)雷帕霉素诱导系统:FKBP与FRB蛋白分别与T7核糖核酸聚合酶(T7 RNA polymerase)其中一个结构域融合,并由PVV启动子(痘苗病毒晚期启动子)驱动表达。雷帕霉素存在的情况下,FKBP与FRB蛋白二聚促使分裂式T7核糖核酸聚合酶恢复活性,驱动PT7启动子表达下游基因。(B) Dox控制系统:Dox存在的情况下,阻遏蛋白(TetR)与操纵子(TetO)的阻碍能力被解除,痘苗病毒启动子驱动下游基因表达。(C) Cumate诱导系统:Cumate存在的情况下,阻遏蛋白(CymR)与操纵子(CuO)的阻碍能力被解除,痘苗病毒启动子驱动下游基因表达。POI:痘病毒复制关键基因D13L、免疫细胞因子、细胞杀伤蛋白。 图 3 小分子诱导系统调控溶瘤痘苗病毒蛋白表达 |
溶瘤病毒的临床转化历经三次技术迭代[14]。第一代病毒以天然或减毒病毒为主,例如2015年获批的T-VEC通过表达GM-CSF激活抗肿瘤免疫,在黑色素瘤Ⅲ期临床试验(NCT00769704)中有较好的治疗效果[54]。第二代病毒通过基因工程增强选择性,例如中国首个上市的溶瘤腺病毒H101删除了E1B-55K基因(E1B-55K蛋白在野生型腺病毒中的作用是结合并抑制抑癌蛋白p53),从而阻止被感染细胞的凋亡,确保病毒复制。H101删除该基因后,在p53功能正常的细胞中,p53会激活凋亡通路清除病毒感染的细胞,阻断病毒复制;而在p53缺陷的肿瘤细胞中,因缺乏p53介导的防御机制,病毒可大量复制并溶解肿瘤细胞。该病毒还可以联合化疗以进一步提高头颈癌患者的生存期[55]。
第三代智能溶瘤病毒依赖于人工合成基因线路与溶瘤病毒结合,实现肿瘤特异性杀伤并增强杀伤效果。谢震团队[56]开发的溶瘤腺病毒SynOV1.1在Ⅰ期临床试验(CXSL2101198)中不仅可以靶向肿瘤细胞进行杀伤,还可以通过激活全身抗肿瘤免疫来治愈肝癌并部分缓解远处转移的肝癌。除此之外,还有表达α-1, 3-半乳糖基转移酶以增强杀伤效果的新城疫病毒(newcastle disease virus, NDV-GT),其通过诱导补体介导的超急性排斥反应破坏肿瘤血管,Ⅰ期临床试验(ChiCTR2000031980) 20例转移性癌症患者中3例部分缓解(partial response, PR)、15例疾病稳定(stable disease, SD),无剂量限制性毒性(dose-limiting toxicity, DLT)[57]。
最新研究表明,单纯疱疹病毒VG161通过携带IL-12、IL-15/IL-15RA复合物及PD-L1阻断肽,可进行多方面的免疫激活。临床前研究显示,VG161在肝癌模型中肿瘤治疗效果良好。在Ⅰ期临床试验(NCT04806464)中,患者耐受性良好,未报告3级以上不良事件,初步客观缓解率(ORR)达35%[58]。此外,溶瘤痘苗病毒JX-594 (Pexa-Vec)是一种基因工程改造的溶瘤痘苗病毒,通过删除胸苷激酶基因和插入GM-CSF基因,实现选择性肿瘤复制与免疫激活双重功能,但目前Ⅲ期临床试验(NCT02562755)效果不佳[59, 60]。
4 溶瘤病毒的联合治疗现有一些研究表明,溶瘤病毒与现有治疗手段的联合治疗能显著提升抗肿瘤疗效。溶瘤病毒与免疫检查点抑制剂联用可逆转免疫抑制微环境,例如T-VEC联合帕博利珠单抗在晚期黑色素瘤Ⅲ期临床试验(NCT00769704)中显著提高了受试者的中位生存期。研究表明,病毒裂解肿瘤细胞释放抗原并招募了树突状细胞,与PD-1抗体协同治疗提高了T细胞免疫效果[61]。
嵌合抗原受体工程改造的实体瘤T细胞疗法会因肿瘤表面缺乏抗原而受到限制,通过痘苗病毒携带CD19抗原基因感染肿瘤细胞,则可以使肿瘤细胞表面表达CD19。在临床前模型中使用该溶瘤病毒联合CD19 CAR-T治疗胶质母细胞瘤,具有良好的治疗效果且无明显的脱靶毒性[62]。除此之外,有研究者在病毒基因组中插入抗表皮生长因子受体(epidermal growth factor receptor, EGFR)抗体靶向的双特异性T细胞衔接器(cBiTE)基因,其由EGFR单链抗体和抗CD3单链抗体通过柔性连接肽串联,并受控于腺病毒主要晚期启动子,确保仅在病毒复制时表达。这种搭载双特异性T细胞衔接器抗体的溶瘤腺病毒可在EGFR高表达的肿瘤细胞中有效激活肿瘤浸润T细胞。同时,该病毒介导的溶瘤作用可引发强烈的T细胞活化、增殖及旁观者细胞介导的细胞毒性,实验证明瘤内注射该腺病毒可显著提高肿瘤浸润T细胞在体内的持续存在时间[63]。
5 讨论与展望人工基因线路赋予了溶瘤病毒更高的特异性与可编程性,有望实现“感知-决策-执行”的精准肿瘤杀伤。例如,通过构建多输入逻辑门基因线路,可实现对肿瘤特异miRNA、低氧或异常信号通路的组合识别,增强治疗靶向性与安全性。未来,基因线路可进一步驱动免疫因子表达、调控溶瘤病毒复制周期,甚至实现体内自适应调控。然而,也面临一系列挑战,包括线路在病毒载体中的稳定表达、宿主细胞本身对线路功能的干扰以及免疫系统对合成元件的清除反应。此外,如何在小型病毒载体中平衡装载容量与线路复杂度,也是工程设计中的关键问题。
溶瘤病毒临床转化的核心挑战在于载体容量限制、全身递送效率及宿主预存免疫。例如,腺病毒8.5 kb容量制约复杂人工合成基因线路植入,对于载量更大的逻辑线路则无法装载,而对于单纯疱疹病毒和痘苗病毒等,过大的包装也增加了突变的可能,对于治疗的效果和安全都是很大的考验。现有研究表明,利用T细胞或者间充质干细胞(mesenchymal stem cells, MSC)系统性递送溶瘤病毒,可以提高系统性递送效率和安全性[64]。
利用材料学和物理学,顾臻团队[65]在溶瘤病毒递送领域开发了基于液-液相分离的凝聚体囊泡和特洛伊木马式递送等创新策略:凝聚体囊泡表面没有膜结构,由高密度液体层和充满水的腔体组成,具有优良的稳定性,通过不依赖受体的大胞饮过程可以显著提升溶瘤病毒进入肿瘤细胞的效率,增强病毒驻留及抗肿瘤免疫;而特洛伊木马策略则利用肿瘤细胞携带病毒全身递送,经液氮冲击消除载体致病性后,使肺转移灶病毒富集从而有效规避免疫清除[66]。团队还探索了细胞载体运输、纳米修饰、聚合物涂层及联合免疫抑制等多种技术,协同解决病毒靶向性差、免疫中和及生产成本高等临床应用挑战。
人工智能(artificial intelligence, AI)目前也广泛用于合成生物学中,现在的深度学习模型可以通过分析数万种启动子序列来人工合成肿瘤特异性启动子,提高特异性激活倍数[67]。AI还可检测筛选正交调控元件,构建多层反馈回路实现精准剂量控制。未来,溶瘤病毒将与AI结合,进行其基因的优化精简及通过人工合成基因线路实现更为安全可控的肿瘤治疗。除此之外,人源化肿瘤模型与大型动物实验平台的建立也是目前溶瘤病毒向临床转化所必需的,如人源化小鼠、迷你猪,这些将加快推进临床试验,降低转化风险。随着技术创新与临床证据的积累,溶瘤病毒有望在未来成为实体瘤一线治疗手段,实现精准化与个性化医疗愿景。
| [1] |
Siegel RL, Miller KD, Wagle NS, et al. Cancer statistics, 2023. CA Cancer J Clin, 2023, 73: 17-48. |
| [2] |
Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin, 2024, 74: 229-63. |
| [3] |
Park JH, Rivière I, Gonen M, et al. Long-term follow-up of CD19 CAR therapy in acute lymphoblastic leukemia. N Engl J Med, 2018, 378: 449-59. |
| [4] |
Blüm P, Kayser S. Chimeric antigen receptor (CAR) T-cell therapy in hematologic malignancies: clinical implications and limitations. Cancers (Basel), 2024, 16: 1599. |
| [5] |
Wang L, Fang C, Kang Q, et al. Bispecific CAR-T cells targeting CD19/20 in patients with relapsed or refractory B cell non-Hodgkin lymphoma: a phase Ⅰ/Ⅱ trial. Blood Cancer J, 2024, 14: 130. |
| [6] |
Majzner RG, Mackall CL. Tumor antigen escape from CAR T-cell therapy. Cancer Discov, 2018, 8: 1219-26. |
| [7] |
Sterner RC, Sterner RM. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J, 2021, 11: 69. |
| [8] |
Wang DR, Wu XL, Sun YL. Therapeutic targets and biomarkers of tumor immunotherapy: response versus non-response. Signal Transduct Target Ther, 2022, 7: 331. |
| [9] |
Bushweller JH. Targeting transcription factors in cancer - from undruggable to reality. Nat Rev Cancer, 2019, 19: 611-24. |
| [10] |
Ferragut Cardoso AP, Banerjee M, Nail AN, et al. miRNA dysregulation is an emerging modulator of genomic instability. Semin Cancer Biol, 2021, 76: 120-31. |
| [11] |
Yang L, Shi P, Zhao G, et al. Targeting cancer stem cell pathways for cancer therapy. Signal Transduct Target Ther, 2020, 5: 8. |
| [12] |
Cubillos-Ruiz A, Guo T, Sokolovska A, et al. Engineering living therapeutics with synthetic biology. Nat Rev Drug Discov, 2021, 20: 941-60. |
| [13] |
Zhu B, Yin H, Zhang D, et al. Synthetic biology approaches for improving the specificity and efficacy of cancer immunotherapy. Cell Mol Immunol, 2024, 21: 436-47. |
| [14] |
Kelly E, Russell SJ. History of oncolytic viruses: genesis to genetic engineering. Mol Ther, 2007, 15: 651-9. |
| [15] |
Kaufman HL, Kohlhapp FJ, Zloza A. Oncolytic viruses: a new class of immunotherapy drugs. Nat Rev Drug Discov, 2015, 14: 642-62. |
| [16] |
Morgan RA, Yang JC, Kitano M, et al. Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2. Mol Ther, 2010, 18: 843-51. |
| [17] |
Soliman H, Hogue D, Han H, et al. Oncolytic T-VEC virotherapy plus neoadjuvant chemotherapy in nonmetastatic triple-negative breast cancer: a phase 2 trial. Nat Med, 2023, 29: 450-7. |
| [18] |
Shalhout SZ, Miller DM, Emerick KS, et al. Therapy with oncolytic viruses: progress and challenges. Nat Rev Clin Oncol, 2023, 20: 160-77. |
| [19] |
Kant R, Manne RK, Anas M, et al. Deregulated transcription factors in cancer cell metabolisms and reprogramming. Semin Cancer Biol, 2022, 86: 1158-74. |
| [20] |
Mizrahi A, Czerniak A, Levy T, et al. Development of targeted therapy for ovarian cancer mediated by a plasmid expressing diphtheria toxin under the control of H19 regulatory sequences. J Transl Med, 2009, 7: 69. |
| [21] |
Hanna N, Ohana P, Konikoff FM, et al. Phase 1/2a, dose-escalation, safety, pharmacokinetic and preliminary efficacy study of intratumoral administration of BC-819 in patients with unresectable pancreatic cancer. Cancer Gene Ther, 2012, 19: 374-81. |
| [22] |
Sidi AA, Ohana P, Benjamin S, et al. Phase Ⅰ/Ⅱ marker lesion study of intravesical BC-819 DNA plasmid in H19 over expressing superficial bladder cancer refractory to bacillus Calmette-Guerin. J Urol, 2008, 180: 2379-83. |
| [23] |
Arend RC, Beer HM, Cohen YC, et al. Ofranergene obadenovec (VB-111) in platinum-resistant ovarian cancer; favorable response rates in a phase Ⅰ/Ⅱ study are associated with an immunotherapeutic effect. Gynecol Oncol, 2020, 157: 578-84. |
| [24] |
Arend RC, Monk BJ, Shapira-Frommer R, et al. Ofranergene obadenovec (Ofra-Vec, VB-111) with weekly paclitaxel for platinum-resistant ovarian cancer: randomized controlled phase Ⅲ trial (OVAL Study/GOG 3018). J Clin Oncol, 2024, 42: 170-9. |
| [25] |
Nissim L, Wu MR, Pery E, et al. Synthetic RNA-based immunomodulatory gene circuits for cancer immunotherapy. Cell, 2017, 171: 1138-50. e15. |
| [26] |
Zhang C, Sun C, Zhao Y, et al. Overview of microRNAs as diagnostic and prognostic biomarkers for high-incidence cancers in 2021. Int J Mol Sci, 2022, 23: 11389. |
| [27] |
Rupaimoole R, Slack FJ. MicroRNA therapeutics: towards a new era for the management of cancer and other diseases. Nat Rev Drug Discov, 2017, 16: 203-22. |
| [28] |
Xie Z, Wroblewska L, Prochazka L, et al. Multi-input RNAi-based logic circuit for identification of specific cancer cells. Science, 2011, 333: 1307-11. |
| [29] |
Ning H, Liu G, Li L, et al. Rational design of microRNA-responsive switch for programmable translational control in mammalian cells. Nat Commun, 2023, 14: 7193. |
| [30] |
Yoshida K, Sanada M, Shiraishi Y, et al. Frequent pathway mutations of splicing machinery in myelodysplasia. Nature, 2011, 478: 64-9. |
| [31] |
Quesada V, Conde L, Villamor N, et al. Exome sequencing identifies recurrent mutations of the splicing factor SF3B1 gene in chronic lymphocytic leukemia. Nat Genet, 2011, 44: 47-52. |
| [32] |
Graubert TA, Shen D, Ding L, et al. Recurrent mutations in the U2AF1 splicing factor in myelodysplastic syndromes. Nat Genet, 2011, 44: 53-7. |
| [33] |
North K, Benbarche S, Liu B, et al. Synthetic introns enable splicing factor mutation-dependent targeting of cancer cells. Nat Biotechnol, 2022, 40: 1103-13. |
| [34] |
Torti D, Trusolino L. Oncogene addiction as a foundational rationale for targeted anti-cancer therapy: promises and perils. EMBO Mol Med, 2011, 3: 623-36. |
| [35] |
Zhou Y, Tao L, Qiu J, et al. Tumor biomarkers for diagnosis, prognosis and targeted therapy. Signal Transduct Target Ther, 2024, 9: 132. |
| [36] |
Chung HK, Zou X, Bajar BT, et al. A compact synthetic pathway rewires cancer signaling to therapeutic effector release. Science, 2019, 364: eaat6982. |
| [37] |
Sulahian R, Kwon JJ, Walsh KH, et al. Synthetic lethal interaction of SHOC2 depletion with MEK inhibition in RAS-driven cancers. Cell Rep, 2019, 29: 118-34. e8. |
| [38] |
Senn G, Nissen L, Benenson Y. Synthetic gene circuits that selectively target RAS-driven cancers. eLife, 2025, 14: RP104320. |
| [39] |
Day EK, Campbell A, Pandolf A, et al. ERK-dependent suicide gene therapy for selective targeting of RTK/RAS-driven cancers. Mol Ther, 2021, 29: 1585-601. |
| [40] |
Nissim L, Bar-Ziv RH. A tunable dual-promoter integrator for targeting of cancer cells. Mol Syst Biol, 2010, 6: 444. |
| [41] |
Liu Y, Zeng Y, Liu L, et al. Synthesizing AND gate genetic circuits based on CRISPR-Cas9 for identification of bladder cancer cells. Nat Commun, 2014, 5: 5393. |
| [42] |
Liu Y, Huang W, Cai Z. Synthesizing AND gate minigene circuits based on CRISPReader for identification of bladder cancer cells. Nat Commun, 2020, 11: 5486. |
| [43] |
Angelici B, Shen L, Schreiber J, et al. An AAV gene therapy computes over multiple cellular inputs to enable precise targeting of multifocal hepatocellular carcinoma in mice. Sci Transl Med, 2021, 13: eabh4456. |
| [44] |
Walker C, Mojares E, Del Río Hernández A. Role of extracellular matrix in development and cancer progression. Int J Mol Sci, 2018, 19: 3028. |
| [45] |
Choi JY, Jang YS, Min SY, et al. Overexpression of MMP-9 and HIF-1α in breast cancer cells under hypoxic conditions. J Breast Cancer, 2011, 14: 88-95. |
| [46] |
Liu Y, Vandekeere A, Xu M, et al. Metabolite-derived protein modifications modulating oncogenic signaling. Front Oncol, 2022, 12: 988626. |
| [47] |
Li YM, Song ST, Jiang ZF, et al. Telomerase-specific oncolytic virotherapy for human hepatocellular carcinoma. World J Gastroenterol, 2008, 14: 1274-9. |
| [48] |
Semenza GL, Rue EA, Iyer NV, et al. Assignment of the hypoxia-inducible factor 1alpha gene to a region of conserved synteny on mouse chromosome 12 and human chromosome 14q. Genomics, 1996, 34: 437-9. |
| [49] |
Cha ST, Chen PS, Johansson G, et al. MicroRNA-519c suppresses hypoxia-inducible factor-1alpha expression and tumor angiogenesis. Cancer Res, 2010, 70: 2675-85. |
| [50] |
Gravdal K, Halvorsen OJ, Haukaas SA, et al. Proliferation of immature tumor vessels is a novel marker of clinical progression in prostate cancer. Cancer Res, 2009, 69: 4708-15. |
| [51] |
Liu C, Wu J, Zhu J, et al. Lactate inhibits lipolysis in fat cells through activation of an orphan G-protein-coupled receptor, GPR81. J Biol Chem, 2009, 284: 2811-22. |
| [52] |
Li X, Yang Y, Zhang B, et al. Lactate metabolism in human health and disease. Signal Transduct Target Ther, 2022, 7: 305. |
| [53] |
Huang H, Liu Y, Liao W, et al. Oncolytic adenovirus programmed by synthetic gene circuit for cancer immunotherapy. Nat Commun, 2019, 10: 4801. |
| [54] |
Lawler SE, Speranza MC, Cho CF, et al. Oncolytic viruses in cancer treatment: a review. JAMA Oncol, 2017, 3: 841-9. |
| [55] |
Wei D, Xu J, Liu XY, et al. Fighting cancer with viruses: oncolytic virus therapy in China. Hum Gene Ther, 2018, 29: 151-9. |
| [56] |
Liu G, Hu Q, Peng S, et al. The spatial and single-cell analysis reveals remodeled immune microenvironment induced by synthetic oncolytic adenovirus treatment. Cancer Lett, 2024, 581: 216485. |
| [57] |
Zhong L, Gan L, Wang B, et al. Hyperacute rejection-engineered oncolytic virus for interventional clinical trial in refractory cancer patients. Cell, 2025, 188: 1119-36. e23. |
| [58] |
Shen Y, Bai X, Zhang Q, et al. Oncolytic virus VG161 in refractory hepatocellular carcinoma. Nature, 2025, 641: 503-11. |
| [59] |
Toulmonde M, Guegan JP, Spalato-Ceruso M, et al. Reshaping the tumor microenvironment of cold soft-tissue sarcomas with oncolytic viral therapy: a phase 2 trial of intratumoral JX-594 combined with avelumab and low-dose cyclophosphamide. Mol Cancer, 2024, 23: 38. |
| [60] |
Toulmonde M, Cousin S, Kind M, et al. Randomized phase 2 trial of intravenous oncolytic virus JX-594 combined with low-dose cyclophosphamide in patients with advanced soft-tissue sarcoma. J Hematol Oncol, 2022, 15: 149. |
| [61] |
Chesney J, Puzanov I, Collichio F, et al. Randomized, open-label phase Ⅱ study evaluating the efficacy and safety of talimogene laherparepvec in combination with ipilimumab versus ipilimumab alone in patients with advanced, unresectable melanoma. J Clin Oncol, 2018, 36: 1658-67. |
| [62] |
Park AK, Fong Y, Kim SI, et al. Effective combination immunotherapy using oncolytic viruses to deliver CAR targets to solid tumors. Sci Transl Med, 2020, 12: eaaz1863. |
| [63] |
Fajardo CA, Guedan S, Rojas LA, et al. Oncolytic adenoviral delivery of an EGFR-targeting t-cell engager improves antitumor efficacy. Cancer Res, 2017, 77: 2052-63. |
| [64] |
Chastkofsky MI, Pituch KC, Katagi H, et al. Mesenchymal stem cells successfully deliver oncolytic virotherapy to diffuse intrinsic pontine glioma. Clin Cancer Res, 2021, 27: 1766-77. |
| [65] |
Wen P, Huang H, Zhang R, et al. Coacervate vesicles assembled by liquid-liquid phase separation improve delivery of biopharmaceuticals. Nat Chem, 2025, 17: 279-88. |
| [66] |
Wu Q, Huang H, Sun M, et al. Inhibition of tumor metastasis by liquid-nitrogen-shocked tumor cells with oncolytic viruses infection. Adv Mater, 2023, 35: e2212210. |
| [67] |
Wu MR, Nissim L, Stupp D, et al. A high-throughput screening and computation platform for identifying synthetic promoters with enhanced cell-state specificity (SPECS). Nat Commun, 2019, 10: 2880. |
 2025, Vol. 37
2025, Vol. 37 

 叶海峰,华东师范大学特聘教授、生命科学学院院长,国家重点研发计划首席科学家、国家高层次人才入选者。任教育部科技委交叉科学与未来技术专门委员会委员、中国生物工程学会理事。2007—2013年在瑞士苏黎世联邦理工学院(ETH Zurich) 从事博士和博士后研究工作,2013年被授予ETH Zurich最高荣誉奖章。课题组聚焦人工生物分子机器的设计与动态调控研究,致力于构建具有创新机制的遗传控制系统,并以此为基础开发智能化活体药物体系。研究工作重点围绕代谢性疾病、肿瘤及衰老等重大健康问题,旨在通过多学科交叉融合,探索精准治疗的全新策略与技术路径,为相关疾病的临床干预提供理论支撑与应用范式。近年来,基于合成生物学理念,建立了一系列遗传控制系统,开发智能活体药物用于代谢病和肿瘤的精准可控的基因治疗和细胞治疗,相关研究成果以通讯作者身份发表在Sci Transl Med、Sci Adv、Nat Biotech、Nat Cancer、Nat Biomed Eng、Nat Chem Biol、Nat Commun、Proc Natl Acad Sci USA、Molecular Cell、Cell Systems、Cell Rep Med等期刊。申请发明专利20余项,授权10余项
叶海峰,华东师范大学特聘教授、生命科学学院院长,国家重点研发计划首席科学家、国家高层次人才入选者。任教育部科技委交叉科学与未来技术专门委员会委员、中国生物工程学会理事。2007—2013年在瑞士苏黎世联邦理工学院(ETH Zurich) 从事博士和博士后研究工作,2013年被授予ETH Zurich最高荣誉奖章。课题组聚焦人工生物分子机器的设计与动态调控研究,致力于构建具有创新机制的遗传控制系统,并以此为基础开发智能化活体药物体系。研究工作重点围绕代谢性疾病、肿瘤及衰老等重大健康问题,旨在通过多学科交叉融合,探索精准治疗的全新策略与技术路径,为相关疾病的临床干预提供理论支撑与应用范式。近年来,基于合成生物学理念,建立了一系列遗传控制系统,开发智能活体药物用于代谢病和肿瘤的精准可控的基因治疗和细胞治疗,相关研究成果以通讯作者身份发表在Sci Transl Med、Sci Adv、Nat Biotech、Nat Cancer、Nat Biomed Eng、Nat Chem Biol、Nat Commun、Proc Natl Acad Sci USA、Molecular Cell、Cell Systems、Cell Rep Med等期刊。申请发明专利20余项,授权10余项