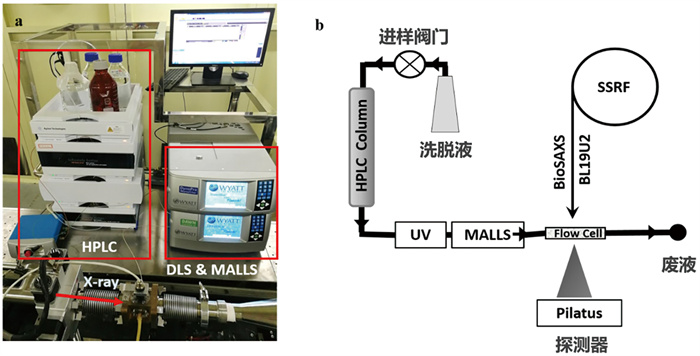
蛋白质分子是一切生命活动的基础,由20种不同的氨基酸通过肽键相连形成线性的高分子链。蛋白质分子的三维空间结构决定了其催化活性、分子识别及分子调控功能,进而影响基因表达、信号转导以及代谢调节等重要的生命活动[1]。蛋白质的生物功能与其结构和动力学特征密切相关,因此针对具有生理功能的蛋白质分子,从时间和空间维度开展研究,对于准确理解蛋白质“结构、动力学和功能”具有重要的现实意义[2]。传统的结构表征方法获得的蛋白质结构信息通常是一个或者几个静态结构[3],虽然提供了解读其功能的重要线索,但是缺少了时间信息和动力学演化过程的重要部分。随着结构生物学领域的发展,关键的科学问题往往要求对生物大分子静态结构之外的动力学的表征研究,因此越来越多的研究者开始重点关注蛋白质的动态结构以及复杂生物体系各组分随时间的变化信息[4, 5]。
国家蛋白质科学研究(上海)设施(以下简称“蛋白质设施”)这所集蛋白质科学技术之大成的大科学装置,正是中国在全球新一轮科技革命蓬勃兴起的时刻,洞察科技发展未来趋势,在面向人民生命健康的蛋白质科学领域所作的重大战略布局。作为全球生命科学领域首个综合性大科学装置,蛋白质设施自2015年正式建成并开放运行以来,已成为我国蛋白质科学研究的重要支撑平台[6]。其中,位于上海同步辐射光源的生物小角X射线散射(biological small-angle X-ray scattering, BioSAXS)线站BL19U2,作为国内首个用于溶液生物大分子小角散射实验的专用平台,凭借其在溶液生理状态下对生物大分子进行原位、无损、高通量、快速的多尺度结构表征技术优势,已成为研究蛋白质等生物大分子动态构象变化、超大“分子机器”复合体组装过程以及评价蛋白质结构稳定性的重要研究工具[7]。
当前,结构生物学领域主流的生物物理检测技术,生物大分子晶体学(X-ray crystallography, MX)、核磁共振(nuclear magnetic resonance, NMR)、冷冻电子显微(cryo-electron microscopy, Cryo-EM)技术,已分别基于各自的技术特点逐渐发展出特定的方法学来探测蛋白质分子构象的变化。例如MX领域有基于劳厄衍射方法的“泵浦-探测”实验方法[8, 9],但该方法局限于光敏蛋白体系的研究,因为溶液状态的变化很难同步作用于晶体内部大量的分子,而且晶体的堆积往往限制结构的变化;NMR技术可以有效提供溶液体系的分子动力学信息,但由于信号的复杂性,其仅适用于分子量较小的体系[10];Cryo-EM技术在近年取得了举世瞩目的突破,不仅可以用于解析单分子状态下的分子结构,也开始被用于研究多构象的体系,但现有的方法还不能很好地提供结构随时间变化的动力学过程信息,检测体系仍局限于具有较大分子量的生物大分子复合体[11]。
通过与以上方法的详细比较(表 1),BioSAXS技术可以在很大程度不受这些方法的局限。其主要技术优势包括:(1)能够提供生物大分子及其复合物低分辨率的结构信息,在溶液生理状态下即可进行实验,检测过程不受分子量以及测试体系浓度的限制;(2)实验测试时间相对较短(在第三代同步辐射光源,毫秒曝光时间就可以获得一帧信噪比足够好的散射数据用于结构分析);(3)对样品稳定性要求较低,且能够反映溶液中生物大分子构象的系综平均[12]。通过SAXS技术快速测量溶液生理状态下生物分子体系随时间变化的过程,捕捉一系列时间变化特征曲线,结合计算机建模和动力学模拟的方法,可以进一步获得精细的动力学过程。此外,SAXS还可与其他技术,如高效液相色谱(high performance liquid chromatography, HPLC)、停流-混流(stop-flow)装置、微流控(microfluidic)连续流装置联用,实现对蛋白质结构变化的实时监测。近年来,随着人工智能技术的发展,SAXS数据的分析与建模效率和准确性也得到了显著提升,为蛋白质动态结构研究带来了新的机遇。
| 表 1 常见蛋白质结构解析方法的技术优势和局限性比较 |
本文旨在综述蛋白质设施自运行以来,SAXS技术的发展历程及其在蛋白质科学研究中的应用进展。首先,介绍散射技术国内外发展现状及发展趋势;随后,重点回顾SAXS技术在蛋白质设施中的技术演进,包括设备升级、数据采集与分析平台的优化等;接着,结合典型应用案例,探讨SAXS在蛋白质动态结构、蛋白质相互作用以及超分子复合体自组装体系研究中的应用;最后,展望SAXS技术与人工智能等新兴技术的融合前景,以及该技术在蛋白质科学研究中的未来发展方向。
1 同步辐射小角散射技术的发展现状与趋势 1.1 全球主要同步辐射小角散射线站小角X-射线散射(SAXS)是一项检测物质微观结构且在结构生物学领域有重要贡献的技术[13]。近年来,随着同步辐射光源的应用与发展、分子生物学研究的不断深入以及针对生物样本散射信号数据分析算法的不断进步,SAXS在解析蛋白质结构研究中的重要性引起了结构生物学研究者的广泛关注。
目前,全球范围内多个同步辐射光源已建有专用的BioSAXS线站,用于支持生物大分子在溶液状态下的结构研究。这些线站在能量范围、光子通量、光斑尺寸、样品处理系统及探测器配置等方面各具特点,代表了当前国际生物SAXS研究平台的高水平。表 2列举了全球具有代表性的几条BioSAXS线站的主要技术参数,涵盖了欧洲、美洲、亚洲的多个重要同步辐射装置[14-21]。
| 表 2 全球主要同步辐射BioSAXS线站的技术参数比较 |
其中,位于德国汉堡PETRA Ⅲ同步辐射光源的P12线站光通量较高,在常规双晶单色器(double crystal monochromator, DCM)模式下,光通量可达到1013 Phs/s,在增强多层膜单色器(double multilayer monochromator, DMM)模式下,光通量可达到5×1014 Phs/s,适用于快速时间分辨(亚毫秒量级)的散射数据采集。同时,P12线站自动化程度高,配备多个Pilatus系列面探测器,是国际上应用最广泛的BioSAXS实验平台之一。位于英国Diamond同步辐射光源的Ⅰ22线站光通量中等,约为6×1012 Phs/s,但其光斑尺寸可调,具备多元化的原位样品装置,可支持多种纳米尺度结构表征实验方法的联用。位于法国SOLEIL同步辐射光源的Swing线站擅长开展具有柔性分子链的软物质结构表征,光通量约为5×1012 Phs/s,线站配有高灵敏度的Merlin探测器。位于美国APS同步辐射光源的18-ID线站光通量最高可达2×1013 Ph/s@12 keV,尤其适合原位时间分辨散射实验,线站同时配备有Mar CCD及Pilatus探测器,保证了线站时间分辨散射实验的稳定性。
与国际同类BioSAXS线站相比,位于中国上海同步辐射光源的BL19U2线站在多项核心参数上已达到国际领先水平:
光通量与能量范围:BL19U2线站能够提供4.5×1012 Phs/s的稳定光通量,与国际同类先进线站的光通量非常接近;线站能量范围在7~15 keV可调,可以满足蛋白质、核酸、膜蛋白、胶原蛋白等大部分生物样品的检测需求。
多尺寸聚焦光斑:BL19U2线站可根据样品特点与检测需求调整样品处光斑尺寸(大光斑:330 (H)×40 (V) μm2或微小光斑:10 (H)×10 (V) μm2);同时线站具备微量样品的检测能力,在实验方法与实验装置选择的灵活性上优于大部分同类国际线站。
原位样品检测环境:BL19U2线站不仅配备有自动样品处理机械手、温控样品池,还支持分子筛层析柱联用、离子交换柱在线分离、动态组装过程结构表征功能,全面满足高通量、多环境变量的生物大分子动态结构研究的需求。
高性能探测器系统:BL19U2线站配备有Pilatus 300k-W探测器用于WAXS信号采集、Pilatus 2M探测器用于SAXS信号采集,可实现原位WAXS与SAXS的散射数据联采;其高帧率、无读出噪声和低散射背景保证了线站采集到的散射数据质量,非常适合开展时间分辨SAXS等前沿应用。
综上,BL19U2线站虽然通量略低于PETRA Ⅲ光源的P12和APS光源的18-ID线站,但在聚焦光斑的可调节范围、原位样品装置多样性、溶液样品处理自动化水平以及探测器配置等方面,均已达到或优于国际同类散射线站的先进水平。作为中国首条面向生物大分子结构研究的专用BioSAXS线站,BL19U2已在蛋白质折叠、生物大分子复合物组装、膜蛋白结构表征等领域取得大量重要成果,体现出其作为国际一流平台的科研支撑能力。
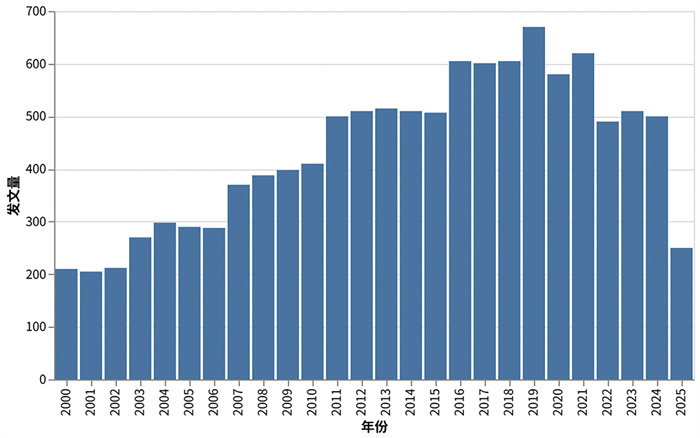
1.2 溶液小角散射技术国内外文献总体出版情况为全面了解国内外溶液SAXS技术及相关研究领域的发展水平,根据Web of Science核心合集数据库文献收录情况,以“溶液小角散射(Solution SAXS)”为关键词,将2000年—2025年间发表文章进行统计(图 1)。结果表明,溶液SAXS技术相关研究总发文量11 312篇,年均发文量452.5篇。其中,英文文献发文量10 245篇,年均发文量449.7篇;中文文献总发文量40篇,年均发文量1.7篇;日文文献发文量27篇,年均发文量1.17篇。
|
图 1 2000—2025年度溶液SAXS技术领域文章出版量时间序列变化 |
根据统计结果,溶液SAXS技术领域的文献出版情况整体呈波动增长的态势。自2007年开始,呈现明显的增长趋势,这与全球同步辐射装置的建设以及探测器技术的突破息息相关。在2019年文献出版数量达到高峰之后,2020年起文献出版量有一定回落,或许与新冠疫情的暴发有所关联。
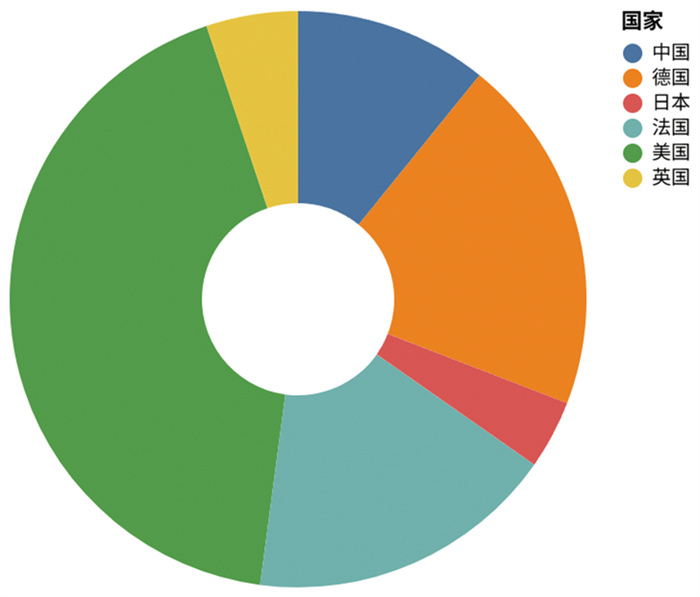
为进一步了解溶液SAXS技术发展及应用现状,基于Web of Science核心合集数据库筛选与总结,分析不同国家(地区)在此研究领域做出的贡献。结果表明,发文量排名前6的国家(地区)共发表文章10 143篇(图 2),占比97.36%,依次为美国、德国、法国、中国、英国和日本。其中,溶液SAXS技术领域中国(大陆地区)发文量在2014—2015年之前增长较平缓,但在2016—2019年间呈快速增长态势(2020年新冠疫情暴发之后有一定回落)。而位于上海同步辐射光源的中国首条适用于溶液SAXS体系研究的BL19U2线站恰于2015年正式运行开放,这证明了BL19U2线站的建成与运行对于国内溶液SAXS技术及相关研究领域的发展起到了十分重要的促进作用。
|
图 2 2000—2025年度不同国家在溶液SAXS技术领域发文量统计情况 |
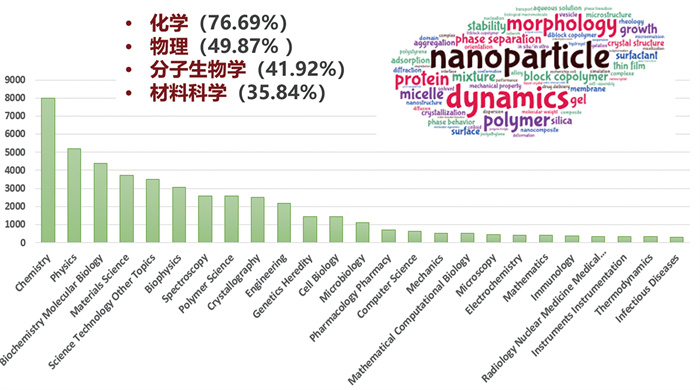
溶液小角散射主要用于分析溶液体系中散射体颗粒的尺寸分布、形状因子、纳米尺度微观结构等。研究对象涵盖胶体分散体系、生物大分子溶液、高分子溶液、乳液等。为更深入地了解国内外溶液SAXS技术应用领域的发展状况,根据Web of Science核心合集数据库筛选与总结,将2000—2025年间出版的11 312篇有关溶液SAXS技术的研究文献以研究方向作为分类进行统计(含学科交叉),其中化学类占比最大(76.69%),其次为物理类(49.87%)、分子生物学(4 368篇,41.92%)和材料科学(3 734篇,35.84%)。若以更为精细的学科方向进行划分,溶液SAXS技术在蛋白质科学(2 580篇,22.81%)、基因遗传学(1 457篇,12.88%)、细胞生物学(1 448篇,12.80%)、微生物学(1 107篇,9.78%)、制药科学(702篇,6.21%)等研究领域都有着广泛的应用(图 3)。通过进一步对Web of Science核心合集数据库搜索得到的关键词进行聚类和突现分析,发现“纳米粒子”“药物递送”“动力学”“蛋白质”“生物溶液”“表界面”“自组装”“原位实验方法”等是当前溶液SAXS研究领域的热点方向。
|
图 3 2000—2025年度溶液SAXS技术主要应用领域统计情况 |
位于上海同步辐射光源的国家蛋白质科学研究(上海)设施生物小角散射线站,主要研究方向聚焦蛋白质等生物大分子溶液状态下的构象、动态变化以及生物分子之间的相互作用,于2015年正式面向全球用户开放。作为中国首条生物溶液散射专用同步辐射线站(图 4),BL19U2线站在光通量、光稳定性、光发散度、光斑尺寸、能量分辨率以及实验站自动化程度方面持续进行性能升级,线站使用波荡器作为光源,光束线的设计方案采用类K-B镜聚焦模式,即光束的水平聚焦和垂直聚焦分别由2个压弯柱面镜完成,从而得到满足实验要求的聚焦光斑[14]。BL19U2同时在实验站配有能量范围可调、多元化的原位样品检测环境;通过进一步整合小角散射和广角散射技术,目前在BL19U2线站可获得更大的可测量散射矢量q范围(0.05~20 nm-1),空间检测尺度范围可覆盖1~1 000 nm[22, 23]。
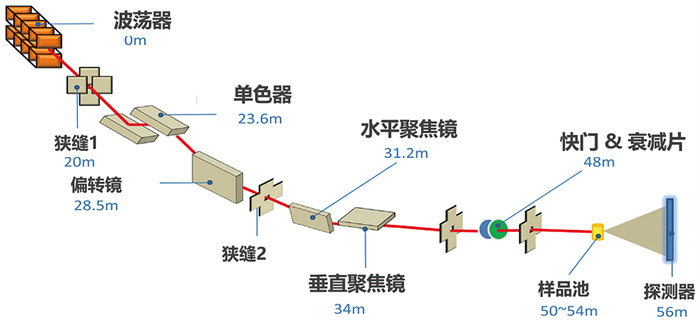
|
图 4 同步辐射生物小角散射线站BL19U2布局[14] |
生物大分子体系的主要组分为C、H、O、N、P等轻原子,这些原子经X-射线照射后对X-射线的散射程度非常低,样本的散射信号与相应缓冲液的本底散射信号之间的强度差值非常小;并且生物分子通常都具有活性,维持生物分子在溶液生理状态下的活性与这些分子行使正常的生物学功能息息相关。这些特殊的性质对样品检测适用的散射实验装置提出了更高的要求。由国家蛋白质科学研究(上海)设施负责运行的基于上海光源的BL19U2生物溶液小角散射线站,具有光通量高以及准直性好的特点。线站自主开发了多元化的溶液小角散射原位实验装置,同时配备有快速数据采集探测器以及自动散射数据分析处理程序,使得弱散射体系的小角散射测量以及结构演化动力学时间分辨测定更为方便。自2015年通过验收正式开放以来,BL19U2线站共服务全球超过80家单位的数百个科研团队,技术成果共促进科研用户产出SCI论文748篇(一区文章共计445篇,CNS论文共计7篇);支持企业用户技术开发项目7项;主持发布脂质药物散射检测方法团体标准1项、参与发布细胞与基因治疗产品团体标准1项;团队开发的纳米颗粒粒度检测散射方法获CNAS认证,有效促进和支撑了我国生物医药产业的发展。线站主要原位实验装置概述如下。
2.2.1 真空溶液自动进样散射实验装置BL19U2实验站十年间共发展了三代自动溶液进样装置(图 5)。其中一代进样装置采用铜块作为毛细管样品池支架,一般用于非真空散射数据收集。该装置单次测试可同时检测6个样品和2个样品对应的缓冲体系。二代进样装置常与真空管道联用,单次可检测24个样品,减少了换样次数,提高了实验效率。三代进样装置主要进行了三个方面的性能提升:(1)将液体蠕动泵以及样品池干燥、清洗组件集成于装置内部,提升了整个装置的集成度;(2)具有更高的样品检测通量,单次可同时检测24个1.5 mL体积Eppendorf管以及36个0.5 mL体积PCR管,也可以集成1块标准96孔测试板,极大地提升了样品的散射数据收集通量;(3)减少了检测样品的体积用量,考虑到生物样品纯化表达的难度,新研制的样品装置通过优化进样管路以及机械手臂的取样方式,优化了单个样品测试所需的用量,单个样品的最少用量为15 μL。
2.2.2 SEC-SAXS在线分离纯化散射实验装置生物样品的小角散射检测对样品的均一性要求很高。针对单分散性差、稳定性不高的生物大分子溶液体系,可以通过在BL19U2散射装置上整合样品分离纯化HPLC,将分子排阻色谱(size exclusion column, SEC)与SAXS原位装置进行整合,进而根据SEC洗脱曲线有针对性地对分离后的单一组分进行散射数据的实时收集[14, 22]。在此基础上,SEC-SAXS装置可以与多角度静态光散射(multi-angle laser light scattering, MALLS)、动态光散射(dynamic light scattering, DLS)、示差折射(refractive index, RI)和紫外(ultra violet, UV)检测器整合,可针对多分散性较高的测试体系,在线与SAXS方法联用,整合多种生物物理实验方法对单分散性较差的样品进行结构表征。目前SEC-SAXS模式已在BL19U2线站稳定开放运行(图 6)。
2.2.3 时间分辨散射实验装置时间分辨散射实验(time resolved SAXS, TR-SAXS) 可以为复杂的生物反应过程提供有价值的结构表征,例如蛋白质和RNA折叠[24]。同步辐射X-射线的高亮度可为测试体系提供高时空分辨率的实验工具,使溶液SAS实验方法能够在线跟踪反应过程中研究对象的微观结构动态变化过程和反应体系中分子间的相互作用。
BL19U2实验站配备快速停流-混流(stopped-flow)反应装置(SFM2000,Bio-Logic Inc.),可提供时间分辨率为毫秒量级的生物大分子结构动力学研究方法。该装置反应死时间 < 20 ms,液体混和比例范围可控(1:1~1:100),生物大分子SAXS测试最低样品检测体积为200 µL。该设备与BL19U2在线探测器整合控制,可以达到最快3 ms的时间分辨检测率(图 7a)。

|
图 7 同步辐射生物小角散射线站时间分辨散射实验装置[25] |
考虑到生物样品在X射线照射下容易发生辐照损伤的物理特性,同时为了满足生物大分子动态结构表征更快时间尺度的研究需求,BL19U2线站还配备有自研的微流控溶液混合芯片(图 7b),可以满足2种液体的在线原位混合连续流散射实验研究需求。该装置的混合死时间 < 1 ms,最大混合流速为5 mL/s,配合线站自研的时间斩波器使用,可以开展最快20 µs的时间分辨散射实验[25]。
2.2.4 “泵浦-探测”原位散射实验装置除了通过改变溶液环境组分触发动态反应的Stopped-Flow和微流芯片散射实验装置之外,针对生物大分子相互作用、自组装以及相变过程结构动力学的研究,BL19U2线站配置了更多“泵浦-探测”触发反应的方式,包括温度扫描与跳变、压力扫描与跳变、力场(拉力、磁力等)作用与变化以及光催化动态反应等原位散射实验方法[26-29]。目前BL19U2线站可以实现可控温度范围-175~350 ℃ (控温精度为±0.1 ℃)的原位变温实验、可控拉力范围0~200 N且拉伸速度范围1~5 000 µm/s的原位拉伸实验以及磁力范围0~3 000 G连续改变磁场且0~400 MPa的连续加压实验。线站同时配备了波长为445 nm的LED光源,可以开展特定光感蛋白光动力学结构表征的“激光-泵浦”研究(图 8)。
2.2.5 散射数据自动分析软件SAS-cam随着同步辐射SAXS技术在生物大分子结构研究中的广泛应用,自动化数据处理软件的开发成为提升数据分析效率和准确性的关键。BL19U2线站围绕同步辐射散射数据采集中高通量实验的需求,采用Python语言开发了针对SAXS数据自动处理的软件系统SAS-cam[31]。该软件具备快速处理大量散射数据的能力,集成模块使用标准库(如NumPy和PIL)处理SAXS数据,且每分钟可处理200~250帧数据。背景扣除模块去除了样品数据中的噪声,进一步提高了数据质量。该软件利用SASTBX程序包进行模型解释,能够提取生物大分子关键的结构信息并实时优化实验参数。这种自动化处理大大提高了用户在同步辐射线站数据采集的工作效率,能够在数据采集过程中快速评估数据质量,并根据反馈调整实验参数,进而现场优化实验设计(图 9)。
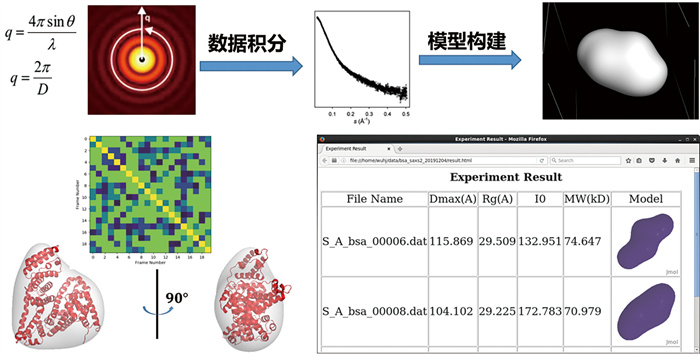
|
图 9 同步辐射生物小角散射线散射数据自动分析软件SAS-cam[31] |
同步辐射SAXS技术可以不受检测体系分子量的限制,在溶液生理条件下表征蛋白质及其复合物的生理活性结构;同时该技术具备高通量、快速结构表征的能力,且可以与其他高分辨率生物物理实验技术(如X射线晶体学、NMR和Cryo-EM)相结合,推动整合结构生物学的发展,帮助蛋白质科学研究人员更全面地理解生物大分子的结构与功能。因此,即使SAXS技术检测分辨率不高(空间分辨率可达到1~2 nm),近年已逐渐发展为蛋白质科学研究的重要工具。SAXS在蛋白质科学整合结构生物学研究中的应用主要表现在如下方面。
3.1 高分辨原子结构的快速验证与补充SAXS可用于快速验证已知高分辨原子结构(如晶体结构、Cryo-EM重构结构)与其溶液生理活性结构的一致性。在验证结构一致性的基础上,该技术还适用于预测晶体结构中缺失结构域或柔性铰链区域的构象。
2025年1月8日,凯斯西储大学医学院杨泗春课题组在Nature期刊发表了题为“The sequence-structure-function relationship of intrinsic ERα disorder”的研究论文[32],首次揭示了雌激素受体α (ERα)中一个关键的分子调控机制。ERα在乳腺癌的发展中扮演着关键角色,其内在的无序性是构效关系研究中的难点。杨泗春课题组利用SEC-SAXS技术,结合顺磁核磁共振(paramagnetic-NMR)光谱学、粗粒化计算模拟和功能应用研究,揭示了ERα无序区域的“序列-结构-功能”关系,这一突破性研究为开发新一代乳腺癌治疗药物开辟了新途径(图 10)。
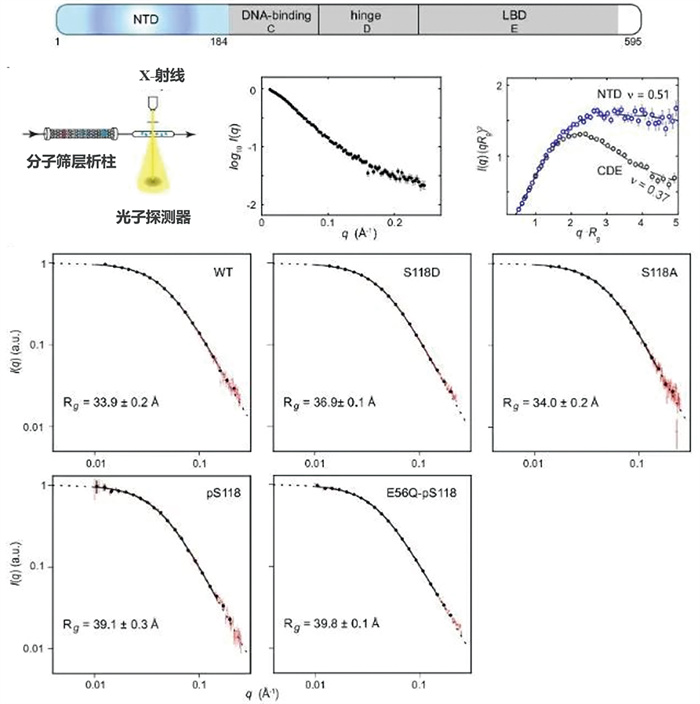
|
图 10 SEC-SAXS数据分析及ER-NTD结构无序性研究[32] |
SAXS结合时间分辨技术,在生物大分子动态结构表征中具有独特优势。TR-SAXS技术能够实时监测蛋白质等生物大分子在生理活性条件下的构象变化,解析瞬态中间体结构,研究重要生命过程调节的分子机制。TR-SAXS技术可以与其他结构生物学技术互补,推动对蛋白质功能分子机制的深入理解。
2025年1月4日,俄罗斯科学院莫斯科物理与技术学院Alexy课题组在International Journal of Biological Macromolecules期刊发表了题为“Ferritin-based hybrid macromolecules experience unusual shift of stoichiometry distribution”的研究论文[33]。该研究工作基于BL19U2溶液散射线站在研究蛋白质复合物组装和动态变化过程结构信息的技术优势,通过调控铁蛋白(Ferritin)组装过程中缓冲体系的pH值,采用停流-混流TR-SAXS技术对组装产物的结构特性进行了表征。研究团队还基于SAXS数据开发了一种定量评估混合物中不同组装亚型分布的算法,通过将实验数据与模型拟合,首次提出了描述24聚体Ferritin自组装过程所有可能结构模式的方案(图 11)。
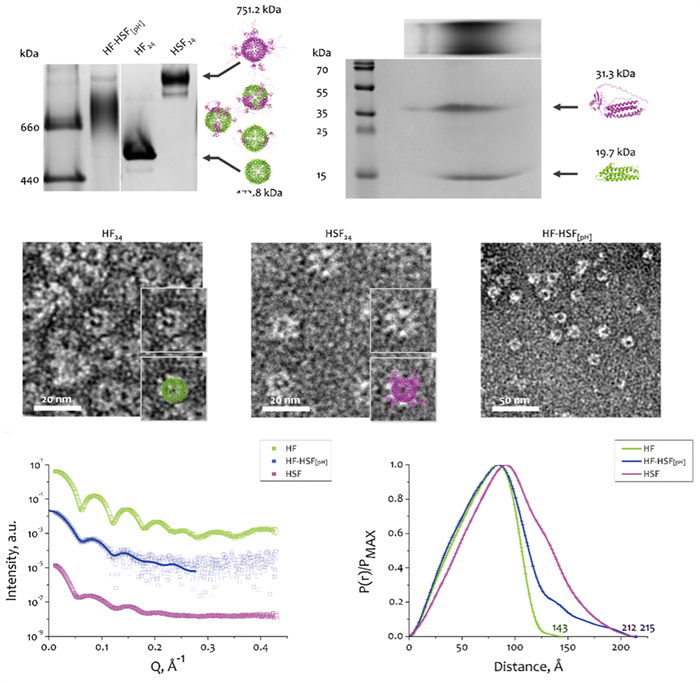
|
图 11 基于同步辐射TR-SAXS技术研究铁蛋白自组装动态结构[33] |
SAXS技术在研究生物大分子复合体结构,尤其是蛋白质-蛋白质,蛋白质与小分子、核酸等配体的相互作用方面具有独特优势。SAXS能够在接近溶液生理条件下原位检测蛋白质复合体的整体形貌、构象变化以及多聚状态等信息,尤其适用于研究动态性强、柔性区域多或难以结晶的生物大分子复合体。通过将SAXS提供的整体形貌信息与其他技术(如X射线晶体学、NMR和Cryo-EM)获得的局部高分辨率结构信息相结合,可以构建更为准确和全面的复合体结构模型,深入理解其功能机制。SAXS现已被成功应用于膜蛋白-去垢剂复合物、蛋白质-核酸复合物以及多蛋白结构域复合体结构特征的应用研究中。
2024年9月3日,中国科学院脑科学与智能技术卓越创新中心竺淑佳团队联合包括BL19U2线站在内的多家科研机构,在Nature Structural & Molecular Biology期刊发表了题为“Structural basis for antibody- mediated NMDA receptor clustering and endocytosis in autoimmune encephalitis”的研究论文[34]。该研究揭示了自身免疫性脑炎中抗体介导的NMDA受体聚集和内吞作用的结构基础。SAXS在该研究中提供了抗原-抗体复合物溶液生理条件下活性构象的结构数据,验证了抗体与NMDA受体的结合模式及复合体在病理状态下的分子机制,从而为理解自身免疫性脑炎的发病机制提供了关键证据。进一步功能实验表明,设计结合NMDA受体R1结构域表位的肽段或小分子可能是一种治疗NMDA受体自身免疫性脑炎的潜在新策略。这项研究不仅为NMDA受体自身免疫性脑炎的诊断提供了关键的生物标志物,还为开发自身免疫性脑炎靶向性治疗方法提供了新的理论依据(图 12)。
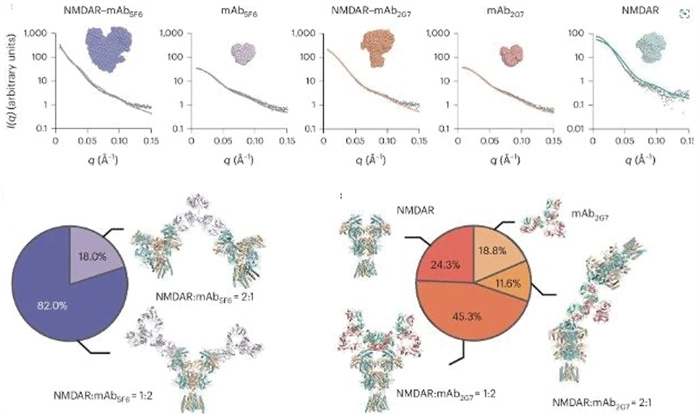
|
图 12 基于同步辐射SAXS技术的NMDA受体-mAb结合模式定量分析[34] |
生物相分离体系的物理学特性、形成机制、生物学功能是当前生命科学领域的研究热点。SAXS技术独特的溶液样品环境为研究相分离发生的分子机制提供了实验条件。在SAXS检测中,可以快速地获取蛋白质等生物大分子在液-液相分离(liquid-liquid phase separation, LLPS)过程中粒子的尺寸、整体形状、聚集状态、构象变化以及粒子与介质的界面结构和相分离程度等结构参数。通过与分子动力学模拟等计算方法结合,SAXS技术为揭示生物大分子LLPS过程中的结构演变和相互作用机制提供了强有力的工具。
2025年1月10日,中国科学技术大学项晟祺教授课题组、侯中怀教授课题组和姚雪彪教授课题组在Nature Chemical Biology期刊在线发表了题为“The molecular mechanism of temperature-dependent phase separation of heat shock factor 1”的研究论文[35]。该研究首次发现了热休克转录因子1 (heat shock factor 1, HSF1)通过相分离传导温度调控效应。研究团队综合利用生物化学、核磁共振波谱学、统计物理和分子动力学模拟等多学科手段,成功解析了HSF1编码温度响应能力的化学代码,阐明了翻译后修饰对其活性的调控机制。项目团队基于BL19U2线站采集的SAXS数据,获得了HSF1单体结构域在5 ℃ 和 37 ℃ 稀溶液中的尺寸分布。结果表明,野生型RD (WT)和突变体RD (M1 和 M2 ) 回转半径(Rg) 大小有显著差异,从分子水平直接揭示了野生型HSF1典型的低临界溶液温度相分离特征(图 13)。
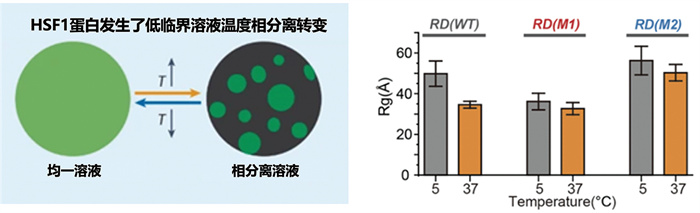
|
图 13 基于同步辐射SAXS技术的相分离体系结构表征[35] |
同步辐射SAXS技术在研究环境变量触发的生物大分子结构变化中具有重要意义。通过结合“泵浦-探测”实验设计,SAXS能够实时监测溶液条件下环境刺激(如温度、pH、离子强度、光照、压力、磁场等)引发的蛋白质构象变化和组装的动态过程。通过进一步与其他结构生物学技术(如X射线晶体学、NMR、Cryo-EM)和计算模拟方法结合,SAXS技术可以为揭示生物大分子在环境变化下的结构动态和功能机制提供强有力的研究工具。
2025年2月1日,云南师范大学化学与化工学院孙洋团队联合BL19U2溶液散射团队,在Food Hydrocolloids在线发表了题为“Surfactant Charge Tuning Alters Casein Micelle Structure and Complexation Behavior”的研究论文[36]。该研究揭示了具有不同电荷性质的表面活性剂如何在分子尺度调控酪蛋白胶束的结构特性。本研究聚焦山羊酪蛋白胶束(goat casein micelle, GCM)结构的动态调控,分别采用常规SAXS溶液模式、尺寸排阻色谱(SEC)-SAXS模式以及时间分辨SAXS模式,系统研究了具有不同电荷性质的表面活性剂与酪蛋白胶束相互作用时,胶束结构从静态到动态的组装结构变化过程。基于SAXS测试结果,研究人员首次获得了GCM和表面活性剂形成的纳米簇复合物动态结构特征(图 14)。
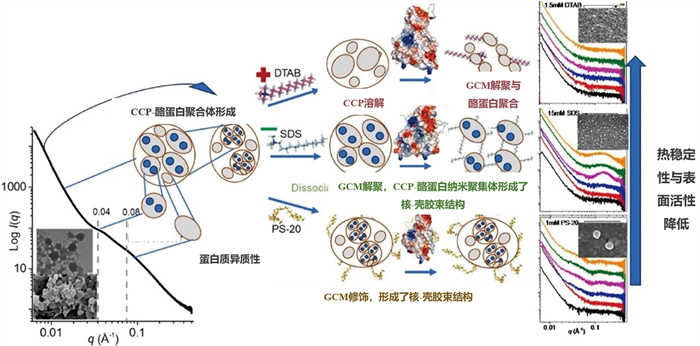
|
图 14 基于同步辐射SAXS技术研究表面活性剂电荷调控羊酪蛋白胶束结构形成的分子机制[36] |
当前,人工智能(artificial intelligence, AI)与同步辐射SAXS技术的融合正推动结构生物学和材料科学研究进入高通量、自动化和智能化的新阶段。SAXS技术因其在纳米尺度独特的结构表征能力,已成为研究蛋白质、核酸等生物大分子结构的重要工具。随着同步辐射光源高通量数据采集能力的提升,传统的SAXS数据处理方法面临着数据量大、处理速度慢、模型选择依赖经验等挑战。AI技术,特别是机器学习和深度学习方法,已被应用于SAXS数据分析中,显著提高了数据处理的效率和准确性。在此基础上,AI还被用于SAXS图像的降噪处理,提升了图像质量,减少了对高质量参考数据的依赖,进而推广到在SAXS实验方案设计中的应用[37]。
AlphaFold的出现为蛋白质结构预测带来了革命性的进展。然而,AlphaFold预测的结构与实验SAXS数据之间可能存在差异,尤其是在处理多态性和柔性区域时,AlphaFold的结构预测精度仍有待提升。采用AI辅助的实验控制系统能够根据实时分析结果,自动调整实验参数,实现实验的闭环控制,同时可以进一步优化AlphaFold预测结构与SAXS实验数据之间的拟合度,提升了结构建模的准确性[38, 39]。
4.2 AI辅助的同步辐射SAXS技术在药物开发领域的应用潜力当前,AI已在药物开发各阶段展现出整合性潜力,为结构驱动的药物设计提供了科学研究新范式。在靶点识别与先导化合物筛选方面,AI模型可从SAXS低分辨率结构中挖掘生物大分子动态结构信息,提高药物结合位点预测的精度[40]。在小分子药物设计与优化方面,结合AI驱动的分子生成算法,可基于SAXS实验数据,快速验证候选小分子与靶标蛋白的结构适配性,加快结构优化迭代[41]。在跨尺度分子建模方面,AI可将SAXS数据与AlphaFold等结构预测模型整合,实现从序列到复合体结构的多尺度建模,推动蛋白质复合物机制解析与药物筛选[42]。
5 总结与展望蛋白质设施建成十年以来,位于上海同步辐射光源的BL19U2生物小角X射线散射线站不断拓展技术边界,现已发展为国内领先、具有国际影响力的同步辐射溶液SAXS实验平台。该线站不仅实现了从静态结构分析到时间分辨动态结构表征的技术跃迁,还围绕蛋白质溶液体系的多尺度结构特征,开发了一系列原位散射实验装置与高效算法工具,显著提升了散射实验数据的采集效率与生物大分子结构建模的准确性。BL19U2线站服务用户数量逐年增长,支撑了诸如膜蛋白复合物、相分离体系、药物作用机制等多个前沿方向的原创性研究,充分发挥了蛋白质设施在基础研究与技术创新中的核心支撑作用。
展望未来,SAXS技术将在生物大分子多尺度动态结构解析、整合结构生物学平台建设、人工智能辅助蛋白质构效关系挖掘等方向迎来更多机遇。尤其在AI与结构预测模型结合、低分辨率结构与高分辨率技术的互补生物大分子动态结构解析方面,BL19U2线站将进一步拓展自身在新药研发、疾病发生分子机制研究等场景中的应用,加强同蛋白质设施其他技术系统的跨平台协同,通过持续创新与协同发展,不断拓展生命科学研究的深度与广度,为国家重大科学需求提供技术支撑。
| [1] |
Alberts B, Heald R, Johnson A, et al. Molecular Biology of the Cell (7th ed.). New York, USA: W. W. Norton & Company, 2022. |
| [2] |
Campbell EC, Correy GJ, Mabbitt PD, et al. Laboratory evolution of protein conformational dynamics. Curr Opin Struct Biol, 2018, 50: 49-57. |
| [3] |
Wallin E, Heijne GV. Genome-wide analysis of integral membrane proteins from eubacterial, Archaean, and eukaryotic organisms. Protein Sci, 1998, 7: 1029-38. |
| [4] |
Johansson KE, Lindorff-Larsen K. Structural heterogeneity and dynamics in protein evolution and design. Curr Opin Struct Biol, 2018, 48: 157-63. |
| [5] |
Khrennikov A, Yurova E. Automaton model of protein: dynamics of conformational and functional states. Prog Biophys Mol Biol, 2017, 130: 2-14. |
| [6] |
王大成, 秦文明, 李娜, 等. 结构生物学研究在中国. 生物化学与生物物理进展, 2014, 41: 944-71. |
| [7] |
德米特里S, 迈克尔K, 彼得T, 等著. 生物大分子小角散射: 理论、计算与应用[M]. 李娜, 刘广峰, 吴洪金, 等译. 北京: 清华大学出版社, 2019
|
| [8] |
Kubo M, Nango E, Tono K, et al. Nanosecond pumb-probe device for time-resolved serial femtosecond crystallography developed at SACLA. J Synchrotron Radiat, 2017, 24: 1086-91. |
| [9] |
Chollet M, Alonso-Mori R, Cammarata M, et al. The X-ray pump-probe instrument at the linac coherent light source. J Synchrotron Radiat, 2015, 22: 503-7. |
| [10] |
Jacques DA, Trewhella J. Small-angle scattering for structural biology-Expanding the frontier while avoiding the pitfalls. Protein Sci, 2010, 19: 642-57. |
| [11] |
Richard H. Avoiding the pitfalls of single particle cryo-electron microscopy: Einstein from noise. Proc Natl Acad Sci USA, 2013, 110: 18037-41. |
| [12] |
Hura GL, Menon AL, Hammel M, et al. Robust, high-throughput solution structural analyses by small angle X-ray scattering (SAXS). Nat Methods, 2009, 6: 606-13. |
| [13] |
Guinier A. 30 years of small-angle X-ray scattering. Phys Today, 1969, 22: 25-30. |
| [14] |
Li N, Li XH, Wang YZ, et al. The new NCPSS BL19U2 beamline at the SSRF for small-angle X-ray scattering from biological macromolecules in solution. J Appl Crystallogr, 2016, 5: 1428-32. |
| [15] |
Blanchet CE, Spilotros A, Schwemmer F, et al. Versatile sample environments and automation for biological solution X-ray scattering experiments at the P12 beamline (PETRAⅢ, DESY). J Appl Crystallogr, 2015, 48: 431-43. |
| [16] |
Smith AJ, Alcock SG, Davidson LS, et al. Ⅰ22: SAXS/WAXS beamline at diamond light source - an overview of 10 years operation. J Synchrotron Radiat, 2021, 28: 939-47. |
| [17] |
Thureau A, Roblin P, Perez J. BioSAXS on the SWING beamline at synchrotron SOLEIL. J Appl Crystallogr, 2021, 54: 1698-710. |
| [18] |
Fischetti R, Stepanov S, Rosenbaum G, et al. The BioCAT undulator beamline 18ID: a facility for biological non-crystalline diffraction and X-ray absorption spectroscopy at the advanced photon source. J Synchrotron Radiat, 2004, 11: 399-405. |
| [19] |
Herranz-Trillo F, Sorensen HV, Dicko C, et al. Time-resolved scattering methods for biological samples at the CoSAXS beamline, MAX Ⅳ laboratory. Methods Enzymol, 2024, 709: 245-96. |
| [20] |
Schneider D, Berman LE, Chubar O, et al. Three biomedical beamlines at NSLS-Ⅱ for macromolecular crystallography and small-angle scattering. J Phys Conf Ser, 2013, 425: 012003. |
| [21] |
Matsui T, Rajkovic I, Mooers BHM, et al. Adaptable SEC-SAXS data collection for higher quality structure analysis in solution. Protein Sci, 2024, 33: e4946. |
| [22] |
Liu GF, Li YW, Wu HJ, et al. Upgraded SSRF BL19U2 beamline for small-angle X-ray scattering of biological macromolecules in solution. J Appl Crystallogr, 2018, 51: 1633-40. |
| [23] |
Li YW, Liu GF, Wu HJ, et al. BL19U2: small-angle X-ray scattering beamline for biological macromolecules in solution at SSRF. Nucl Sci Tech, 2020, 31: 117. |
| [24] |
Pollack L. Time resolved SAXS and RNA folding. Biopolymmers, 2011, 95: 543-9. |
| [25] |
李娜, 宋攀奇, 刘广峰, 等. 一种基于高能光源的微流控液体混合实验装置: 中国, 202321469511.9[P]. 2023-11-17
|
| [26] |
宋攀奇, 张建桥, 李怡雯, 等. 溶液小角散射技术在软物质研究中的应用与展望. 化学学报, 2022, 80: 690-702. |
| [27] |
刘广峰, 李怡雯, 张建桥, 等. 适用于同步辐射小角X射线散射的高压溶液装置及其应用. 高压物理学报, 2025, 39: 020101. |
| [28] |
李娜, 刘广峰, 吴洪金, 等. 一种适用于溶液高通量筛选的真空自动样品装置及真空样品室: 中国, 201811403928.9[P]. 2024-01-26
|
| [29] |
李娜, 张建桥, 刘广峰, 等. 用于高能光源的原位溶液样品高通量筛选自动化测试系统: 中国, 202221902418.8[P]. 2022-11-08
|
| [30] |
Huang LQ, Mai JG, Zhu QH, et al. Reversible rearrangement of magnetic nanoparticles in solution studied using time-resolved SAXS method. J Synchrotron Radiat, 2019, 26: 1294-301. |
| [31] |
Wu HJ, Li YW, Liu GF, et al. SAS-cam: a program for automatic processing and analysis of small-angle scattering data. J Appl Crystallogr, 2020, 53: 1147-53. |
| [32] |
Du ZW, Wang H, Luo SQ, et al. The sequence-structure-function relationship of intrinsic ERα disorder. Nature, 2025, 638: 1130-8. |
| [33] |
Gette MS, Sudarev VV, Osipov SD, et al. Ferritin-based hybrid macromolecules experience unusual shift of stoichiometry distribution. Int J Biol Macromol, 2025, 293: 139335. |
| [34] |
Wang H, Xie C, Deng B, et al. Structural basis for antibody-mediated NMDA receptor clusgtering and endocytosis in autoimmune encephalitis. Nat Struct Mol Biol, 2024, 31: 1987-96. |
| [35] |
Ren QN, Li LG, Liu L, et al. The molecular mechanism of temperature-dependent phase separation of heat shock factor 1. Nat Chem Biol, 2025, 21: 831-42. |
| [36] |
Yang LY, Che MJ, Luo YY, et al. Surfactant charge tuning alters casein micelle structure and complexation behavior. Food Hydrocolloids, 2025, 164: 111145. |
| [37] |
Molodenskiy DS, Svergun DI, Kikhney AG. Artificial neural networks for solution scattering data analysis. Structure, 2022, 30: 900-8. |
| [38] |
Brookes E, Rocco M, Vachette P, et al. AlphaFold-predicted protein structures and small-angle X-ray scattering: insights from an extended examination of selected data in the small-angle scattering biological data bank. J Appl Crystallogr, 2023, 56: 910-26. |
| [39] |
Patt E, Classen S, Hammel M, et al. Predicting RNA structure and dynamics with deep learning and solution scattering. Biophys J, 2025, 124: 549-64. |
| [40] |
Zhang K, Yang X, Wang YF, et al. Artificial intelligence in drug development. Nat Med, 2025, 31: 45-59. |
| [41] |
Chen PC, Masiewicz P, Perez K, et al. Structure-based screening of binding affinities via small-angle X-ray scattering. IUCr J, 2020, 7: 644-55. |
| [42] |
Zhou BX, Zheng LR, Wu BH, et al. A conditional protein diffusion model generates artificial programmable endonuclease sequences with enhanced activity. Cell Discov, 2024, 10: 95. |
 2025, Vol. 37
2025, Vol. 37 

 李娜,教授级高级工程师,国家蛋白质科学研究(上海)设施党支部书记、同步辐射生物小角X-射线散射线站科学家、中国晶体学会小角散射委员会委员、中国生物物理学会分子生物物理委员会委员。2006年获华东师范大学动物学硕士学位,2009年获法国巴黎萨克雷大学生物物理学博士学位。同年加入法国居里研究所做博士后研究,2011年加入国家蛋白质科学研究(上海)设施,主要从事同步辐射溶液散射方法学及其在软物质领域的应用研究工作。现已以第一作者、通讯作者和共同作者的身份在国际知名期刊发表学术论文93篇;作为项目负责人主持科研项目合计17项;提交专利申请9项,授权6项;出版学术专著、译著4部。技术成果共促进用户产出748篇文章(SCI一区文章共计445篇),同时担任多家学术期刊审稿人。于2017年入选中国科学院青年创新促进会会员,2021年入选中国科学院首批特聘研究岗位“骨干研究员”,2022年入选上海市青年科技人才协会,2023年入选中国科学院关键技术支撑人才,同年入选国际标准化协会ISO/TC24/SC4工作组专家,2024年入选上海市浦东新区“明珠计划”。瑞士Dectris公司根据在她多肽药物设计及自组装动态结构研究中的贡献,于2022年授予其Dectris Award奖项
李娜,教授级高级工程师,国家蛋白质科学研究(上海)设施党支部书记、同步辐射生物小角X-射线散射线站科学家、中国晶体学会小角散射委员会委员、中国生物物理学会分子生物物理委员会委员。2006年获华东师范大学动物学硕士学位,2009年获法国巴黎萨克雷大学生物物理学博士学位。同年加入法国居里研究所做博士后研究,2011年加入国家蛋白质科学研究(上海)设施,主要从事同步辐射溶液散射方法学及其在软物质领域的应用研究工作。现已以第一作者、通讯作者和共同作者的身份在国际知名期刊发表学术论文93篇;作为项目负责人主持科研项目合计17项;提交专利申请9项,授权6项;出版学术专著、译著4部。技术成果共促进用户产出748篇文章(SCI一区文章共计445篇),同时担任多家学术期刊审稿人。于2017年入选中国科学院青年创新促进会会员,2021年入选中国科学院首批特聘研究岗位“骨干研究员”,2022年入选上海市青年科技人才协会,2023年入选中国科学院关键技术支撑人才,同年入选国际标准化协会ISO/TC24/SC4工作组专家,2024年入选上海市浦东新区“明珠计划”。瑞士Dectris公司根据在她多肽药物设计及自组装动态结构研究中的贡献,于2022年授予其Dectris Award奖项