(2 上海交通大学医学院,上海市免疫学研究所,上海 200025)
(2 Shanghai Institute of Immunology, Shanghai Jiao Tong University School of Medicine, Shanghai 200025, China)
免疫细胞治疗是一种利用人体自身或供体来源的免疫细胞,通过体外培养、扩增、活化或基因修饰等操作,再回输到患者体内,以激发或增强机体免疫功能的治疗方法。免疫细胞治疗的核心在于通过激活和增强免疫细胞的功能,使其能够更有效地识别和攻击癌细胞,这种疗法通常被称为过继性细胞治疗(adoptive cell therapy, ACT)。
自2017年,全球首个嵌合抗原受体T细胞(chimeric antigen receptor T cells, CAR-T)治疗药物Kymriah获美国食品和药物管理局(FDA)批准上市,7年来免疫细胞治疗得到了全球科技界与产业界的持续关注,针对新型免疫细胞疗法的研发如火如荼地开展,全球的研发管线也在不断增加。2024年是全球免疫细胞治疗领域爆发的一年。在适应证层面,一系列新的临床试验验证了CAR-T疗法在自身免疫性疾病中的治疗潜力,相关研究成果被Science杂志评为2024年度十大科学突破;在产品层面,全球首款治疗黑色素瘤的肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte cells, TIL)疗法和首款治疗滑膜肉瘤的T细胞受体嵌合T细胞(T cell receptor-gene engineered T cells, TCR-T)疗法陆续获批上市,免疫细胞治疗正式被用于实体瘤的治疗,其已从探索期进入到全面产业化阶段。
1 前沿进展免疫细胞治疗分为工程化免疫细胞疗法和非工程化免疫细胞疗法。工程化免疫细胞疗法主要包括CAR-T细胞疗法、TCR-T疗法、嵌合抗原受体自然杀伤细胞(chimeric antigen receptor natural killer cells, CAR-NK)疗法、嵌合抗原受体自然杀伤性T细胞(chimeric antigen receptor natural killer T cells, CAR-NKT)疗法、嵌合抗原受体巨噬细胞(chimeric antigen receptor macrophages, CAR-M)疗法、嵌合抗原受体γδT细胞(chimeric antigen receptor γδ T cells, CAR-γδT)等;非工程化免疫细胞疗法主要包括TIL疗法、调节性T细胞(regulatory T cells, Treg)疗法、细胞因子诱导的杀伤细胞(cytokine-induced killer, CIK)疗法、树突细胞(dendritic cell, DC)疗法等。目前,免疫细胞治疗还存在治疗靶点受限、T细胞衰竭、肿瘤免疫逃逸、细胞因子释放综合征等挑战,有待持续优化构建策略,拓宽细胞来源,拓展适应证范围,进一步提升免疫细胞治疗的安全性、有效性及应用潜力。本文聚焦CAR-T、CAR-NK、TCR-T、TIL等最主要的免疫细胞治疗类型,分析2024年在这些技术领域的最新进展。
1.1 CAR-T细胞治疗CAR-T细胞治疗是最受关注的免疫细胞治疗领域。解决T细胞耗竭问题、优化疗效、拓展在实体瘤等新适应证的应用和强化基因编辑等新工具赋能是2024年度CAR-T细胞治疗领域的布局重点。在应对T细胞耗竭问题方面,研究人员通过操纵或增补限制T细胞干性的调节因子,提升T细胞长期的抗肿瘤作用。2024年4月,Nature杂志背靠背发表两篇论文,证实了转录因子FOXO1可增强CAR-T细胞活力,防止其耗竭,并验证了过表达FOXO1可提升CAR-T细胞干性、代谢适应性,从而增强其抗肿瘤,特别是抗实体瘤的能力[1][2]。美国斯坦福大学医学院等证明可通过直接补充或过表达腺苷脱氨酶增加肌苷水平,从而增强CAR-T细胞干性,并建议在细胞制造环节引入肌苷以获得更强效的CAR-T细胞[3]。2024年12月,苏州系统医学研究所等证实通过补充D-甘露糖来增强/恢复过继转移T细胞的甘露糖代谢,可以增强抗肿瘤活性,并限制T细胞体外和体内的衰竭分化[4]。在优化疗效层面,外源性细胞因子工程化被认为是增强T细胞抗肿瘤作用的重要解决方案。瑞士洛桑联邦理工学院发现,表达IL-10的CAR-T细胞可抵抗功能障碍,并介导实体瘤和转移瘤的持久清除[5]。耶鲁大学等验证了将IL-4纳入CAR-T细胞治疗产品制造过程,增强其2型功能,可以增强肿瘤免疫治疗的疗效[6]。贝勒医学院等评估了IL-15共表达对靶向GPC3 CAR-T细胞的影响以及对实体瘤患者的治疗效果,结果显示,与单独的GPC3 CAR-T细胞相比,共表达IL-15的GPC3 CAR-T细胞在患者体内的扩增显著增加,抗肿瘤反应显著增强[7]。在拓展适应证层面,CAR-T细胞疗法在脑胶质瘤治疗、延缓衰老等领域的应用持续得到验证。麻省总医院等提出一种新CAR-T产品——CARv3-TEAM-E T细胞,成功应用于胶质母细胞瘤患者的治疗,打破了CAR-T细胞在异质性较大的肿瘤治疗中的局限性[8]。冷泉港实验室使用CAR-T细胞靶向衰老细胞高表达的蛋白——尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator, uPA),能够选择性清除衰老细胞,让老年小鼠恢复活力[9]。此外,基因编辑等新工具为CAR-T细胞研究领域提供了强有力的赋能作用。斯坦福大学开发了一种基于CRISPR-Cas13d的多重RNA编辑平台MEGA,可用于T细胞的多重转录调控,有助于增强CAR-T细胞的体外和体内适应性和抗肿瘤活性[10]。
1.2 CAR-NK细胞治疗拓展细胞来源、挖掘新的治疗靶点、创新递送载体和提升大规模生产工艺是2024年度CAR-NK细胞治疗领域的布局重点。在细胞来源拓展方面,采用干细胞技术制备NK细胞成为该领域的重要趋势。北京干细胞与再生医学研究院利用基因工程技术和类器官诱导技术,获得人胚胎干细胞来源的Mesothelin CAR-iNK (MSLN CAR-iNK)细胞,其具有高效杀伤MSLN阳性卵巢癌细胞的能力,具有成为现货式(off-the-shelf)细胞制剂的转化潜力[11]。新靶点的发现持续拓展CAR-NK细胞的应用潜力。浙江大学医学院附属第二医院首先报道了CD70 CAR-NK细胞在治疗CD19阴性B细胞淋巴瘤中的良好应用前景,为其临床转化应用提供了科学依据[12]。在递送载体方面,纳米脂质体等新型递送载体成为重要的研究领域。韩国成均馆大学采用含有1, 2-二油酰基-3-三甲基铵丙烷(DOTAP)的双功能脂质纳米粒(DLNP),有效提升CAR-NK的递送效率[13]。随着CAR-NK进入到大规模产业化阶段,细胞培养设备与反应设备的优化成为生产工艺提升的重要一环。美国罗格斯大学使用G-Rex 100M生物反应器开发了一种大规模、可靠和实用的NK和CAR-NK生产工艺[14],德国法兰克福大学使用CliniMACS Prodigy(R)平台自动生成大量靶向CD33的CAR-NK细胞[15],两所大学均表示相关工艺可用于支持NK细胞免疫治疗的未来临床应用。
1.3 TCR-T细胞治疗虽然TCR-T与CAR-T同属于过继性T细胞疗法,但TCR-T可以靶向的靶点不仅包括细胞表面抗原,还包括细胞内部抗原。因此,TCR-T技术拥有比CAR-T更广泛的应用,特别在实体瘤领域,TCR-T更容易向实体瘤内部渗透,可靶向抗原库的范围比CAR-T细胞疗法更大,目前靶点主要集中于肿瘤-睾丸(cancer/testis, CT)抗原、新抗原(neoantigen)等。2024年,优化TCR-T结构、建立筛选与评估工具是TCR-T细胞治疗领域的布局重点。在结构优化方面,札幌医科大学利用密码子优化建立针对顺铂耐药相关肿瘤相关抗原CLSPN的特异性强效TCR-T细胞[16]。伦敦大学学院利用外源性CD3ζ的加入增强TCR表达水平和抗原特异性T细胞功能[17]。德国美天旎生物技术公司验证了共表达CD33-CAR和dNPM1-TCR的CAR'TCR-T细胞在治疗急性髓系白血病中的优越性,可显著提高抗肿瘤活性,并最大限度地降低抗原逃逸的风险[18]。在筛选与评估工具建立方面,上海交通大学医学院附属第一人民医院和苏州科锐迈德生物医药科技有限公司共同开发了一种基于环状RNA转导moDC的体外抗原特异性TCR筛选方法[19]。北京大学利用肿瘤类器官发展了一种在体外快速识别肿瘤特异性T细胞受体的方法[20]。
1.4 TIL细胞治疗优化TIL结构、提升细胞扩增与筛选能力是2024年度TIL细胞治疗领域的布局重点。在结构优化方面,皇家马德里大学医院研发了可分泌EGFR/CD3双特异性T细胞衔接器(T-cell engager, TCE)的TIL细胞(TILSTAb),并验证了其在体外和体内的抗肿瘤活性[21]。在提升细胞扩增与筛选方面,研究人员进一步明确了可用于治疗的TIL的筛选标准。哈佛大学医学院将肿瘤免疫微环境(tumor immune microenvironment, TIME)与TIL的扩增联系起来,结果显示,FoxP3细胞中低CD8+ FoxP3比率和高PD-1表达等特征值得研究,可成为TIL成功扩增的潜在生物标志物[22]。
1.5 其他细胞治疗除了CAR-T、CAR-NK、TCR-T、TIL等免疫细胞治疗外,CAR-NKT、CAR-M、Treg等新型细胞治疗也受到越来越多的关注。在CAR-NKT领域,卡罗莱纳大学证明CAR-NKT细胞可以共表达PD1和TIM3,且与CAR-T细胞相比具有更优的抗肿瘤活性,PD1阻断和疫苗接种可增强CAR-NKT细胞的抗肿瘤活性[23]。加州大学洛杉矶分校基于造血干细胞研发了通用的CAR工程NKT (UCAR-NKT)细胞,其显示出良好的安全性,移植物抗宿主病和细胞因子释放综合征的风险较低[24]。在CAR-M领域,北京大学鲲石生物科技有限公司发现基于DNA折纸术的组装球体可以更好地评价嵌合抗原受体巨噬细胞(CAR-M)的细胞毒性和肿瘤杀伤能力[25]。在Treg细胞疗法领域,牛津大学采用Treg细胞疗法联合阿仑珠单抗用于肾移植患者,从而减轻活体肾移植中的免疫抑制[26]。韩国庆熙大学证明了过继性Treg细胞疗法可以抑制小胶质细胞活化,从而治疗阿尔茨海默病[27]。
2 临床转化随着技术的不断成熟,免疫细胞治疗产品的临床与转化应用进程持续加快。根据Cortellis数据库显示,截至2024年底,共有1 040个免疫细胞治疗产品进入临床试验阶段,其中有621个为CAR-T细胞治疗产品,占其中的59.7%,临床应用的深入为新产品的产业化提供了重要支撑。
2.1 中美两国为全球临床试验最为活跃的区域从临床试验开展的国家来看,截至2024年底,在美国与中国开展免疫细胞治疗临床试验的产品数量远超其他国家,其中,在美国开展临床试验的免疫细胞治疗产品502个,全球占比48.3%,位居首位;在中国开展临床试验的免疫细胞治疗产品489个,全球占比47.0%,位居第二位(表 1)。
| 表 1 截至2024年底全球免疫细胞治疗产品的临床试验国家分布 |
从临床试验阶段来看,免疫细胞治疗产品临床试验主要处于临床Ⅰ期和Ⅱ期,其中临床Ⅰ期560个,临床Ⅱ期395个,临床Ⅲ期20个(图 1)。从产品类型来看,CAR-T细胞治疗产品仍是进入临床阶段最多的免疫细胞类型,总数约占进入临床阶段的免疫细胞治疗产品的2/3。从整体成熟度来看,免疫细胞治疗还是处于临床早期,虽然基于血液瘤的CAR-T细胞治疗领域已有多个产品上市,但在实体瘤、免疫系统疾病、传染病等其他适应证领域,以及CAR-NK、TCR-T、TIL等其他产品类型方面,正处于蓬勃发展期。
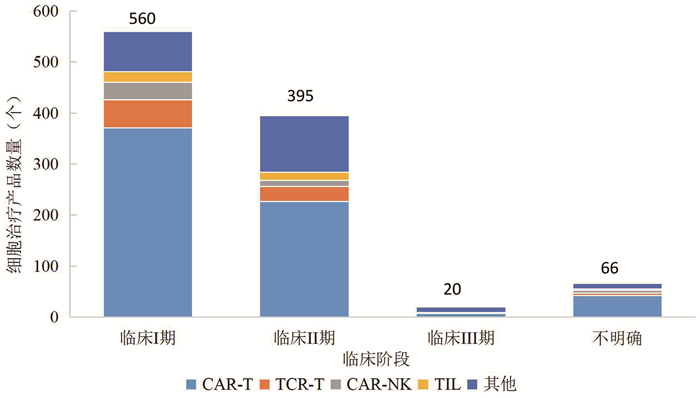
|
数据来源:Cortellis数据库 图 1 截至2024年底全球免疫细胞治疗产品的临床试验阶段分布(单位:个) |
对截至2024年全球进入临床阶段的免疫细胞治疗药物研发机构的分布情况分析显示,美国作为免疫细胞治疗的源起国,在药物研发方面优势显著,相关机构包括国家癌症研究所(NCI)、贝勒医学院、M.D.安德森癌症中心、宾夕法尼亚大学、斯隆-凯特林癌症研究所、Kite Pharma Inc.和百时美施贵宝。其中宾夕法尼亚大学和斯隆-凯特林癌症研究所是CAR-T细胞治疗的发源地,Kite Pharma Inc.和百时美施贵宝均已有产品上市。从我国来看,主要有3家机构,包括深圳基因免疫医学研究所、浙江大学和AbelZeta Inc. (原西比曼)。深圳基因免疫医学研究所专注于CAR-T等免疫细胞治疗产品的研发,针对血液肿瘤、实体肿瘤、自身免疫性疾病等领域有26个CAR-T、CTL等产品处于临床试验阶段,在所有机构中名列第二位(表 2)。
| 表 2 截至2024年底全球进入临床阶段的免疫细胞治疗产品的研发机构分布 |
避开热门CD19和B细胞成熟抗原(B cell maturation antigen, BCMA)赛道,寻找差异化的竞争优势是目前进入临床的产品共同的特点。2024年4月,专注于开发和推广自体、异体和CAR-NK的生物技术公司NKGen Biotech,宣布其用于治疗帕金森病的NK细胞疗法SNK01已经获得美国FDA的新药临床研究申请(IND)批准。2024年1月,华夏英泰基于独创STAR-T平台开发的创新靶点LILRB4特异性“YTS104细胞注射液”,获得临床试验默示许可,用于治疗复发/难治性急性髓系白血病(AML)等适应证。2024年3月,瑞顺生物递交的RJMty19注射液(CD19-CAR-DNT细胞治疗药物)治疗CD19阳性的成人复发/难治性B细胞急性淋巴细胞白血病获得临床试验默认许可,表明RJMty19注射液作为全球首款未经基因编辑的“现货通用型” CAR-DNT免疫细胞治疗产品的第三个适应证也正式进入注册临床试验。2024年4月,广东暨德康民自主研发的用于治疗原发性肝细胞癌的创新性细胞药物“γδ-T细胞注射液”获得临床试验默示许可,这是中国首个基于γδ-T细胞的创新免疫细胞药物。2024年7月,由羿尊生物自主研发的CNK-UT002细胞注射液的新药临床试验申请获国家药品监督管理局默示许可,这是国内首个获批临床的通用型实体瘤细胞疗法。
此外,免疫细胞治疗的临床应用潜力进一步得到验证。2024年1月,美国M.D.安德森癌症中心报告了CAR-NK细胞疗法在CD19阳性B细胞恶性肿瘤患者中的1/2期临床试验数据,显示CAR-NK细胞在CD19阳性恶性肿瘤患者中具有优异的抗肿瘤活性[28]。2024年9月,美国国家卫生研究院开展了一项TCR-T治疗转移性结直肠癌的Ⅱ期临床试验,结果发现7例患者中有3例患者效果明显,转移性肿瘤消退,并持续4~7个月[29]。值得注意的是,免疫细胞治疗自身免疫性疾病在2024年获得极大的关注,CAR-T疗法用于自身免疫性疾病获评Science杂志2024年度十大科学突破。2024年2月,德国埃尔兰根大学医院采用CAR-T细胞治疗15例自身免疫性疾病患者(8例系统性红斑狼疮、4例系统性硬化症和3例特发性炎性肌炎),结果显示在停止包括糖皮质激素在内的免疫抑制和抗炎药物的情况下,所有患者的临床症状都明显得到缓解[30]。2024年7月,海军军医大学徐沪济团队等使用健康供体来源的CD19靶向CAR-T细胞成功治疗了一名难治性免疫介导的坏死性肌病患者和两名弥漫性皮肤系统性硬化症患者,该成果首次用通用型CAR-T细胞治疗自身免疫疾病,具有里程碑式的意义,徐沪济教授也因此被Nature杂志评为2024年度十大人物[31]。研究中采用的通用型CAR-T细胞治疗产品来源于邦耀生物细胞治疗产品TyU19,该产品于2023年7月获批用于治疗急性B淋巴细胞白血病的临床试验。为了减少异体细胞移植中可能存在的移植物抗宿主病(graft versus host disease, GVHD)风险,该产品采用CRISPR-Cas基因编辑技术对CAR-T细胞进行了基因改造,敲除了TRAC、PD-1、HLA-A、HLA-B以及CIITA,随后进行磁珠分选,分离得到最终产品,在临床试验中展示了显著的疗效和较高的安全性。
此外,免疫细胞治疗与单抗等其他治疗策略的联用也已成为研究的重点方向。浙江大学医学院附属第一医院首次提出CD7 CAR-T细胞治疗与异基因造血干细胞移植序贯治疗这一新的治疗策略,利用患者接受CD7 CAR-T细胞治疗后的骨髓抑制状态,预防可能引发的GVHD [32]。美国斯坦福大学医学院发现CD47抗体与CAR-T细胞联合使用可以保护T细胞免受巨噬细胞的吞噬,并诱导巨噬细胞大量和持续流入,表现出了很强的抗肿瘤协同作用[33]。南方医科大学验证了阿托伐醌通过增强活性氧诱导的肝细胞癌“铁死亡(Ferroptosis)”来增强TCR-T细胞的抗肿瘤疗效[34]。美国Elicio Therapeutics公司验证了接种两亲抗癌疫苗具有增强人TCR-T细胞增殖、活化和抗肿瘤活性的临床潜力,为支持将两亲抗癌疫苗接种与TCR T细胞疗法相结合以增强抗肿瘤活性提供了理论基础[35]。
3 产业化发展2024年,免疫细胞治疗产业进入高速发展阶段,TCR-T、TIL等多种新型细胞治疗药物陆续上市,临床与上市的监管程序持续完善。在投融资层面,除了CAR-T产品外,CAR-NK、CAR-M、TCR-T等新领域的投融资热度不断升温。
3.1 多款免疫细胞治疗产品上市或即将上市从产品上市情况来看,2024年,全球共有6款免疫细胞治疗产品上市或处于上市申请阶段,其中已上市4款,分别为全球首个TIL细胞疗法Lifileucel、全球首个TCR-T细胞疗法Afami-cel、针对CD19的CAR-T细胞治疗药物Aucatzyl和我国第二款靶向BCMA的CAR-T细胞治疗产品泽沃基奥仑赛注射液。
从已上市产品来看,2024年2月,Iovance Biotherapeutics宣布其TIL细胞治疗产品Lifileucel获得FDA批准上市,用于治疗PD-1抗体治疗后进展的晚期黑色素瘤,这是全球首款获批上市的TIL细胞疗法,更是首款获批的治疗实体瘤的免疫细胞疗法。2024年8月,Adaptimmune Therapeutics宣布其TCR-T细胞治疗产品Afami-cel获FDA批准上市,用于晚期滑膜肉瘤的治疗,这是全球上市的首款TCR-T细胞疗法。2024年11月,美国FDA批准了Autolus Therapeutics针对CD19的CAR-T细胞治疗药物Aucatzyl,用于治疗复发或难治性前体B细胞急性淋巴细胞白血病的成年患者,与已批准的同类CAR-T细胞疗法诺华的Kymriah和吉利德的Tecartus相比,Aucatzyl的安全性更高,是FDA批准的第一个无需药品风险评估和减轻策略(risk evaluation and mitigation strategy, REMS)的CAR-T疗法。2024年3月1日,科济药业宣布其CAR-T细胞治疗产品泽沃基奥仑赛注射液获国家药品监督管理局批准上市,用于治疗复发或难治性多发性骨髓瘤,泽沃基奥仑赛是国内上市的第五款CAR-T细胞产品,同时也是第二款靶向BCMA的CAR-T产品(表 3)。
| 表 3 2024年全球新上市的免疫细胞治疗产品(截至2024年底) |
从即将上市的产品来看,Northwest Biotherapeutics的DC细胞疫苗DCVax-L在2023年12月向英国药品和健康产品管理局(Medicines and Healthcare Products Regulatory Agency, MHRA)递交了上市申请,用于治疗脑胶质母细胞瘤。2024年7月,重庆精准生物的CAR-T细胞治疗产品普基仑赛的上市申请获得国家药品监督管理局受理,用于治疗CD19阳性复发/难治性的急性淋巴细胞白血病(ALL)患者(3~21岁),有望成为首款针对儿童白血病的CAR-T细胞治疗产品。2024年11月,华东医药的CAR-T细胞治疗产品IM19的上市申请获得国家药品监督管理局受理,用于治疗复发或难治CD19阳性的非霍奇金淋巴瘤。2024年12月,恒润达生的CAR-T细胞治疗产品润达基奥仑赛注射液获得国家药品监督管理局受理,用于治疗复发/难治性CD19阳性非霍奇金淋巴瘤(表 4)。
| 表 4 2024年全球拟上市的免疫细胞治疗产品(截至2024年底) |
从产品监管层面来看,免疫细胞监管体系日趋完善,产业规范化程度不断提升。国际方面,2024年1月,美国FDA发布《应用人基因组编辑技术的人类基因治疗产品行业指南》(Human Gene Therapy Products Incorporating Human Genome Editing Guidance for Industry),包括产品设计、产品测试、产品制造、非临床安全性评估和临床试验设计等内容,为企业评估基因治疗产品的质量与安全性提供建议。同月,美国FDA发布了《CAR-T细胞产品开发的注意事项行业指南》(Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Guidance for Industry),为CAR-T细胞产品的开发提供了化学、制造和控制(chemistry, manufacturing and controls, CMC),以及药理学、毒理学和肿瘤适应证临床研究设计的相关建议。2024年4月,美国FDA发布了《扩展用于细胞治疗产品的人同种异体细胞的安全性测试》(Safety Testing of Human Allogeneic Cells Expanded for Use in Cell-Based Medical Products),提出细胞安全测试应基于风险分析,考虑细胞的扩增潜力、用于扩增培养细胞的试剂以及基于细胞的医疗产品能够治疗的个体数量。2024年9月,国家卫生健康委员会、国家中医药管理局和国家疾病预防控制局三部委联合发布了《医疗卫生机构开展研究者发起的临床研究管理办法》,有序推动了细胞治疗等前沿技术领域研究者发起的临床研究的开展。2024年11月,国家药品监督管理局发布《细胞治疗产品临床药理学研究技术指导原则(试行)》,阐述了细胞治疗产品临床药理学研究的关键技术、研究内容及评价标准。
在产业支持层面,各国或地区对免疫细胞治疗科技与产业的支持力度持续加大。虽然美国与中国在免疫细胞治疗领域领先全球,印度、巴西等国家从低价产品的供给角度提升全球竞争力,如2024年3月,巴西卫生部所资助的基金会Fundação Oswaldo Cruz (Fiocruz)宣布与美国非营利组织Caring Cross合作,推出3.5万美元/针的CAR-T疗法,用于治疗白血病和淋巴瘤,最终实现产品成本约为美国和欧洲目前批准的CAR-T疗法价格的十分之一。从我国来看,在国家层面,2024年2月正式施行的《产业结构调整指导目录(2024年本)》将细胞培养、细胞治疗药物列入鼓励类产业目录,标志着我国政府对细胞治疗领域的重视和支持达到了新的高度。2024年9月,商务部、卫生健康委员会、国家药品监督管理局三部委联合发布《关于在医疗领域开展扩大开放试点工作的通知》,在北京、上海、广东和海南特定区域允许外商投资企业从事人体干细胞、基因诊断与治疗技术开发和技术应用,助力外资企业开展细胞与基因治疗业务。在地方层面,2024年10月,上海发布《上海市人民政府办公厅关于支持生物医药产业全链条创新发展的若干意见》,明确对仅需完成早期临床试验、确定性临床试验的细胞与基因治疗1类新药,按照规定择优给予一定研发投入支持。2024年10月,北京发布《高质量建设细胞与基因治疗产业集群实施方案(2024-2026年)(征求意见稿)》,旨在充分发挥北京细胞与基因治疗领域原始创新和临床资源优势,加快培育细胞与基因治疗领域新质生产力,建设国际领先的细胞与基因治疗产业集群。2024年10月,天津发布《天津市全链条支持生物医药创新发展的若干意见(征求意见稿)》,提出增强对细胞和基因治疗类药物的检测能力,支持自贸试验区创新基因与细胞治疗管理模式,探索基因与细胞治疗分级分类制度。
3.3 新型免疫细胞疗法成为投融资重点关注领域2024年,根据美国梅萨细胞和基因会议(Cell and Gene Meeting on the Mesa),全球2024年上半年细胞和基因治疗(CGT)行业的投资额达到了109亿美元(约777亿元人民币)。但同时,受到资本寒冬等的影响,细胞和基因治疗行业的投资在达到高峰之后逐渐面临着投资逆风、投资机会下降的情况。
尽管如此,高价值的企业与产品仍受到市场的青睐。如2023年底,亘喜生物凭借BCMA/CD19双靶点自体CAR-T细胞等产品成为首个被跨国药企收购的中国创新药企,并在2024年第一季度完成交易。2024年11月,美国通用型CAR-T细胞研发企业Poseida Therapeutics被罗氏以15亿美元的价格收购,Poseida拥有一个专有技术平台,该平台具备设计、开发和制造同种异体记忆性干细胞样T细胞(T memory stem cell, TSCM)的能力,该类细胞被认为在CAR-T细胞研发中具有显著优势。同月,我国东北制药宣布,拟以1.87亿元收购北京鼎成肽源70%的股权,鼎成肽源是一家专注于研发用于实体瘤的TCR-T细胞疗法的企业。
从已上市与拟上市的产品可以看到,全球靶向CD19和BCMA的CAR-T细胞产品领域已有较多产品上市,同质化情况初现,如何形成区别性竞争优势是获得投资者青睐的关键。据公开信息不完全统计,2024年免疫细胞领域全国共有20余家免疫细胞治疗企业获得融资,其中南华生物、先博生物、中盛溯源、生研生物、邦耀生物等企业融资金额靠前。从产品类型来看,新型免疫细胞疗法成为投资的主角,通用型CAR-T、CAR-NK、CAR-iNK、TCR-T等在投资市场获得更多的机会,将成为未来领域研发的重点(表 5)。
| 表 5 2024年我国免疫细胞治疗领域代表性融资事件情况(截至2024年底) |
免疫细胞疗法作为一种革命性的治疗方式,显著改变了癌症治疗的模式。从发展趋势来看,2024年,针对CD19和BCMA靶点的CAR-T赛道同质化情况已经非常明显,挤压了同类产品上市的利润空间;并且,尽管成熟度最高的CAR-T细胞疗法已进入了全面产业化阶段,但主要针对血液肿瘤,且对于复发或难治性癌症患者,应用局限性仍然显著。因此,不仅是在临床转化层面还是对投融资的吸引力,新型替代性免疫细胞疗法研发的重要性也在显著提升。
研发思路主要有两种,一是对于TIL、CIK、DC、CIK等细胞疗法,主要利用人体的自然防御机制来靶向消除癌细胞,通常具有较少的副作用或风险;二是对于TCR-T、CAR-NK或CAR-M等细胞疗法,通常采用同种异体或异种细胞,或基因修饰细胞,这需要更高水平的细胞操纵能力。此外,对于已经上市的免疫细胞治疗产品,细胞来源的拓展与细胞制备工艺的持续优化仍具有巨大的进步空间,在源头上需要最大程度地解决细胞异质性和批次差异的问题。从制备角度,需要自主开发自动化、封闭式,且能规模化生产细胞药物的设备,进而最终实现细胞药物稳健的低成本生产。总体而言,免疫细胞治疗是细胞与基因治疗赛道中成熟度较高的赛道,其科学价值与经济价值已经得到认可,未来仍然可期。
| [1] |
Doan AE, Mueller KP, Chen AY, et al. FOXO1 is a master regulator of memory programming in CAR T cells. Nature, 2024, 629: 211-8. DOI:10.1038/s41586-024-07300-8 |
| [2] |
Chan JD, Scheffler CM, Munoz I, et al. FOXO1 enhances CAR T cell stemness, metabolic fitness and efficacy. Nature, 2024, 629: 201-10. DOI:10.1038/s41586-024-07242-1 |
| [3] |
Klysz DD, Fowler C, Malipatlolla M, et al. Inosine induces stemness features in CAR-T cells and enhances potency. Cancer Cell, 2024, 42: 266-82. DOI:10.1016/j.ccell.2024.01.002 |
| [4] |
Qiu Y, Su Y, Xie E, et al. Mannose metabolism reshapes T cell differentiation to enhance anti-tumor immunity. Cancer Cell, 2024. DOI:10.1016/j.ccell.2024.11.003 |
| [5] |
Zhao Y, Chen J, Andreatta M, et al. IL-10-expressing CAR T cells resist dysfunction and mediate durable clearance of solid tumors and metastases. Nat Biotechnol, 2024, 42: 1693-704. DOI:10.1038/s41587-023-02060-8 |
| [6] |
Bai Z, Feng B, McClory SE, et al. Single-cell CAR T atlas reveals type 2 function in 8-year leukaemia remission. Nature, 2024, 634: 702-11. DOI:10.1038/s41586-024-07762-w |
| [7] |
Steffin D, Ghatwai N, Montalbano A, et al. Interleukin-15-armoured GPC3 CAR T cells for patients with solid cancers. Nature, 2024. DOI:10.1038/s41586-024-08261-8 |
| [8] |
Choi BD, Gerstner ER, Frigault MJ, et al. Intraventricular CARv3-TEAM-E T cells in recurrent glioblastoma. N Engl J Med, 2024, 390: 1290-8. DOI:10.1056/NEJMoa2314390 |
| [9] |
Amor C, Fernández-Maestre I, Chowdhury S, et al. Prophylactic and long-lasting efficacy of senolytic CAR T cells against age-related metabolic dysfunction. Nat Aging, 2024, 4: 336-49. DOI:10.1038/s43587-023-00560-5 |
| [10] |
Tieu V, Sotillo E, Bjelajac JR, et al. A versatile CRISPR-Cas13d platform for multiplexed transcriptomic regulation and metabolic engineering in primary human T cells. Cell, 2024, 187: 1278-95. DOI:10.1016/j.cell.2024.01.035 |
| [11] |
Liu Y, Zhang M, Shen X, et al. Mesothelin CAR-engineered NK cells derived from human embryonic stem cells suppress the progression of human ovarian cancer in animals. Cell Prolif, 2024, 57: e13727. DOI:10.1111/cpr.13727 |
| [12] |
Guo S, Lei W, Jin X, et al. CD70-specific CAR NK cells expressing IL-15 for the treatment of CD19-negative B-cell malignancy. Blood Adv, 2024, 8: 2635-45. DOI:10.1182/bloodadvances.2023012202 |
| [13] |
Shin H, Han JH, Park JD, et al. Enhancing CAR-NK cells against solid tumors through chemical and genetic fortification with DOTAP-functionalized lipid nanoparticles. Adv Funct Mater, 2024, 34: 2470164. DOI:10.1002/adfm.202470164 |
| [14] |
Wang X, Byrne ME, Liu C, et al. Scalable process development of NK and CAR-NK expansion in a closed bioreactor. Front Immunol, 2024, 15: 1412378. DOI:10.3389/fimmu.2024.1412378 |
| [15] |
Albinger N, Müller S, Kostyra J, et al. Manufacturing of primary CAR-NK cells in an automated system for the treatment of acute myeloid leukemia. Bone Marrow Transplant, 2024, 59: 489-95. DOI:10.1038/s41409-023-02180-4 |
| [16] |
Hori K, Yamada S, Murata K, et al. Establishment of potent TCR-T cells specific for cisplatin-resistance related tumor-associated antigen, CLSPN using codon-optimization. Hum Vaccin Immunother, 2024, 20: 2414542. DOI:10.1080/21645515.2024.2414542 |
| [17] |
Degirmencay A, Thomas S, Holler A, et al. Exploitation of CD3ζ to enhance TCR expression levels and antigen-specific T cell function. Front Immunol, 2024, 15: 1386132. DOI:10.3389/fimmu.2024.1386132 |
| [18] |
Teppert K, Yonezawa Ogusuku IE, Brandes C, et al. CAR'TCR-T cells co-expressing CD33-CAR and dNPM1-TCR as superior dual-targeting approach for AML treatment. Mol Ther Oncol, 2024, 32: 200797. DOI:10.1016/j.omton.2024.200797 |
| [19] |
Shen L, Yang J, Zuo C, et al. Circular mRNA-based TCR-T offers a safe and effective therapeutic strategy for treatment of cytomegalovirus infection. Mol Ther, 2024, 32: 168-84. DOI:10.1016/j.ymthe.2023.11.017 |
| [20] |
Li Z, Ma L, Gao Z, Wang X, et al. Identification and validation of tumor-specific T cell receptors from tumor infiltrating lymphocytes using tumor organoid co-cultures. Cancer Immunol Immunother, 2024, 73: 164. DOI:10.1007/s00262-024-03749-8 |
| [21] |
Aran A, Lázaro G, Marco V, et al. Analysis of tumor infiltrating CD4+ and CD8+ CDR3 sequences reveals shared features putatively associated to the anti-tumor immune response. Front Immunol, 2023, 14: 1227766. DOI:10.3389/fimmu.2023.1227766 |
| [22] |
Einstein DJ, Halbert B, Denize T, et al. Generation and characterization of ex vivo expanded tumor-infiltrating lymphocytes from renal cell carcinoma tumors for adoptive cell therapy. J Immunother, 2024, 47: 361-8. DOI:10.1097/CJI.0000000000000533 |
| [23] |
Zhou X, Wang Y, Dou Z, et al. CAR-redirected natural killer T cells demonstrate superior antitumor activity to CAR-T cells through multimodal CD1d-dependent mechanisms. Nat Cancer, 2024, 5: 1607-21. DOI:10.1038/s43018-024-00830-0 |
| [24] |
Li YR, Zhou Y, Yu J, et al. Engineering allorejection-resistant CAR-NKT cells from hematopoietic stem cells for off-the-shelf cancer immunotherapy. Mol Ther, 2024, 32: 1849-74. DOI:10.1016/j.ymthe.2024.04.005 |
| [25] |
Zhu Q, He X, Liu J, et al. DNA origami assembled spheroid for evaluating cytotoxicity and infiltration of chimeric antigen receptor macrophage (CAR-M). Commun Biol, 2024, 7: 1302. DOI:10.1038/s42003-024-07009-4 |
| [26] |
Brook MO, Hennessy C, Hester J, et al. Late treatment with autologous expanded regulatory T-cell therapy after Alemtuzumab induction is safe and facilitates immunosuppression minimization in living donor renal transplantation. Transplantation, 2024, 108: 2278-86. DOI:10.1097/TP.0000000000005065 |
| [27] |
Park SY, Cha N, Kim S, et al. Blocking microglial proliferation by CSF-1R inhibitor does not alter the neuroprotective effects of adoptive regulatory T cells in 3×Tg Alzheimer's disease mice. Curr Issues Mol Biol, 2024, 46: 2871-883. DOI:10.3390/cimb46040180 |
| [28] |
Marin D, Li Y, Basar R, et al. Safety, efficacy and determinants of response of allogeneic CD19-specific CAR-NK cells in CD19+ B cell tumors: a phase 1/2 trial. Nat Med, 2024, 30: 772-84. DOI:10.1038/s41591-023-02785-8 |
| [29] |
Parkhurst M, Goff SL, Lowery FJ, et al. Adoptive transfer of personalized neoantigen-reactive TCR-transduced T cells in metastatic colorectal cancer: phase 2 trial interim results. Nat Med, 2024, 30: 2586-95. DOI:10.1038/s41591-024-03109-0 |
| [30] |
Müller F, Taubmann J, Bucci L, et al. CD19 CAR T-cell therapy in autoimmune disease - A case series with follow-up. N Engl J Med, 2024, 390: 687-700. DOI:10.1056/NEJMoa2308917 |
| [31] |
Wang X, Wu X, Tan B, et al. Allogeneic CD19-targeted CAR-T therapy in patients with severe myositis and systemic sclerosis. Cell, 2024, 187: 4890-904. DOI:10.1016/j.cell.2024.06.027 |
| [32] |
Hu Y, Zhang M, Yang T, et al. Sequential CD7 CAR T-cell therapy and allogeneic HSCT without GVHD prophylaxis. N Engl J Med, 2024, 390: 1467-80. DOI:10.1056/NEJMoa2313812 |
| [33] |
Yamada-Hunter SA, Theruvath J, McIntosh BJ, et al. Engineered CD47 protects T cells for enhanced antitumour immunity. Nature, 2024, 630: 457-65. DOI:10.1038/s41586-024-07443-8 |
| [34] |
Chen A, Yu Z, Ma N, et al. Atovaquone enhances antitumor efficacy of TCR-T therapy by augmentation of ROS-induced ferroptosis in hepatocellular carcinoma. Cancer Immunol Immunother, 2024, 73: 49. DOI:10.1007/s00262-024-03628-2 |
| [35] |
Drakes DJ, Abbas AM, Shields J, et al. Lymph node-targeted vaccine boosting of TCR T-cell therapy enhances antitumor function and eradicates solid tumors. Cancer Immunol Res, 2024, 12: 214-31. DOI:10.1158/2326-6066.CIR-22-0978 |
 2025, Vol. 37
2025, Vol. 37 

 范月蕾,中国科学院上海营养与健康研究所生命科学信息中心馆员,专利代理人,主要从事生物医药领域产业与技术情报研究与咨询工作。2021年获评“上海优秀科技情报工作者”。主持或参与国家、省市级细胞治疗领域软课题研究与政策制定工作,发表论文30余篇,主编《细胞治疗:技术与产业》等著作;
范月蕾,中国科学院上海营养与健康研究所生命科学信息中心馆员,专利代理人,主要从事生物医药领域产业与技术情报研究与咨询工作。2021年获评“上海优秀科技情报工作者”。主持或参与国家、省市级细胞治疗领域软课题研究与政策制定工作,发表论文30余篇,主编《细胞治疗:技术与产业》等著作; 毛开云,中国科学院上海营养与健康研究所生命科学信息中心研究馆员,主要从事生物领域的产业与技术情报研究、专利信息分析和知识产权分析评议工作。2016年获评全国专利信息实务人才(国家知识产权局)。先后主持和参与科技部、国家卫健委食品司、国家知识产权局、中国科学院、上海市科委等来源的课题,主编《细胞治疗:技术与产业》等著作
毛开云,中国科学院上海营养与健康研究所生命科学信息中心研究馆员,主要从事生物领域的产业与技术情报研究、专利信息分析和知识产权分析评议工作。2016年获评全国专利信息实务人才(国家知识产权局)。先后主持和参与科技部、国家卫健委食品司、国家知识产权局、中国科学院、上海市科委等来源的课题,主编《细胞治疗:技术与产业》等著作