光合作用作为地球上几乎一切生命活动的能量和物质来源,是生物赖以生存的基础,影响着地球的碳氧循环[1]。植物叶绿体是光合作用的场所,它利用光能将二氧化碳和水转化为有机物和氧气,从而为地球生物的生长和繁衍提供碳源和能量。
光为植物光合作用提供能量,是植物生长发育最重要的环境因子之一[2]。植物利用光能进行光合作用,但当光照条件不适合植物生长时,光照可能成为主要的非生物胁迫因素[3]。高光会引起植物叶绿体中活性氧(reactive oxygen species, ROS)的爆发,造成胞内氧化胁迫的产生,损伤叶绿体DNA,导致转录及翻译紊乱,造成类囊体膜结构被破坏,光系统核心蛋白被降解,严重抑制光合作用[4-6]。为了应对高光胁迫,植物进化出多种自我保护机制,如过剩光能的耗散、叶绿体ROS的清除、损伤的光系统蛋白的修复、叶片和叶绿体的移动、气孔的打开或关闭、花青素的产生以及多信号协调反应等。
本世纪初,工程学思想策略与现代生物学、系统科学、物理学、化学及合成科学的融合,形成了以采用标准化表征的生物学部件,在理性设计指导下,重组乃至从头合成新的、具有特定功能的人工元器件乃至人造生命为目标的“合成生物学”[7-9]。合成生物学从最初的微生物系统开始,现在已经发展到包括植物系统在内的真核生物中[10-14]。目前植物将光能转化为有机物的效率仅约1%左右,光能转化效率还有很大的提升空间[15-16],因此,合成生物学的出现,使得以优化设计、系统整合、提高效率为目标的光合作用合成生物学成为国内外新的研究热点,为系统改造光合作用提供了一条崭新的途径。本文主要对近年来合成生物学提高光合作用高光抗性的研究成果进行综述,并分析此领域未来的发展趋势。
1 植物光合作用的光破坏防御机制在叶绿体中,类囊体膜上排列的4种蛋白复合体通过捕获光能并驱动电子传递来推动光合作用。参与光合作用的4种主要蛋白复合体包括:光系统Ⅱ (photosystem Ⅱ, PSⅡ)、细胞色素b6f复合体(cytochrome b6f complex, Cyt b6f)、光系统Ⅰ (photosystem Ⅰ, PSI)以及ATP合酶(ATP synthase, ATPase)(图 1)[17]。其中,PSⅡ是一个多亚基的色素蛋白复合体,在高等植物和藻类的类囊体中起光驱动水氧化和质体醌(plastoquinone, PQ)还原的作用[18],它也是高光胁迫下植物遭受损害的主要位点。当植物遇到强光胁迫时,PSⅡ很容易失活,光合效率迅速下降,称为光抑制[4, 19-20];光抑制降低植物的光合活性,影响植物的生长和产量。
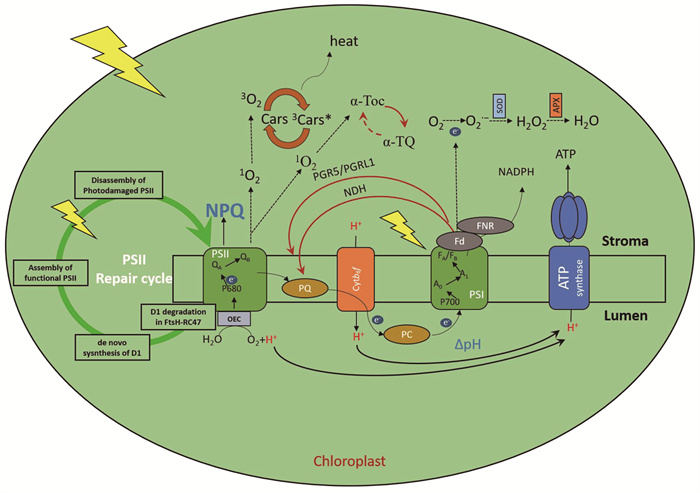
|
叶绿体光破坏防御机制主要包括以下四种:(1)能量依赖的非光化学猝灭(energy-dependent nonphotochemical queching, qE)介导的过多能量的及时耗散;(2)环式电子传递(cyclic electron transport, CEF);(3) ROS的清除;(4) PSⅡ的损伤修复。APX,抗坏血酸过氧化物酶;ATP,三磷酸腺苷;ATP synthase,ATP合酶;Chloroplast,叶绿体;Cyt b6f,细胞色素b6f复合体;Cars,类胡萝卜素;FA/FB,铁硫中心;Fd,铁氧还蛋白;FNR,铁氧还蛋白-NADP还原酶;FtsH,ATP依赖的金属离子型水解酶复合体;Lumen,类囊体腔;NADPH,还原型烟酰胺腺嘌呤二核苷磷酸;NDH,NAD(P)H脱氢酶复合体;OEC,放氧复合体;P680,PSⅡ反应中心色素分子;P700,PSI反应中心色素分子;PC,质体蓝素;PGR5,质子梯度调节蛋白;PGRL1,质子梯度调节类似蛋白;PQ,质体醌;PSI,光系统I;PSⅡ,光系统Ⅱ;QA,PSⅡ主要电子受体;QB,PSⅡ次要电子受体;RC47,缺少CP43的PSⅡ复合体;SOD,超氧化物歧化酶;Stroma,叶绿体基质;ΔpH,跨膜pH梯度;α-Toc,α-生育酚;α-TQ,α-生育酚醌。 图 1 叶绿体光破坏防御机制示意图 |
植物在适应高光强的过程中演化出了多种自我保护机制,其中叶绿体光破坏防御机制主要包括:能量依赖的非光化学猝灭(energy-dependent nonphoto- chemical queching, qE)介导的过多能量的及时耗散、环式电子传递(cyclic electron transport, CEF)、ROS的清除、PSⅡ损伤修复等(图 1),避免ROS所造成的氧化损伤以及促进过量光能的耗散[5],从而保护光合机构。
1.1 非光化学猝灭介导的热耗散植物通过PSⅡ吸收的光能主要有3条去路:(1)进行正常的光合作用,即光化学猝灭;(2)以荧光的形式散失掉,即荧光猝灭;(3)以热能的形式进行耗散,即qE[21]。在适应强光的过程中,植物演化出一种与PSⅡ相关的短期适应状态称为非光化学猝灭(non-photochemical quenching, NPQ)(图 1),包括qE、光合机构(类囊体膜)状态转换猝灭(state transition quenching, qT)、光抑制猝灭(photoinhibition quenching, qI)以及最近发现的一种组成型弛豫较慢的NPQ机制qH[22-25]。
NPQ是光系统最快速、最有效的保护策略之一[26]。研究表明,在较高的光照强度下,qE会在几秒钟内激活能量猝灭,qT会在几分钟后激活,而qI则会在几小时内激活[27]。因此,qE在光破坏防御过程中起非常关键的作用,植物可以通过它迅速地将多余的光能以热能的形式耗散掉,避免过量光能造成伤害。
qE主要由类囊体腔内pH酸化、PSⅡ亚基PsbS和叶黄素循环三个因素调节和控制[28]。PsbS是类囊体腔内外即跨膜pH梯度(ΔpH)的传感器,负责邻近天线蛋白猝灭的开与关[21, 29-32]。高光胁迫首先造成类囊体内pH迅速降低,然后PsbS迅速激活定位在类囊体腔侧的紫黄质去环氧酶(violaxanthin deepoxidase, VDE),从而将紫黄质依次转化为花药黄质和玉米黄质[33-35],增加跨类囊体膜两侧的质子梯度,有利于质子传递,避免光抑制的发生。与高等植物不同,绿藻没有PsbS蛋白,但是有与胁迫有关的捕光复合体LHCSR (light harvesting complex stress-related)蛋白。在强光下,绿藻LHCSR蛋白会大量积累[36],形成的PSⅡ-LHCⅡ-LHCSR3超复合体完成能量耗散[37]。此外,在绿藻中,LHCSR既是ΔpH的传感器,又是过量光能的耗散部位;而在陆生植物中,PsbS只是ΔpH的传感器或qE的调节者,光系统Ⅱ捕光色素复合体(LHCⅡ)是光合作用捕光的重要调节者,也是热耗散的基本部位[30, 38-41]。叶黄素循环在qE的调控中起重要的作用[42]。研究表明,在拟南芥过表达PsbS基因的植株中,qE显著升高,单线态氧1O2减少,进一步说明qE可有效地减少1O2的产生,进而缓解光抑制的发生[43-44]。此外,NADPH硫氧还蛋白还原酶C (NADPH thioredoxin reductase C, NTRC)参与叶黄素循环,说明qE也受氧化还原状态调控[45];玉米黄质和花药黄质共同形成一个特殊的类胡萝卜素颈环结构,该颈环结构对于qE的产生也是必需的[46]。
1.2 环式电子传递植物叶绿体吸收光能后,需要经过电子传递将光能转化为可供植物利用的化学能,为卡尔文-本森-巴萨姆循环和其他的生理生化反应提供能量[47]。叶绿体类囊体膜上的PSⅡ反应中心是光合作用电子传递的起点(电荷分离),PSⅡ的放氧复合体(oxygen evolving complex, OEC)负责水的裂解并释放O2和H+。PSⅡ反应中心色素分子P680被激发释放电子,电子经脱镁叶绿素(pheophytin, Pheo)传递给受体QA和QB,又经质体醌(plastoquinone, PQ)传递至Cyt b6f,Cyt b6f将电子传递给质体蓝素(plastocyanin, PC),然后传递给受光激发电荷分离后失去电子的PSI反应中心色素分子P700+。PSI的初级电子受体A0和次级电子受体A1接受来自激发态P700*的电子,经过一系列铁硫蛋白(FeSX、FeSA和FeSB)传递后,电子被转移给铁氧还蛋白(ferredoxin, Fd),最后电子传递给铁氧还蛋白-NADP还原酶(ferredoxin-NADP reductase, FNR),FNR将NADP+还原为NADPH (图 1)[48]。
当PSI受光激发时,处于激发态的PSI反应中心色素分子P700*将电子传递给铁氧还蛋白(Fd)后,Fd并没有将电子传递给NADP+,而是将电子直接转移到PQ,然后电子经Cyt b6f重新传递回PSI。该电子传递过程只形成质子动力势(proton motive force, pmf),催化ATP合酶形成ATP,而电子并不参与NADPH的产生。这种围绕PSI的电子传递方式称为环式电子传递(CEF)(图 1)[47],CEF是植物缓解光氧化损伤的重要方式之一。在高光胁迫条件下,CEF可以通过增强电子从PSI到PQ的传递速率进而升高跨类囊体膜的质子梯度;CEF的提高可使电子保持在正常的线性电子传递(LEF)和CEF中,电子将优先还原Fd和NADP+,而不是O2,避免了过剩光能对光系统的氧化损伤[49]。
植物体内主要存在分别由PGR5/PGRL1和NDH介导的两条CEF途径,其中PGR5/PGRL1途径被认为在高等植物中起主要作用。研究表明,PGR5/PGRL1途径是植物CEF的主要途径[50-52]。CEF的作用随着光照强度的变化而变化[53]:一方面,依赖于CEF的pmf的产生主要有利于亚饱和光强下ATP的合成,以维持ATP/NADPH的合适比例和满足高效C固定的需要[54-55];另一方面,类囊体腔的酸化可通过激发NPQ和促进Ca2+/H+的运输保护PSⅡ免受光抑制,通过稳定Cyt b6f来调节LEF速率从而保护PSI[56-57]。
1.3 ROS的清除在高光条件下,叶绿体内ROS大量积累,特别是当二氧化碳有限和ATP合成受损时[5]。ROS是一种高活性物质,可通过对PSⅡ的直接损伤导致光抑制的发生,也可通过破坏PSⅡ的修复来加重抑制[58]。叶绿体ROS的主要来源是PSⅡ反应中心(RC)、PSI电子传递链(ETCs)和LHCⅡ [59]。光胁迫下,LHCⅡ吸收光能后使叶绿素(chlorophyll, Chl)分子转化为单线态叶绿素(1Chl),吸收的过剩的能量一部分以荧光形式发射或者以热能形式耗散,衰变成三重(线)激发态3Chl,3Chl通过与分子氧作用产生1O2。PSI电子受体侧发生电子泄漏产生超氧阴离子O2•−,经歧化作用生成H2O2,H2O2随后被非血红素铁进一步转化为羟基自由基OH•;在PSⅡ电子供体侧,水不完全氧化生成H2O2,H2O2进一步还原为OH• [60]。
叶绿体能够通过多种物质协同作用及时将ROS清除,有效避免体内ROS的过度积累,将光损伤降至最低[61],包括超氧化物歧化酶(superoxide dismutase, SOD)、抗坏血酸过氧化物酶(ascorbate peroxidase, APX)、维生素E (vitamin E)、类胡萝卜素(carotenoids, Cars)[如玉米黄质(zeaxanthin)、花药黄质(neoxantin)以及叶黄素(lutein)]等(图 1)。PSI电子传递组分将来自PSⅡ的电子传递给O2,产生O2•−,SOD歧化O2•−生成O2和H2O2;另一种ROS清除酶,抗坏血酸过氧化物酶(APX),利用抗坏血酸(ASC)将H2O2还原为H2O(图 1)[62-63]。从ROS转移到Cars的激发能量导致三线态氧3O2和三线态激发态类胡萝卜素3Car*的形成,3Car*衰变为基态,同时激发能被转化为热量。此外,定位在叶绿体被膜、类囊体膜等膜上的α-生育酚(维生素E)可以通过提供一个电子给单线态氧1O2,形成电荷转移激发复合体,最终形成游离的α-生育酚醌和分子氧,使1O2失去破坏性[64-65]。
1.4 PSⅡ损伤修复在面对光破坏时,PSⅡ会经历损坏、修复和再组装过程(图 1)。其主要步骤包括:基粒中PSⅡ-LHCⅡ超复合物和PSⅡ核心二聚体的高光诱导磷酸化、破坏和分解;PSⅡ核心单体向基质(stroma)暴露的类囊体膜侧向迁移;去磷酸化,PSⅡ核心单体部分分解,以及光损伤蛋白降解;新D1蛋白的合成和重新组装;核心天线复合物CP43的重新结合;放氧复合体(OEC)的重新连接;PSⅡ核心单体迁移回基粒,以及二聚化为PSⅡ核心二聚体和PSⅡ-LHCⅡ超复合物的重整[63, 66]。PSⅡ修复周期最核心的机制是D1蛋白的快速降解和替换[67],它是PSⅡ光破坏防御的主要途径之一,而光抑制和PSⅡ活性的净损失只有在过度光照条件下降解速度快于修复速度时才会发生[68-71]。
在PSⅡ的损伤、修复和再组装过程中需要一系列蛋白质因子的协助,其中PSⅡ核心蛋白尤其是D1的磷酸化主要由状态转换激酶8 (STN8)催化[67, 72],而LHCⅡ的磷酸化主要由状态转换激酶7 (STN7)催化[72-73]。STN7不仅参与植物对光的短期响应(例如状态转换),还参与植物对光的长期适应[74]。STN7能磷酸化LHCⅡ蛋白,也能磷酸化PSⅡ核心天线CP43蛋白,并且CP43蛋白磷酸化程度在有限光下最小,在过量光下最大[75]。
此外,PSⅡ的光抑制不仅可以在高光强下发生,还可以在植物处于其他环境胁迫下时发生,如低CO2浓度、低温、高温、干旱和高盐度,这些都会导致D1从头合成不足,无法修复PSⅡ[76-77]。因此,D1蛋白的快速周转被认为是PSⅡ修复过程的核心,也是PSⅡ抵御光破坏的最后一道防线[17]。
2 与高光抗性相关的合成生物学研究光合作用合成生物学的实质是利用光合作用的基本原理,整合多学科理论、技术方法,通过理论设计、工程改造及人工进化等手段,创建新型光合系统,为社会创制更好的粮食[78-80]、能源[81-82]、健康[83-84]、生态系统[85-86]服务功能供给方式,并为光合作用研究提供新材料及资源,提高人类认识光合作用、利用光合作用的能力。植物合成生物学在“设计阶段”的关键之一是选择合适的宿主生物,即“底盘植物(plant chassis)”[87],目前已经开发的底盘植物种类包括:烟草、水稻、番茄、拟南芥等。随着植物基因组改造的合成生物学技术的快速发展,已实现使用CRISPR (clustered regularly interspaced short palindromic repeats)系统的基因编辑技术对拟南芥、小麦、水稻等植物的精准高效基因编辑;基于金门克隆(Golden Gate cloning)的模块化克隆体系,可以将多个DNA片段按指定顺序和方向拼接,同时将植物研究中常用的启动子、终止子、非翻译区域(untranslated regions, UTR)元件标准化[88]。近年来,随着人们对合成生物学的关注度提升、资助力度加大,促进光合作用合成生物学取得了一系列重要进展,通过降低捕光天线的大小、减少叶绿体中色素的含量,优化NPQ的诱导和弛豫速度,增强光破坏防御、减轻光抑制等方法,可以直接或间接地提高光合作用的高光抗性。
2.1 利用合成生物学降低捕光天线的大小、减少色素含量光能捕获是光反应的前提,是决定光合作用效率的重要因素。当植物通过捕光天线吸收的光能超过自身的利用能力时,过剩的光能需要以热和叶绿素荧光的形式重新散发出去,否则会造成光合机构的破坏[89]。Glick等[90]发现,通常植物PSⅡ、PSI分别含157个、204个叶绿素分子,当PSⅡ和PSI中叶绿素分子分别减少到37个、95个时,光合电子传递仍能正常进行。这意味着自然界中捕光复合体中叶绿素分子存在功能冗余。因此,利用合成生物学降低捕光天线的大小、减少叶绿体中色素的含量可以提高光合作用的高光抗性。
在利用合成生物学策略降低捕光天线的大小方面,Ort团队提出与高等植物相比,藻类和蓝细菌拥有较小的光系统和较少的捕光色素含量,但其吸收的光能转化为生物质的比例更大[91]。因此,可以通过减少叶片色素含量使更多的光穿过植物群体的顶层叶片,增加下部叶片的光合作用效率,从而提高生物量;此外,减少色素含量的光合器官对强光不敏感,也可以减少光抑制现象带来的光合效率下降的问题。因此,通过降低捕光天线的大小或减少叶绿体中色素的含量可能会避免过量光吸收,缓解光胁迫,增加光合作用的光能吸收和转化效率[80, 92-93]。Tomoaki团队发现在蓝细菌和衣藻中通过降低捕光色素的含量可以提高其生物量,并发现通过减少捕光色素的含量来提高生物量并不局限于某种菌株,而是适用于各种各样的光合生物。因此,利用合成生物学设计基因调控路线控制叶绿素在植物体不同叶片中的生物合成、降低顶层叶片色素含量、优化捕光天线可能是提高植物光合效率的有效手段[94]。
微藻在对环境适应的漫长进程中演化出的多样的遗传机制和复杂的表型可塑性,能够最大程度地利用太阳能并防止过剩光能造成光损伤。在高度变化的海洋环境中,真核藻类的光捕获复合物(LHC)演化出结构和功能的多样性,从而实现在各种光照条件下的光捕获与光破坏防御的平衡[95]。Niyogi团队及其合作者以海洋微拟球藻(Nannochloropsis oceanica)为模式,通过定向进化、蛋白质组等分离并表征了一株名为hlr1的LHCR突变体。HLR1是一种捕光天线蛋白,在hlr1突变体中PSI-LHC超复合物发生改变,PSI天线尺度减小,说明HLR1蛋白的缺失减弱PSI的光捕获能力,并提高了对强光的耐受力;同时,该蛋白具有广泛的进化分布和相对保守的功能,在光破坏防御与光利用之间的动态平衡过程中起到关键作用,为开发调控这种平衡的合成生物学方法提供了理论支撑 [96]。
2.2 利用合成生物学优化NPQ的诱导和弛豫速度植物捕获的光能一部分用于转变为化学能,另一部分通过热和叶绿素荧光的形式被耗散掉,NPQ是热耗散的主要形式。研究表明,通过NPQ而耗散的能量占植物固碳能量的7.5%~30%[97],自然界中植物所接受的光强是在不断变化中的,当叶片因被云或其他叶片遮挡而暂时处于弱光环境时,虽然光能捕获量已经减少,但NPQ在从强光转入弱光后的一段时间内仍然处于高速运转状态,从而造成吸收能量的过度耗散,因此NPQ虽然是植物光破坏防御不可缺少的,但也造成了能量的浪费[89]。所以,通过优化NPQ的诱导和弛豫速度,加快光破坏防御机制的响应,可以提高光合作用的高光抗性。
在利用合成生物学实现光能高效利用方面,德国科学家Leister提出基因工程的潜力并不局限于修饰或替换捕光天线,而是可以利用合成生物学策略重新设计对光敏感的复合物亚基,或者打造一个没有组装过程的单亚基蛋白体并装配上人工合成的新型色素,使之具有永久的光能捕获和转化能力。此外,为了满足不同生物和栖息地的需要,必须设计和组合几个版本的光系统和捕光天线,这些新的光系统不仅可以用于产生ATP和NADPH,而且还可以利用新的方法将电荷分离转化为化学能[98]。
能量依赖型猝灭(qE)是高光条件下最主要和最快速响应的NPQ组分。在高光条件下,植物通过激活紫黄质脱环氧化物酶(VDE)并通过叶黄素循环(VAZ)催化紫黄素转化为花药黄素、玉米黄素,从而启动qE;相比之下,在遮阴条件下,玉米黄质环氧酶(ZEP)将玉米黄质转化回紫黄质的逆反应过程却十分缓慢;此外,PSⅡ亚基S (PsbS)也可以通过构象改变影响qE过程。因此,VDE、PsbS和ZEP (统称为VPZ)被认为是影响NPQ的弛豫速度进而影响作物光合效率的关键。Stephen P. Long团队通过在烟草中上调VPZ的表达,促进了叶黄素类循环(VAZ)中紫黄质和玉米黄质的转换,导致NPQ的诱导和弛豫更快,从而增加了波动光照条件下的碳同化以及PSⅡ的电子传递速率;在田间实验中,转基因株系的地上部分生物量比野生型增加14%~21%,提高了光合作用效率和生物质产量[99]。为了测试这种基因工程改造是否能够在农作物中实现增产,他们又构建了大豆VPZ转基因株系。研究表明,VPZ的过表达加速了NPQ的逆转过程,当植株感受到从光到暗的转变时,光破坏防御机制会更快地关闭,导致在波动光下的光合效率大幅度提高;通过两年的大田实验该团队发现,VPZ过表达显著提高了大豆种子产量(最高可增加33%);此外,大豆种子内的蛋白质含量和含油量并未发生变化,这说明大豆产量的增加是通过VPZ途径而不是通过施加氮肥[100]。
2.3 利用合成生物学方法增强PSⅡ的修复效率叶绿体是进行光合作用的场所,高光强或高温胁迫通常会抑制光合作用,进而导致作物严重减产。因此,全球气候的变化对世界粮食安全造成严重威胁[4, 80, 101-105]。利用合成生物学改善植物光系统光破坏防御机制,增强PSⅡ的修复效率等,可以提高光合作用的高光抗性。
如何提高强光条件下或高温胁迫下PSⅡ的修复效率,进而增强植物的光合效率、生物量和产量,是长期困扰这一领域科学家的难题。郭房庆课题组将热激转录因子HsfA2的启动子作为热诱导开关启动psbA基因的表达,并在psbA编码区的N-端加入了叶绿体定位信号序列;融合基因在细胞核中表达,翻译后在叶绿体定位信号肽的引导下使表达产物D1蛋白进入叶绿体并定位于类囊体膜上,结果显著提高了拟南芥、水稻、烟草的耐热能力,促进了光系统Ⅱ修复和植物生长,提高了生物质积累和作物产量,相关转基因水稻的大田产量提高20%[106]。
光合作用研究在理论认知和工程化改造的水平上取得了根本性突破,利用合成生物学手段优化光合作用正从概念验证进入到生产实践阶段。
3 未来提高光合作用高光抗性的合成生物学研究方向光破坏防御是植物在光强逆境下采取的一系列策略,旨在减少光能的损害,并保护光合器官的完整性。光合作用合成生物学的发展为研究和应用光破坏防御策略,提高光合作用高光抗性提供了新的机会。
3.1 现有光合途径光破坏防御通路的合成生物学遗传改造及优化光合作用是植物生长和生物量生产的主要动力。光合作用合成生物学近期目标是利用自然界已有光合作用系统,挖掘当前系统得以改造及优化的位点,进而通过合成生物学手段,改造、优化现存光合系统,提高其光能利用效率[107]。因此,可以利用基因编辑、重组、整合技术,优化并改造光合膜复合物功能维持与修复关键基因及其光破坏防御通路模块,如编辑叶绿体相关基因以增强其光能转换效率、调节抗氧化酶基因以增强植物对光胁迫的抵抗能力等。此外,光破坏防御与光信号传导密切相关,可以通过合成生物学调控光信号通路中的关键基因来改善植物对光逆境的响应。
3.2 光合途径高光抗性的跨物种重建蓝细菌(Cyanobacteria)是最古老的放氧光合原核生物,在水生和陆地生态系统中都有分布。由于所处的生长环境不同,与高等植物相比,一些细菌在演化过程中形成了一些独特、有效的光破坏防御机制。伪枝藻素(Scytonemin)是一种黄褐色脂溶性的生物碱色素小分子,存在于一些蓝细菌的胞外鞘中,常作为一种十分有效的保护性物质抵御短波长的太阳紫外线(UV)辐射,大大减少蓝细菌体内ROS的产生及其对DNA的损伤[108-109]。从沙漠土壤结皮中分离出的绿藻小球藻在极强光下也可以正常生长,具有显著的抗光损伤性[110-111]。因此,可以将具有显著高光抗性的光合作用系统在作物中有效重建,增强作物高光抗性,并提高作物光能、水分及氮素利用效率,增强抵御非生物胁迫的能力,进而提高农作物产量。
3.3 创建全新的光破坏防御通路模块基于光合系统运行及光破坏防御的分子机制,开展全新的植物光破坏防御系统的构建。例如,设计新的具有抗高光逆境与光氧化能力的基因线路;合成新型抗光氧化的代谢物;设计高光响应智能化元件并与光破坏防御模块进行组装;建立全新的光合代谢合成通路;在植物体内合成新的光破坏防御物质,如抗氧化剂、UV吸收剂等。
4 展望随着全球气候变化、极端天气的频繁出现,发展新的科学技术用于保障世界粮食安全已刻不容缓,在不远的将来必须利用更少的土地生产更多的粮食才能维持人类社会的可持续发展[112]。植物合成生物学研究将在未来提高农作物产量、增强作物营养品质等方面发挥重要作用。其中,提高光合作用效率、创制作物抗逆新种质是未来农业增产的重要环节。
合成生物学在提高植物光合作用高光抗性方面已经取得了一些进展,但仍面临许多挑战。目前,对光合作用高光抗性的改造途径大都涉及多个基因的操作,但光合作用是一个异常复杂的生物学过程,其各个反应相互调节、相互制约,多个基因的导入可能造成难以预测的影响。因此,进一步解析基因功能和代谢网络、多组学关联分析、探索多种策略和方法组合,可为光合作用高光抗性合成生物学的基因线路改造、光合功能优化提供理论支持。
| [1] |
Vinyard DJ, Ananyev GM, Dismukes GC. Photosystem Ⅱ: the reaction center of oxygenic photosynthesis. Annu Rev Biochem, 2013, 82: 577-606. DOI:10.1146/annurev-biochem-070511-100425 |
| [2] |
Jing Y, Lin R. Transcriptional regulatory network of the light signaling pathways. New Phytol, 2020, 227: 683-97. DOI:10.1111/nph.16602 |
| [3] |
Fiorucci AS, Fankhauser C. Plant strategies for enhancing access to sunlight. Curr Biol, 2017, 27: R931-40. DOI:10.1016/j.cub.2017.05.085 |
| [4] |
Nishiyama Y, Allakhverdiev SI, Murata N. Protein synthesis is the primary target of reactive oxygen species in the photoinhibition of photosystem Ⅱ. Physiol Plant, 2011, 142: 35-46. DOI:10.1111/j.1399-3054.2011.01457.x |
| [5] |
Takahashi S, Badger MR. Photoprotection in plants: a new light on photosystem Ⅱ damage. Trends Plant Sci, 2011, 16: 53-60. DOI:10.1016/j.tplants.2010.10.001 |
| [6] |
Anderson CM, Mattoon EM, Zhang N, et al. High light and temperature reduce photosynthetic efficiency through different mechanisms in the C4 model Setaria viridis. Commun Biol, 2021, 4: 1092. DOI:10.1038/s42003-021-02576-2 |
| [7] |
张春霆. 合成生物学: 我国急需发展的前沿科学. 前沿科学, 2007, 1: 55. DOI:10.3969/j.issn.1673-8128.2007.03.009 |
| [8] |
Drubin DA, Way JC, Silver PA. Designing biological systems. Genes Dev, 2007, 21: 242-54. DOI:10.1101/gad.1507207 |
| [9] |
熊燕, 陈大明, 杨琛, 等. 合成生物学发展现状与前景. 生命科学, 2011, 23: 826-37. |
| [10] |
Zhao Y, Coelho C, Hughes AL, et al. Debugging and consolidating multiple synthetic chromosomes reveals combinatorial genetic interactions. Cell, 2023, 186: 5220-36. DOI:10.1016/j.cell.2023.09.025 |
| [11] |
Schindler D, Walker R, Jiang S, et al. Design, construction, and functional characterization of a tRNA neochromosome in yeast. Cell, 2023, 186: 5237-53. DOI:10.1016/j.cell.2023.10.015 |
| [12] |
Zhang W, Lazar-Stefanita L, Yamashita H, et al. Manipulating the 3D organization of the largest synthetic yeast chromosome. Mol Cell, 2023, 83: 4424-37. DOI:10.1016/j.molcel.2023.10.015 |
| [13] |
Hanania U, Ariel T, Tekoah Y, et al. Establishment of a tobacco BY2 cell line devoid of plant-specific xylose and fucose as a platform for the production of biotherapeutic proteins. Plant Biotechnol J, 2017, 15: 1120-9. DOI:10.1111/pbi.12702 |
| [14] |
Čermák T, Curtin SJ, Gil-Humanes J, 等. A multipurpose toolkit to enable advanced genome engineering in plants. Plant Cell, 2017, 29: 1196-217. |
| [15] |
程建峰, 沈允钢. 试析光合作用的研究动向. 植物学报, 2011, 46: 694-704. |
| [16] |
Leister D. Enhancing the light reactions of photosynthesis: Strategies, controversies, and perspectives. Mol Plant, 2023, 16: 4-22. DOI:10.1016/j.molp.2022.08.005 |
| [17] |
董潇潇, 靳红磊, 王宏斌. 植物光系统高光适应机制研究进展. 植物生理学报, 2016, 52: 1725-32. |
| [18] |
Eberhard S, Finazzi G, Wollman FA. The dynamics of photosynthesis. Annu Rev Genet, 2008, 42: 463-515. DOI:10.1146/annurev.genet.42.110807.091452 |
| [19] |
Roach T, Krieger-Liszkay A. Regulation of photosynthetic electron transport and photoinhibition. Curr Protein Pept Sci, 2014, 15: 351-62. DOI:10.2174/1389203715666140327105143 |
| [20] |
Liu J, Lu Y, et al. A new light on photosystem Ⅱ maintenance in oxygenic photosynthesis. Front Plant Sci, 2019, 10: 975. DOI:10.3389/fpls.2019.00975 |
| [21] |
Baker NR. Chlorophyll fluorescence: a probe of photosynthesis in vivo. Annu Rev Plant Biol, 2008, 59: 89-113. DOI:10.1146/annurev.arplant.59.032607.092759 |
| [22] |
Bru P, Nanda S, Malnoë A. A genetic screen to identify new molecular players involved in photoprotection qH in Arabidopsis thaliana. Plants (Basel), 2020, 9: 1565. |
| [23] |
Malnoë A. Photoinhibition or photoprotection of photosynthesis? Update on the (newly termed) sustained quenching component qH. Environ Exp Bot, 2018, 154: 123-33. DOI:10.1016/j.envexpbot.2018.05.005 |
| [24] |
Malnoë A, Schultink A, Shahrasbi S, et al. The plastid lipocalin LCNP is required for sustained photoprotective energy dissipation in Arabidopsis. Plant Cell, 2018, 30: 196-208. DOI:10.1105/tpc.17.00536 |
| [25] |
Yu G, Hao J, Pan X, et al. Structure of Arabidopsis SOQ1 lumenal region unveils C-terminal domain essential for negative regulation of photoprotective qH. Nat Plants, 2022, 8: 840-55. DOI:10.1038/s41477-022-01177-z |
| [26] |
Foyer CH. Reactive oxygen species, oxidative signaling and the regulation of photosynthesis. Environ Exp Bot, 2018, 154: 134-42. DOI:10.1016/j.envexpbot.2018.05.003 |
| [27] |
Hodges M, Dellero Y, et al. Perspectives for a better understanding of the metabolic integration of photorespiration within a complex plant primary metabolism network. J Exp Bot, 2016, 67: 3015-26. DOI:10.1093/jxb/erw145 |
| [28] |
Dietz K. Efficient high light acclimation involves rapid processes at multiple mechanistic levels. J Exp Bot, 2015, 66: 2401-14. DOI:10.1093/jxb/eru505 |
| [29] |
Abe S, Ebihara T, Furuno K, et al. Precision measurement of neutrino oscillation parameters with KamLAND. Phys Rev Lett, 2008, 100: 221803. DOI:10.1103/PhysRevLett.100.221803 |
| [30] |
Marulanda Valencia W, Pandit A. Photosystem Ⅱ subunit S (PsbS): a nano regulator of plant photosynthesis. J Mol Biol, 2023, 16: 168407. |
| [31] |
Horton P, Johnson MP, Perez-Bueno ML, et al. Photosynthetic acclimation: does the dynamic structure and macro-organisation of photosystem Ⅱ in higher plant grana membranes regulate light harvesting states?. FEBS J, 2008, 275: 1069-79. DOI:10.1111/j.1742-4658.2008.06263.x |
| [32] |
Li XP, Gilmore AM, Caffarri S, et al. Regulation of photosynthetic light harvesting involves intrathylakoid lumen pH sensing by the PsbS protein. J Biol Chem, 2004, 279: 22866-74. DOI:10.1074/jbc.M402461200 |
| [33] |
Bratt CE, Arvidsson PO, Carlsson M, et al. Regulation of violaxanthin de-epoxidase activity by pH and ascorbate concentration. Photosynth Res, 1995, 45: 169-75. DOI:10.1007/BF00032588 |
| [34] |
Hall M, Mata-Cabana A, Akerlund HE, et al. Thioredoxin targets of the plant chloroplast lumen and their implications for plastid function. Proteomics, 2010, 10: 987-1001. DOI:10.1002/pmic.200900654 |
| [35] |
Simionato D, Basso S, Zaffagnini M, et al. Protein redox regulation in the thylakoid lumen: the importance of disulfide bonds for violaxanthin de-epoxidase. FEBS Lett, 2015, 589: 919-23. DOI:10.1016/j.febslet.2015.02.033 |
| [36] |
Peers G, Truong TB, Ostendorf E, et al. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis. Nature, 2009, 462: 518-21. DOI:10.1038/nature08587 |
| [37] |
Tokutsu R, Minagawa J. Energy-dissipative supercomplex of photosystem Ⅱ associated with LHCSR3 in Chlamydomonas reinhardtii. Proc Natl Acad Sci U S A, 2013, 110: 10016-21. DOI:10.1073/pnas.1222606110 |
| [38] |
Rochaix JD. Regulation and dynamics of the light-harvesting system. Annu Rev Plant Biol, 2014, 65: 287-309. DOI:10.1146/annurev-arplant-050213-040226 |
| [39] |
许大全, 陈根云. 植物光合作用中的捕光调节. 植物生理学报, 2016, 52: 1649-62. |
| [40] |
Navakoudis E, Stergiannakos T, Daskalakis V. A perspective on the major light-harvesting complex dynamics under the effect of pH, salts, and the photoprotective PsbS protein. Photosynth Res, 2023, 156: 163-77. DOI:10.1007/s11120-022-00935-6 |
| [41] |
Niyogi KK, Li XP, Rosenberg V, et al. Is PsbS the site of non-photochemical quenching in photosynthesis?. J Exp Bot, 2005, 56: 375-82. |
| [42] |
Niyogi KK, Shih C, Soon Chow W, et al. Photoprotection in a zeaxanthin- and lutein-deficient double mutant of Arabidopsis. Photosynth Res, 2001, 67: 139-45. DOI:10.1023/A:1010661102365 |
| [43] |
Li XP, Müller-Moulé P, Gilmore AM, et al. PsbS-dependent enhancement of feedback de-excitation protects photosystem Ⅱ from photoinhibition. Proc Natl Acad Sci U S A, 2002, 99: 15222-7. DOI:10.1073/pnas.232447699 |
| [44] |
Roach T, Krieger-Liszkay A. The role of the PsbS protein in the protection of photosystems Ⅰ and Ⅱ against high light in Arabidopsis thaliana. Biochim Biophys Acta, 2012, 1817: 2158-65. DOI:10.1016/j.bbabio.2012.09.011 |
| [45] |
Naranjo B, Mignee C, Krieger-Liszkay A, et al. The chloroplast NADPH thioredoxin reductase C, NTRC, controls non-photochemical quenching of light energy and photosynthetic electron transport in Arabidopsis. Plant Cell Environ, 2016, 39: 804-22. DOI:10.1111/pce.12652 |
| [46] |
Bringmann A, Pannicke T, Grosche J, et al. Müller cells in the healthy and diseased retina. Prog Retin Eye Res, 2006, 25: 397-424. DOI:10.1016/j.preteyeres.2006.05.003 |
| [47] |
刘玉凤, 鹿嘉智, 孟思达, 等. PGR5/PGRL介导的环式电子传递研究进展. 植物生理学报, 2019, 55: 433-43. |
| [48] |
Govindjee. Chlorophyll a fluorescence: a bit of basics and history[M]//Papageorglou G, Govindjee. Chlorophyll a fluorescence: a signature of photosynthesis. Springer, 2004: 1-42
|
| [49] |
Chow WS, Hope AB. Electron fluxes through photosystem Ⅰ in cucumber leaf discs probed by far-red light. Photosynth Res, 2004, 81: 77-89. DOI:10.1023/B:PRES.0000028396.83954.36 |
| [50] |
Munekage Y, Hashimoto M, Miyake C, et al. Cyclic electron flow around photosystem Ⅰ is essential for photosynthesis. Nature, 2004, 429: 579-82. DOI:10.1038/nature02598 |
| [51] |
Okegawa Y, Kagawa Y, Kobayashi Y, et al. Characterization of factors affecting the activity of photosystem Ⅰ cyclic electron transport in chloroplasts. Plant Cell Physiol, 2008, 49: 825-34. DOI:10.1093/pcp/pcn055 |
| [52] |
Wang C, Yamamoto H, Shikanai T. Role of cyclic electron transport around photosystem Ⅰ in regulating proton motive force. Biochim Biophys Acta, 2015, 1847: 931-8. DOI:10.1016/j.bbabio.2014.11.013 |
| [53] |
Huang W, Yang YJ, Hu H, et al. Different roles of cyclic electron flow around photosystem Ⅰ under sub-saturating and saturating light intensities in tobacco leaves. Front Plant Sci, 2015, 6: 923. |
| [54] |
Avenson TJ, Cruz JA, Kanazawa A, et al. Regulating the proton budget of higher plant photosynthesis. Proc Natl Acad Sci U S A, 2005, 102: 9709-13. DOI:10.1073/pnas.0503952102 |
| [55] |
Walker BJ, Strand DD, Kramer DM, et al. The response of cyclic electron flow around photosystem Ⅰ to changes in photorespiration and nitrate assimilation. Plant Physiol, 2014, 165: 453-62. DOI:10.1104/pp.114.238238 |
| [56] |
Takahashi S, Milward SE, Fan DY, et al. How does cyclic electron flow alleviate photoinhibition in Arabidopsis?. Plant Physiol, 2009, 149: 1560-7. DOI:10.1104/pp.108.134122 |
| [57] |
Tikkanen M, Mekala NR, Aro EM. Photosystem Ⅱ photoinhibition-repair cycle protects photosystem Ⅰ from irreversible damage. Biochim Biophys Acta, 2014, 1837: 210-5. DOI:10.1016/j.bbabio.2013.10.001 |
| [58] |
Nishiyama Y, Allakhverdiev SI, Murata N. A new paradigm for the action of reactive oxygen species in the photoinhibition of photosystem Ⅱ. Biochim Biophys Acta, 2006, 1757: 742-9. DOI:10.1016/j.bbabio.2006.05.013 |
| [59] |
Nelson N, Ben-Shem A. The complex architecture of oxygenic photosynthesis. Nat Rev Mol Cell Biol, 2004, 5: 971-82. |
| [60] |
Pospisil P. Production of reactive oxygen species by photosystem Ⅱ as a response to light and temperature stress. Front Plant Sci, 2016, 7: 1950. |
| [61] |
Bassi R, Dall'Osto L. Dissipation of light energy absorbed in excess: the molecular mechanisms. Annu Rev Plant Biol, 2021, 72: 47-76. DOI:10.1146/annurev-arplant-071720-015522 |
| [62] |
Lu Y. Identification and roles of photosystem Ⅱ assembly, stability, and repair factors in Arabidopsis. Front Plant Sci, 2016, 7: 168. |
| [63] |
Nixon PJ, Michoux F, Yu J, et al. Recent advances in understanding the assembly and repair of photosystem Ⅱ. Ann Bot, 2010, 106: 1-16. DOI:10.1093/aob/mcq059 |
| [64] |
Havaux M, Eymery F, Porfirova S, et al. Vitamin E protects against photoinhibition and photooxidative stress in Arabidopsis thaliana. Plant Cell, 2005, 17: 3451-69. DOI:10.1105/tpc.105.037036 |
| [65] |
García-Cerdán JG, Schmid EM, Takeuchi T, et al. Chloroplast Sec14-like 1 (CPSFL1) is essential for normal chloroplast development and affects carotenoid accumulation in Chlamydomonas. Proc Natl Acad Sci U S A, 2020, 117: 12452-63. DOI:10.1073/pnas.1916948117 |
| [66] |
Johnson VM, Pakrasi HB. Advances in the understanding of the lifecycle of photosystem Ⅱ. Microorganisms, 2022, 10: 836. DOI:10.3390/microorganisms10050836 |
| [67] |
Pesaresi P, Pribil M, Wunder T, et al. Dynamics of reversible protein phosphorylation in thylakoids of flowering plants: the roles of STN7, STN8 and TAP38. Biochim Biophys Acta, 2011, 1807: 887-96. DOI:10.1016/j.bbabio.2010.08.002 |
| [68] |
Aro EM, Virgin I, Andersson B. Photoinhibition of photosystem Ⅱ inactivation, protein damage and turnover. Biochim Biophys Acta, 1993, 1143: 113-34. DOI:10.1016/0005-2728(93)90134-2 |
| [69] |
Long SP, Humphries S, Falkowski PG. Photoinhibition of photosynthesis in nature. Annu Rev Plant Biol, 1994, 45: 633-62. DOI:10.1146/annurev.pp.45.060194.003221 |
| [70] |
Murata N, Takahashi S, Nishiyama Y, et al. Photoinhibition of photosystem Ⅱ under environmental stress. Biochim Biophys Acta, 2007, 1767: 414-21. DOI:10.1016/j.bbabio.2006.11.019 |
| [71] |
Niyogi KK. Photoprotection revisited: genetic and molecular approaches. Ann Rev Plant Physiol Plant Mol Biol, 1999, 50: 333-9. DOI:10.1146/annurev.arplant.50.1.333 |
| [72] |
Gerotto C, Trotta A, Bajwa AA, et al. Thylakoid protein phosphorylation dynamics in a moss mutant lacking SERINE/THREONINE PROTEIN KINASE STN8. Plant Physiol, 2019, 180: 1582-97. DOI:10.1104/pp.19.00117 |
| [73] |
Bellafiore S, Barneche F, Peltier G, et al. State transitions and light adaptation require chloroplast thylakoid protein kinase STN7. Nature, 2005, 433: 892-5. DOI:10.1038/nature03286 |
| [74] |
Pesaresi P, Hertle A, Pribl M, et al. Arabidopsis STN7 kinase provides a link between short- and long term photosynthetic acclimation. Plant Cell, 2009, 21: 2402-23. DOI:10.1105/tpc.108.064964 |
| [75] |
Tikkanen M, Grieco M, Kangasjarvi S, et al. Thylakoid protein phosphorylation in higher plant chloroplasts optimizes electron transfer under fluctuating light. Plant Physiol, 2010, 152: 723-35. DOI:10.1104/pp.109.150250 |
| [76] |
Allakhverdiev SI. Optimising photosynthesis for environmental fitness. Funct Plant Biol, 2020, 47: iii-vii. DOI:10.1071/FPv47n11_FO |
| [77] |
Allahverdiyeva Y, Aro EM. Photosynthetic responses of plants to excess light: mechanisms and conditions for photoinhibition, excess energy dissipation and repair[M]//Eaton-Rye JJ, Tripathy BC, Sharkey TD. Photosynthesis: plastid biology, energy conversion and carbon assimilation. Springer, 2012: 275-97
|
| [78] |
Maurino VG, Weber AP. Engineering photosynthesis in plants and synthetic microorganisms. J Exp Bot, 2012, 64: 743-51. |
| [79] |
Whitney SM, Houtz RL, Alonso H. Advancing our understanding and capacity to engineer nature's CO2-sequestering enzyme, Rubisco. Plant Physiol, 2010, 155: 27-35. |
| [80] |
Zhu XG, Long AP, Ort DR. Improving photosynthetic efficiency for greater yield. Annu Rev Plant Biol, 2010, 61: 235-61. DOI:10.1146/annurev-arplant-042809-112206 |
| [81] |
Steen EJ, Kang Y, Bokinsky G, et al. Microbial production of fatty-acid-derived fuels and chemicals from plant biomass. Nature, 2010, 463: 559-63. DOI:10.1038/nature08721 |
| [82] |
Dekishima Y, Lan EI, Shen CR, et al. Extending carbon chain length of 1-butanol pathway for 1-hexanol synthesis from glucose by engineered Escherichia coli. J Am Chem Soc, 2011, 133: 11399-401. DOI:10.1021/ja203814d |
| [83] |
Ajikumar PK, Xiao WH, Tyo KE, et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science, 2010, 330: 70-4. DOI:10.1126/science.1191652 |
| [84] |
Levskaya A, Chevalier AA, Tabor JJ, et al. Synthetic biology: engineering Escherichia coli to see light. Nature, 2005, 438: 441-2. DOI:10.1038/nature04405 |
| [85] |
Topp S, Gallivan JP. Riboswitches in unexpected places a synthetic riboswitch in a protein coding region. RNA, 2008, 14: 2498-503. DOI:10.1261/rna.1269008 |
| [86] |
Werlen C, Jaspers MC, van der Meer JR. Measurement of biologically available naphthalene in gas and aqueous phases by use of a Pseudomonas putida biosensor. Appl Environ Microbiol, 2004, 70: 43-51. DOI:10.1128/AEM.70.1.43-51.2004 |
| [87] |
Molina-Hidalgo FJ, Vazquez-Vilar M, D'Andrea L, et al. Engineering metabolism in Nicotiana species: a promising future. Trends Biotechnol, 2021, 39: 901-13. DOI:10.1016/j.tibtech.2020.11.012 |
| [88] |
Engler C, Youles M, Gruetzner R, et al. A golden gate modular cloning toolbox for plants. ACS Synth Biol, 2014, 3: 839-43. DOI:10.1021/sb4001504 |
| [89] |
张立新, 卢从明, 彭连伟, 等. 利用合成生物学原理提高光合作用效率的研究进展. 生物工程学报, 2017, 33: 486-93. |
| [90] |
Glick RE, Melis A. Minimum photosynthetic unit size in system Ⅰ and system Ⅱ of barley chloroplasts. Biochim Biophys Acta, 1988, 934: 151-5. DOI:10.1016/0005-2728(88)90130-2 |
| [91] |
Ort DR, Melis A. Optimizing antenna size to maximize photosynthetic efficiency. Plant Physiol, 2011, 155: 79-85. DOI:10.1104/pp.110.165886 |
| [92] |
Long SP, Marshall-Colon A, Zhu XG. Meeting the global food demand of the future by engineering crop photosynthesis and yield potential. Cell, 2015, 161: 56-66. DOI:10.1016/j.cell.2015.03.019 |
| [93] |
Ort DR, Merchant SS, Alric J, et al. Redesigning photosynthesis to sustainably meet global food and bioenergy demand. Proc Natl Acad Sci U S A, 2015, 112: 8529-36. DOI:10.1073/pnas.1424031112 |
| [94] |
Nakajima Y, Itayama T. Analysis of photosynthetic productivity of microalgal mass cultures. J Appl Physiol, 2003, 15: 497-505. |
| [95] |
Qin X, Pi X, Wang W, et al. Structure of a green algal photosystem Ⅰ in complex with a large number of light-harvesting complex Ⅰ subunits. Nat Plants, 2019, 5: 263-72. DOI:10.1038/s41477-019-0379-y |
| [96] |
Lu Y, Gan Q, Iwai M, et al. Role of an ancient light-harvesting protein of PSI in light absorption and photoprotection. Nat Commun, 2021, 12: 679. DOI:10.1038/s41467-021-20967-1 |
| [97] |
Zhu XG, Ort DR, Whitmarsh J, et al. The slow reversibility of photosystem Ⅱ thermal energy dissipation on transfer from high to low light may cause large losses in carbon gain by crop canopies: a theoretical analysis. J Exp Bot, 2004, 55: 1167-75. DOI:10.1093/jxb/erh141 |
| [98] |
Leister D. How can the light reactions of photosynthesis be improved in plants?. Front Plant Sci, 2012, 3: 199. |
| [99] |
Kromdijk J, Głowacka K, Leonelli L, et al. Improving photosynthesis and crop productivity by accelerating recovery from photoprotection. Science, 2016, 354: 857-61. DOI:10.1126/science.aai8878 |
| [100] |
Amanda P, De Souza, Doran L, et al. Soybean photosynthesis and crop yield are improved by accelerating recovery from photoprotection. Science, 2022, 377: 851-4. DOI:10.1126/science.adc9831 |
| [101] |
Allakhverdiev SI, Kreslavski VD, Klimov VV, et al. Heat stress: an overview of molecular responses in photosynthesis. Photosynth Res, 2008, 98: 541-50. DOI:10.1007/s11120-008-9331-0 |
| [102] |
Takahashi S, Murata N. How do environmental stresses accelerate photoinhibition?. Trends Plant Sci, 2008, 13: 178-82. DOI:10.1016/j.tplants.2008.01.005 |
| [103] |
Gururani MA, Venkatesh J, Tran LS. Regulation of photosynthesis during abiotic stress-induced photoinhibition. Mol Plant, 2015, 8: 1304-20. DOI:10.1016/j.molp.2015.05.005 |
| [104] |
Ainsworth EA, Ort DR. How do we improve crop production in a warming world?. Plant Physiol, 2010, 154: 526-30. DOI:10.1104/pp.110.161349 |
| [105] |
Long SP, Ort DR. More than taking the heat: crops and global change. Curr Opin Plant Biol, 2010, 13: 241-8. |
| [106] |
Chen JH, Chen ST, He NY, et al. Nuclear-encoded synthesis of the D1 subunit of photosystem Ⅱ increases photosynthetic efficiency and crop yield. Nat Plants, 2020, 6: 570-80. DOI:10.1038/s41477-020-0629-z |
| [107] |
朱新广, 熊燕, 阮梅花, 等. 光合作用合成生物学研究现状及未来发展策略. 中国科学院院刊, 2018, 33: 1239-48. |
| [108] |
Hankamer B, Barber J, Boekema EJ. Structure and membrane organization of photosystem Ⅱ in green plants. Annu Rev Plant Physiol Plant Mol Biol, 1997, 48: 641-71. DOI:10.1146/annurev.arplant.48.1.641 |
| [109] |
Michel H, Deisenhofer J. Relevance of the photosynthetic reaction center from purple bacteria to the structure of photosystem-Ⅱ. Biochemistry, 1988, 27: 1-7. DOI:10.1021/bi00401a001 |
| [110] |
Treves H, Raanan H, Kedem I, et al. The mechanisms whereby the green alga Chlorella ohadii, isolated from desert soil crust, exhibits unparalleled photodamage resistance. New Phytol, 2016, 210: 1229-43. DOI:10.1111/nph.13870 |
| [111] |
Levin G, Kulikovsky S, Liveanu V, et al. The desert green algae Chlorella ohadii thrives at excessively high light intensities by exceptionally enhancing the mechanisms that protect photosynthesis from photoinhibition. Plant J, 2021, 106: 1260-77. DOI:10.1111/tpj.15232 |
| [112] |
Tilman D, Balzer C, Hill J, et al. Global food demand and the sustainable intensification of agriculture. Proc Natl Acad Sci U S A, 2011, 108: 20260-4. DOI:10.1073/pnas.1116437108 |
 2024, Vol. 36
2024, Vol. 36 

 卢从明,博士,山东农业大学教授、博士生导师。中国科学院“百人计划”入选者,国家“杰出青年基金”项目获得者。1986与1989年获江苏农学院学士与硕士学位,1993年获中国科学院植物研究所博士学位。1994至1999年,在以色列本古里安大学、香港浸会大学以及英国伦敦大学从事博士后研究。2000年至2018年任中国科学院植物研究所研究员,2019年起任山东农业大学教授。主要从事光合作用功能调控分子机理及作物分子设计育种研究。近五年来,在Nature Plants、Molecular Plant等学术期刊发表多篇研究论文
卢从明,博士,山东农业大学教授、博士生导师。中国科学院“百人计划”入选者,国家“杰出青年基金”项目获得者。1986与1989年获江苏农学院学士与硕士学位,1993年获中国科学院植物研究所博士学位。1994至1999年,在以色列本古里安大学、香港浸会大学以及英国伦敦大学从事博士后研究。2000年至2018年任中国科学院植物研究所研究员,2019年起任山东农业大学教授。主要从事光合作用功能调控分子机理及作物分子设计育种研究。近五年来,在Nature Plants、Molecular Plant等学术期刊发表多篇研究论文