高等植物、藻类和蓝细菌的光合作用,利用太阳光能将无机物二氧化碳和水合成碳水化合物,为地球生物圈几乎所有生物提供赖以生存的食物、能量和氧气,是地球生命的发动机,生物圈形成、演化、运转及繁荣的关键。改善自然光合作用和发展人工光合作用,是解决人类目前乃至未来面临的食物、能源和环境(污染和变暖)三大迫切问题的必由之路。
光合作用的光反应过程始于反应中心叶绿素分子受光激发的电荷分离,继之以电子传递与同化力(ATP和NADPH)的形成,最后利用同化力经过一系列碳代谢反应(过去称为暗反应)形成蔗糖和淀粉等碳水化合物。引起反应中心电荷分离的光子,绝大部分是天线复合体捕获传递来的。因此,天线复合体的光捕获及其向反应中心的传递是光合作用系列反应快速进行的根本前提。
在漫长的生物演化过程中,不断变化的环境条件迫使光合生物形成一系列捕光调节机制,以便在弱光下增加光吸收,使光合作用趋向最大;在强光下减少光吸收和向反应中心的传递,减轻以至避免光合机构遭受过量光的破坏。关于捕光调节的研究报告和综述文章很多,例如Pascal等[1]、Belgio等[2]、Rochaix[3]、Xu等[4]、许大全和陈根云[5]。这些调节机制虽然有利于光合生物的生存,可是往往会降低其光合效率和作物产量,这显然不是人们所希望的结果。为了提高植物光合作用效率和生物质产量,人们采取包括合成生物学手段在内的种种方法改善捕光功能[6-8]。下面简要介绍这方面的研究进展(图 1)。
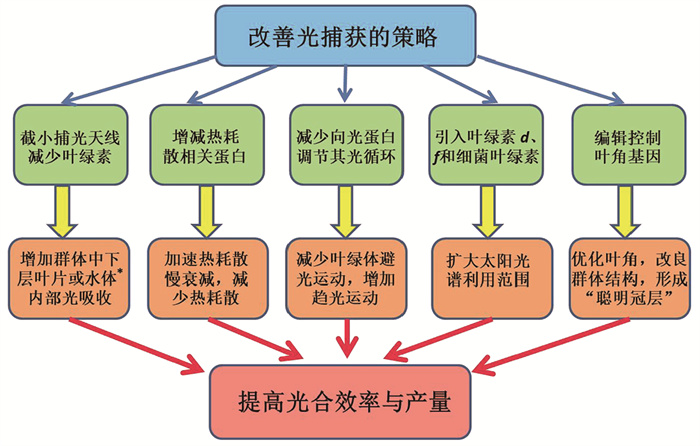
|
*指大量培养藻或蓝细菌的水体 图 1 改善光捕获的策略示意图 |
光合机构的捕光天线是结合叶绿素和类胡萝卜素等色素的蛋白复合体,为光合作用反应中心吸收光能,并高效传递激发能。这些复合体蛋白大多由细胞核基因组编码,通过特定的跨膜螺旋结构精准定位于类囊体膜上。在高等植物和绿藻中,光系统Ⅱ (PSⅡ)的捕光天线(LHCⅡ)更为复杂,它由核心天线(CP43和CP47)和外周天线共同组成,主要的外周天线三聚体由相对分子质量为24~29 kD的三个多肽Lhcb1、Lhcb2和Lhcb3组成,其通过次要的外周天线单体(CP29、CP26和CP24,即Lhcb4、Lhcb5和Lhcb6)以及核心天线CP43和CP47,与反应中心核心复合体(包括D1、D2,与CP43和CP47一样都由叶绿体基因组编码)相连接[9],从而实现从外周天线向反应中心叶绿素a分子的高效光能传递;光系统Ⅰ (PSI)的外周天线LHCI由相对分子质量为20~24 kD的多肽Lhca1~Lhca4组成,这4个多肽装配成2个二聚体,呈半月形地围绕在光系统Ⅰ核心单体的一侧。
捕光天线不仅能有效捕捉和传递光能,而且还可以巧妙调节和优化光能的吸收和传递。在红光照射下,植物部分LHCⅡ被磷酸化,并从PSⅡ转移到PSI (状态2),并与PSI结合[10],从而增加PSI的光吸收与激发。反之,远红光信号则触发磷酸化的LHCⅡ去磷酸化,回到光系统Ⅱ (状态1),类囊体膜的这种状态转换可以在10多分钟内完成,是对两个光系统光能分配不平衡的快速响应。面对短时(几分钟或几小时)强光照射时,植物会启动另一种对捕光的快速调节机制:一些主要的LHCⅡ三聚体可逆地脱离光系统Ⅱ核心复合体[11],由有效的捕光态转变为能量耗散(non-photochemical quenching, NPQ)态,将过多激发能转变成热能形式耗散,从而减少向反应中心的激发能传递,防止反应中心遭受过量激发能的破坏。但当植物较长时间(几天)生长在强光下时,其光系统Ⅱ核心复合体结合的LHCⅡ三聚体数目减少,即捕光天线变小[12],从而减少光能吸收和激发能向反应中心的传递,实现光合机构对光强变化的缓慢而稳定的适应。植物捕光天线通过这一系列机制以有效应对不断变化的外界光环境。
捕光天线的结构、功能及其调节因植物种类的不同而异。绿硫细菌是一种专性不放氧的光自养生物,其捕光天线附着在细胞膜的细胞质一侧的绿色体(chlorosome),含有许多细菌叶绿素a、叶绿素c、d、e等。蓝细菌和红藻光系统Ⅱ的外周天线不是LHCⅡ,而是藻胆体(phycobilisome, PBS)[13],由结合藻红素的藻红蛋白、结合藻蓝素的藻蓝蛋白和结合别藻蓝素的别藻蓝蛋白组成,其结构精妙地体现了天线类似漏斗作用的经典理念。是自然界最有效的天线系统。PBS含有几百个后胆色素分子,结合在PSⅡ二聚体上,在状态转换过程中可以在几秒钟内移动到PSI,在不利条件下它可以解聚或降解,减少传递到反应中心的激发能,避免光破坏。绿藻和苔藓有一种LHC类蛋白LHCSR (与逆境有关的捕光复合体),具有很强的热耗散能力,在胁迫条件下,它迅速积累并从附近的天线复合体接受能量并以热的形式耗散。原核生物蓝细菌和真核生物高等植物捕光天线NPQ的机制及其调节多有不同。这两类生物NPQ的分子过程类似,但其机制却完全不同,前者参与NPQ调节的是橘色类胡萝卜素蛋白(orange carotenoid protein, OCP)[14],而后者却是PsbS蛋白。
在大量培养的微藻悬浮细胞群中,由于上层或外层藻细胞光合作用的光饱和与光能的热耗散及藻细胞的相互遮阴,中下层或水体内部细胞吸收的光能明显少于上层或外层细胞,致使整个细胞群的光能利用率低下[15]。相关研究已经证明,光合细胞捕光色素减少是减轻这种与细胞群表层过度光吸收相联系的光能利用率降低的有效策略[16-17]。与此相一致,在大量培养的微藻细胞群中,具有截小的(truncated)捕光天线的微藻细胞群提高了太阳能向生物质转化的效率[18-19]。人们通过对绿藻的诱变和选择,分离出捕光天线截小的突变体,这些突变体都具有比野生型高的生产力[20-21]。通过部分地减少莱茵衣藻(Chlamydomonas reinhardtii)叶绿素b的含量及外周天线大小,导致强光下光合速率成倍提高和生长速率提高30%。这种转基因株系具有中等大小的外周天线,能够进行状态转换,加强循环电子传递的ATP合成,其强有力的玉米黄质-紫黄质(zeaxanthin-violaxanthin)循环可以防御强光破坏[22]。用RNAi技术降低绿藻即莱茵衣藻(C. reinhardtii)LHCB1、LHCB2和LHCB3的量,由于减少光能的热耗散损失,改善反应器内光分布,减少光抑制和提前激活产氢氢酶的表达以及减少氢酶的氧抑制,从而改善了光-氢转化效率[23]。细胞叶绿素含量降低一半的绿藻(Chlorella sorokiniana)突变体,在实验室和室外光生物反应器(photoreactor)内密集悬浮培养中表现出比其野生型高的最大光合速率(饱和光下,Asat)和光能利用效率,生物质产量提高30%[24]。
与悬浮微藻细胞群相类似,在叶面积系数比较高的作物群体中,由于上层叶片的遮挡,中下层叶片经常处于光能供应不足的情况下,导致整个群体的光合效率降低。对作物群体的冠层光合作用模拟结果表明,降低叶片的叶绿素含量有希望改善群体光合功能[25]。对捕光天线变小的转基因植物的分析测定结果大多与这个预测相一致。例如,捕光天线较小的转基因烟草在高种植密度下获得比较高的生物质产量[26];拟南芥(A.thaliana)和水稻叶绿素含量减少的突变株系都具有较高的光合效率和生物质产量:在失去高光效基因hpe1 (以前没有被鉴定)的拟南芥突变体中,其细胞核编码的与叶绿素有关基因的表达发生改变,总叶绿素含量(但提高了叶绿素a/b比)及捕光天线大小降低,从而改善了光捕获,减少能量损失,减轻了光破坏[27];而叶绿素含量减少的水稻突变体群体冠层内光能的垂直分布得到改善,叶片具有比野生型高的电子传递速率、Rubisco含量及气孔和叶肉对CO2的导度,因此表现比较高的净光合速率和光合氮使用效率[28]。
但是,并不是所有的叶绿素含量降低的突变体其生物质的生产都能够增加,例如,一个具有黄叶表型(叶绿素减少50%)的大豆突变体的生物质生产低于绿叶变种[29]。具有捕光天线轻度减小(Chl a/b大约5.0)的亚麻荠(Camelina sativa)突变体与其野生型(Chl a/b大约3.0)相比,其生物质产量增加。但是,进一步减小捕光天线则降低生产力和对光胁迫的耐受性。这些实验结果清楚地表明,只有适度地降低捕光天线大小,才可以获得提高光合效率和产量的效果。Friedland等[30]揭示了一个明显的转折点:从这一点进一步减小或增加天线的大小都降低光合效率。那些优化了天线大小的植物不仅在受控温室条件下,而且在田间都表现出良好的光合功能,其生物质产量增加了40%。
虽然通过选择性地降低叶绿素b和外周捕光复合体水平而缩小捕光天线的捕光截面已经显著地改善光合效率,然而在弱光和波动光下捕光天线较小的变种却不能表现优化的光合功能。Negi等[31]利用一个翻译控制系统获得能够随着光强变化动态调节捕光天线大小的藻变种。这种转基因藻在强光下,叶绿素a加氧酶的mRNA翻译被抑制,于是叶绿素b的合成减少,导致叶绿素a/b增高、捕光天线变小,结果藻培养物生产力提高;在弱光下则相反,叶绿素a加氧酶的mRNA翻译继续进行,叶绿素b的合成增加,导致叶绿素a/b降低、捕光天线变大,结果还是藻培养物生产力提高。这种灵活性使这种转基因藻无论光强如何变化,都能可观地提高光合速率和增加生物质生产力。
2 增加或减少与热耗散相关的蛋白植物在过量光下捕光调节的一个重要策略就是启动能量的热耗散机制,部分捕光天线色素-蛋白复合体(光系统Ⅱ的外周天线LHCⅡ的三聚体及单体)从有效的捕光态转变为无效的能量耗散态,将过量的光能变成热而无害地耗散掉,从而防止或减轻过量光能(通过具有破坏作用的活性氧的产生)对光合机构(特别是反应中心)的破坏。参与热耗散机制启动和调节的是叶黄素去环氧酶和叶黄素环氧酶及PsbS蛋白[4, 32]。关于NPQ,已经有专门的论文集[33]问世。
在晴朗无云的日子,田间植物的上层叶片中午前后(10:00~14:00)常常受到全日光强(许多地方例如上海的光合有效的光子通量密度大约为2 000 μmol·m-2·s-1) 的太阳光照射,叶片接收的光能大大超过光合作用所能利用的数量(大豆、水稻和小麦非环境胁迫条件下光合作用的饱和光强分别为全日光强的50%、60%和70%左右),往往发生光合作用的光抑制(photoinhibition),在伴随干旱或低温等其他环境胁迫时会发生光合机构的光破坏(photodamage)。这时热耗散等光破坏防御(photoprotection)机制会及时启动和加强。
这种热耗散机制虽然可以有效地防止或减轻过量光下光合机构的光破坏,但是却以降低光合效率和光合生产力为代价,特别是在从强光转变为有限光后热耗散过程的慢衰减会显著降低作物产量,理论分析表明产量潜力可以降低20% [34]。这违背人们栽培作物的初心,于是想方设法加速这种热耗散的慢衰减过程,即加速从能量耗散态回到有效的捕光态。Kromdijk等[35]通过过表达叶黄素去环氧酶和叶黄素环氧酶及PsbS蛋白,使转基因烟草在强光转变为有限光后比野生型更快地停止热耗散过程,结果在田间波动光下生产力增加15%。令人惊奇的是,过表达PsbS蛋白竟还可以提高田间生长作物的水使用效率[36]。
相反,减少与NPQ有关的蛋白,可以提高生物质生产力。例如,敲除蓝细菌负责活化NPQ的OCP (orange carotenoid protein,橘色类胡萝卜素蛋白),使大量培养的Synechocystis突变体比其野生型生物质增加30%[37]。与此相类似,一份初期的报告表明,与胁迫有关的捕光复合体蛋白(LhcSR)积累调节生物质产量,缺乏两个lhcSR3基因的绿藻(C. reinhardtii)突变体的生产力高于其野生型。然而,后来的研究报告表明,缺乏所有的LhcSR同等型的绿藻突变体的生物质产量与其野生型没有明显差别[38-39]。这些结果意味着,尽管通过减少NPQ来提高生物质的生产力是一个有希望的策略,但复杂的环境和生长条件也许会否定这种预期。
3 选择性减少向光蛋白或改变其光循环(photocycle)蓝光受体向光蛋白(phototropin, PHOT)是质膜上受蓝光活化的一个蛋白激酶。它含有C端的丝氨酸/苏氨酸激酶区域和N端的两个弱光-氧或电压传感区域(LOV1和LOV2)。这2个LOV区域结合生色团黄素单核苷酸(FMN),作为蓝光传感器,在调节PHOT活性上发挥不同的作用。PHOT介导多种优化植物光吸收的光响应,包括植物体的向光性、气孔开放、叶绿体运动和叶片的平展(flattening)等[40]。
叶绿体运动是植物优化光吸收的一个重要策略。在弱光下,叶绿体的积光(accumulating)运动使类似铁饼形的叶绿体扁平面朝向光,并且移动到靠近叶肉细胞上侧的细胞壁,从而使光吸收最大化;相反,在强光下,叶绿体的避光(avoiding)运动使它的扁平面与光线平行,并且靠近叶肉细胞的侧壁,相互遮阴,从而减少光吸收,避免或减轻光破坏。叶绿体的积光运动由PHOT1和PHOT2介导,而其避光运动则只由PHOT2介导。缺少PHOT1的水稻突变体phot1因叶绿体积光运动减少而导致生长速率降低[41]。相反,缺少PHOT2的拟南芥突变体phot2则由于不能再介导叶绿体避光运动而使叶片光合作用加强[42]。当然,这些突变体光合作用效率和生长及生物质产量的变化不仅是叶绿体运动变化的结果,也与相应的叶片定位(positioning)和扩展的变化有关。
因为触发叶绿体避光运动的光强阈值小于100 μmol·m-2·s-1,所以即使在植物群体中下层的叶片PHOT2也被活化[8, 43]。植物似乎为了防止光破坏而宁可降低生产力。换句话说,保障生存的“安全”比高生产力重要。为了提高作物的生产力,人们不得不想办法削弱这种过分的“安全”机制。拟南芥的phot2突变体在有限光下加强了叶片光合作用,并且增加了生物质生产,表明叶绿体的积光运动是高效光合作用所必需的[42]。然而,这种phot2突变体对强光是敏感的。因此,必须谨慎地应用这种抑制叶绿体避光运动的技术,否则,在强光下它会导致光破坏,抵消它增加生物质产量的好处[8]。
Hart等[44]通过定点突变(site-directed mutation)替换PHOT1和PHOT2的LOV区域的一些氨基酸,成功地调节了拟南芥变种向光蛋白的光循环,加速或减慢光受体的活化,在有限光下具有慢光循环的变种其生物质生产增加。
4 引入叶绿素d、叶绿素f和细菌叶绿素绝大部分放氧光合生物能够使用人眼可见(400~700 nm)的太阳辐射,即光合有效辐射(photosynthetically active radiation, PAR),而蓝细菌(Acaryochloris marina)和红藻含有的叶绿素d (它几乎能够代替放氧光合作用中叶绿素a的所有功能,包括捕光和反应中心的电荷分离)在体内的最大吸收峰大约在710 nm[45]。在一种尚未鉴定的蓝细菌中新发现的叶绿素f则把体内光合作用的吸收光谱扩展到750 nm[46]。这些发现表明,放氧光合作用可以利用的最大波长阈值至少可以扩展到740 nm,通过基因工程将叶绿素d和叶绿素f引入藻类和高等植物可以增加19%的光量子吸收(与PAR相比)[47]。
用代谢工程方法将脱植基叶绿素(chlorophyllide) a加氧酶(负责叶绿素b生物合成)的基因导入以叶绿素d为主的蓝细菌(Acaryochloris marina),结果转基因变种合成的不是叶绿素b,而是叶绿素[7-formyl]-Chl dp,这种新的叶绿素占总叶绿素含量的10%,推测是该加氧酶和参与Chl d合成的酶共同作用产生的,显示了叶绿素生物合成途径的灵活性[48]。
Nurnberg等[49]发现,生长在远红光(750 nm)环境中含有叶绿素f的蓝细菌的光化学反应能够超出光合作用的“红线”(680~700 nm),其两个光系统(PSI和PSⅡ)反应中心的电荷分离分别使用吸收峰在745 nm和727 nm的叶绿素f和d吸收的光能;每个光系统都有几个位居关键部位的叶绿素f分子吸收远红光,并将激发能上坡(uphill)传递给反应中心色素。放氧光合作用一直被认为只能由可见光推动,近几十年发现藻类、蓝细菌,甚至植物对远红光的不同的适应(adaptation):原核生物的适应包括产生吸收远红光的叶绿素f和d以及重建(remodeling)捕光色素-蛋白复合体藻胆体(phycobilisome)天线和反应中心;真核生物则表达专门的捕光色素-蛋白复合体,并通过色素分子之间和色素分子与周围蛋白质之间的相互作用调整叶绿素a的吸收光谱[50]。虽然蓝细菌(C. fritschii)催化叶绿素f合成的酶已经被鉴定,并且在Synechococus sp.中异源表达成功,积累了叶绿素f [51], 但是,即使这些新色素能够正确地结合在现有的色素支架(scaffold)上,这种方法在改善捕光能力上的可行性还有待实验证实。
高等植物、藻类和蓝细菌的放氧光合作用是在串联的两个光系统(光系统Ⅱ和光系统Ⅰ)的协作下进行的。两个光系统竞争使用400~700 nm这同一波段的光能,以致光能利用效率降低。因此,有人提出利用分子生物学技术将细菌叶绿素和叶绿素d引入放氧的光合生物去替代反应中心的叶绿素a分子,使光系统Ⅰ能够吸收、利用远红光(~1100 nm)[52]。如今十多年过去了,还没有见到关于这个大胆建议实践成功的研究报告。
5 编辑控制叶片着生角度的基因在高种植密度的植物群体中,由于上层叶片的遮挡,中下层叶片接收的太阳光能急剧减少,其光合作用经常处于光不足的限制之中。因此,理想的情况是群体上层叶片直挺,允许较多的光线通过,而下层叶比较水平有效地捕获透过的光[53]。为了改善群体冠层内的光环境,需要优化植株上不同叶片着生角度的分布[54]。只有优化叶片与茎秆之间的着生角度,即上层叶片趋向直立,而下层叶片趋向水平,从而使上层叶片减少光反射和光过量引起的光抑制,下层叶片增加光捕获,才能有效地提高群体的光合效率和生产力。关于叶角对光合效率与产量影响的研究始于20世纪60年代,人们一直尝试寻找和培育这种具有“聪明冠层”(smart canopy)的理想株型作物[55],迄今已经积累大量实验证据[54]。
许多叶片比较直立的玉米良种都是人们多年育种选择的结果[56-58]。在对大约1 000个具有不同叶片着生角度的春小麦品系的比较研究中,那些直立叶株型的群体比叶片趋于水平株型的群体的地上部生物质平均多11%,籽粒产量高13%[59]。
水稻控制叶角的基因已经被阐明,植物激素IAA的体内稳态和油菜素内酯(brassinosteroid)信号可能都参与叶角的遗传控制[60]。最近,玉米2个与叶角控制有关的基因已经被鉴定[61],并通过基因编辑方法成功地优化玉米叶角,培育出类似“聪明冠层”的理想株型玉米,提高了玉米的群体光能利用效率、生物量和产量[62]。很期待这方面研究的深入并得到广泛应用。
改善光合机构捕光系统的光捕获及其向反应中心的传递,是提高光合效率和生物质产量的重要环节。如今在改变捕光天线大小或叶绿素含量、改变参与热耗散调节的蛋白和改变向光蛋白几个方面都取得了重要的研究进展。但是,在引入叶绿素d和叶绿素f及细菌叶绿素方面还没有见到通过扩展光合作用吸收光谱范围而成功改善光合效率和生物质产量的实验结果。在通过改善叶片着生角度而提高群体光合效率和作物产量方面,成功的范例已经不再限于多年育种选择的结果,通过基因工程优化叶片着生角度从而提高作物产量的重要成果令人鼓舞,展示出美好的应用前景。
| [1] |
Pascal AA, Liu ZF, Broess K, et al. Molecular basis of photoprotection and control of photosynthetic light-harvesting. Nature, 2005, 436: 134-7. DOI:10.1038/nature03795 |
| [2] |
Belgio E, Kapitonova E, Chmeliov J, et al. Economic photoprotection in photosystem Ⅱ that retains a complete light-harvesting system with slow energy traps. Nat Commun, 2014, 5: 4433. DOI:10.1038/ncomms5433 |
| [3] |
Rochaix JD. Regulation and dynamics of the light-harvesting system. Annu Rev Plant Biol, 2014, 65: 287-309. DOI:10.1146/annurev-arplant-050213-040226 |
| [4] |
Xu DQ, Chen Y, Chen GY. Light-harvesting regulation from leaf to molecule with the emphasis on rapid changes in antenna size. Photosyn Res, 2015, 124: 137-58. DOI:10.1007/s11120-015-0115-z |
| [5] |
许大全, 陈根云. 植物光合作用中的捕光调节. 植物生理学报, 2016, 52: 1649-61. |
| [6] |
Furbank RT, Quick WP, Sirault XRR. Improving photosynthesis and yield potential in cereal crops by targeted genetic manipulation: prospects, progress and challenges. Field Crop Res, 2015, 182: 19-29. DOI:10.1016/j.fcr.2015.04.009 |
| [7] |
Orr DJ, Pereira AM, da Fonseca Pereira P, et al. Engineering photosynthesis: progress and perspectives. F1000 Res, 2017, 6: 1891. DOI:10.12688/f1000research.12181.1 |
| [8] |
Guardini Z, Gomez RL, DallOsto L. Improving light harvesting[M]//Ruban A, Foyer CH, Murchie EH, eds. Photosynthesis in action. Elsevier Inc, 2022: 135-59
|
| [9] |
Kouřil R, Dekker JP, Boekema EJ. Supramolecular organization of photosystem Ⅱ in green plants. Biochim Biophys Acta, 2012, 1817: 2-12. DOI:10.1016/j.bbabio.2011.05.024 |
| [10] |
Lunde C, Jensen PE, Haldrup A, et al. The PSI-H subunit of photosystem Ⅰ is essential for state transitions in plant photosynthesis. Nature, 2000, 408: 613-5. DOI:10.1038/35046121 |
| [11] |
Chen Y, Xu DQ. Two patterns of leaf photosynthetic response to irradiance transition from saturating to limiting one in some plant species. New Phytol, 2005, 169: 789-98. |
| [12] |
McKim SM, Durnford DG. Translational regulation of light-harvesting complex expression during photoacclimation to high-light in Chlamydomonas reinhardtii. Plant Physiol Biochem, 2006, 44: 857-65. DOI:10.1016/j.plaphy.2006.10.018 |
| [13] |
Adir N. Structure of the phycobilisome antennae in cyanobecteria and red algae[M]//Fromme P. Photosynthetic protein complexes. Weinheim: WILEY-VCH Verlag GmbH & Co KGaA, 2008: 243-74
|
| [14] |
Kirilovsky D, Kerfeld CA. Cyanobacterial photoprotection by the orange carotenoid protein. Nat Plants, 2016, 2: 16180. DOI:10.1038/nplants.2016.180 |
| [15] |
Formighieri C, Franck F, Bassi R. Regulation of the pigment optical density of an algal cell: filling the gap between photosynthetic productivity in the laboratory and in mass culture. J Biotechnol, 2012, 162: 115-23. DOI:10.1016/j.jbiotec.2012.02.021 |
| [16] |
Melis A. Photosystem-Ⅱ damage and repair cycle in chloroplasts: what modulates the rate of photodamage in vivo?. Trends Plant Sci, 1999, 4: 130-5. DOI:10.1016/S1360-1385(99)01387-4 |
| [17] |
Polle JEW, Kanakagiri SD, Melis A. tla1, a DNA insertional transformant of the green alga Chlamydomonas reinhardtii with a truncated light-harvesting chlorophyll antenna size. Planta, 2003, 217: 49-59. DOI:10.1007/s00425-002-0968-1 |
| [18] |
Nakajima Y, Ueda R. Improvement of microalgal photosynthetic productivity by reducing the content of light harvesting pigment. J Appl Phycol, 1999, 11: 195-201. DOI:10.1023/A:1008015224029 |
| [19] |
Melis A. Solar energy conversion efficiencies in photosynthesis: minimizing the chlorophyll antennae to maximize efficiency. Plant Sci, 2009, 177: 272-80. DOI:10.1016/j.plantsci.2009.06.005 |
| [20] |
Kirst H, Garcia-Cerdan JG, Zurbriggen A, et al. Truncated photosystem chlorophyll antenna size in the green microalga Chlamydomonas reinhardtii upon deletion of the TLA3-CpSRP43 gene. Plant Physiol, 2012, 160: 2251-60. DOI:10.1104/pp.112.206672 |
| [21] |
Perin G, Bellan A, Segalla A, et al. Generation of random mutants to improve light-use efficiency of Nannochloropsis gaditana cultures for biofuel production. Biotechnol Biofuels, 2015, 8: 161. DOI:10.1186/s13068-015-0337-5 |
| [22] |
Perrine Z, Negi S, Sayre RT. Optimization of photosynthetic light energy utilization by microalgae. Algal Res, 2012, 1: 134-42. DOI:10.1016/j.algal.2012.07.002 |
| [23] |
Herrera-Estrella L, Oey M, Ross IL, et al. RNAi knock-down of LHCBM1, 2 and 3 increases photosynthetic H2 production efficiency of the green alga Chlamydomonas reinhardtii. PLoS One, 2013, 8: e61375. DOI:10.1371/journal.pone.0061375 |
| [24] |
Cazzaniga S, Dall'Osto L, Szaub J, et al. Domestication of the green alga Chlorella sorokiniana: reduction of antenna size improves light-use efficiency in a photobioreactor. Biotechnol Biofuels, 2014, 7: 157. DOI:10.1186/s13068-014-0157-z |
| [25] |
Ort DR, Zhu X, Melis A. Optimizing antenna size to maximize photosynthetic efficiency. Plant Physiol, 2011, 155: 79-85. DOI:10.1104/pp.110.165886 |
| [26] |
Kirst H, Gabilly ST, Niyogi KK, et al. Photosynthetic antenna engineering to improve crop yields. Planta, 2017, 245: 1009-20. DOI:10.1007/s00425-017-2659-y |
| [27] |
Jin H, Li M, Duan S, et al. Optimization of light-harvesting pigment improves photosynthetic efficiency. Plant Physiol, 2016, 172: 1720-31. DOI:10.1104/pp.16.00698 |
| [28] |
Gu J, Zhou Z, Li Z, et al. Rice (Oryza sativa L.) with reduced chlorophyll content exhibit higher photosynthetic rate and efficiency, improved canopy light distribution, and greater yields than normally pigmented plants. Field Crop Res, 2017, 200: 58-70. DOI:10.1016/j.fcr.2016.10.008 |
| [29] |
Sakowska K, Alberti G, Genesio L, et al. Leaf and canopy photosynthesis of a chlorophyll deficient soybean mutant. Plant Cell Environ, 2018, 41: 1427-37. DOI:10.1111/pce.13180 |
| [30] |
Friedland N, Negi S, Vinogradova-Shah T, et al. Fine-tuning the photosynthetic light harvesting apparatus for improved photosynthetic efficiency and biomass yield. Sci Rep, 2019, 9: 13028. DOI:10.1038/s41598-019-49545-8 |
| [31] |
Negi S, Perrine Z, Friedland N, et al. Light regulation of light-harvesting antenna size substantially enhances photosynthetic efficiency and biomass yield in green algae. Plant J, 2020, 103: 584-603. DOI:10.1111/tpj.14751 |
| [32] |
许大全. 新编光合作用学: 上海: 上海科学技术出版社, 2022: 220-30.
|
| [33] |
Demmig-Adams B, Garab G, Adams WⅢ, et al. Non-photochemical quenching and energy disipation in plants, algae and cyanobacteria: Dordrecht: Springer, 2014: 1-645.
|
| [34] |
Zhu XG, Ort DR, Whitmarsh J, et al. The slow reversibility of photosystem Ⅱ thermal energy dissipation on transfer from high to low light may cause large losses in carbon gain by crop canopies: a theoretical analysis. J Exp Bot, 2004, 55: 1167-75. DOI:10.1093/jxb/erh141 |
| [35] |
Kromdijk J, Glowacka K, Leonelli L, et al. Improving photosynthesis and crop productivity by accelerating recovery from photoprotection. Science, 2016, 354: 857-61. DOI:10.1126/science.aai8878 |
| [36] |
Glowacka K, Kromdijk J, Kucera K, et al. Photosystem Ⅱ subunit S overexpression increases the efficiency of water use in a field-grown crop. Nat Commun, 2018, 9: 868. DOI:10.1038/s41467-018-03231-x |
| [37] |
Peers G. Enhancement of biomass production by disruption of light energy dissipation pathways[P]. US 2012/178134 A1. 2012-07-12
|
| [38] |
Cantrell M, Peers G. A mutant of Chlamydomonas without LHCSR maintains high rates of photosynthesis, but has reduced cell division rates in sinusoidal light conditions. PLoS One, 2017, 12: e0179395. DOI:10.1371/journal.pone.0179395 |
| [39] |
Barera S, Dall'Osto L, Bassi R. Effect of lhcsr gene dosage on oxidative stress and light use efficiency by Chlamydomonas reinhardtii cultures. J Biotechnol, 2021, 328: 12-22. DOI:10.1016/j.jbiotec.2020.12.023 |
| [40] |
de Wit M, Keuskamp DH, Bongers FJ, et al. Integration of phytochrome and cryptochrome signals determines plant growth during competition for light. Curr Biol, 2016, 26: 3320-6. DOI:10.1016/j.cub.2016.10.031 |
| [41] |
Goh CH, Jang S, Jung S, et al. Rice phot1a mutation reduces plant growth by affecting photosynthetic responses to light during early seedling growth. Plant Mol Biol, 2008, 69: 605-19. |
| [42] |
Gotoh E, Suetsugu N, Yamori W, et al. Chloroplast accumulation response enhances leaf photosynthesis and plant biomass production. Plant Physiol, 2018, 178: 1358-69. DOI:10.1104/pp.18.00484 |
| [43] |
Dutta S, Cruz JA, Jiao Y, et al. Non-invasive, whole-plant imaging of chloroplast movement and chlorophyll fluorescence reveals photosynthetic phenotypes independent of chloroplast photorelocation defects in chloroplast division mutants. Plant J, 2015, 84: 428-42. DOI:10.1111/tpj.13009 |
| [44] |
Hart JE, Sullivan S, Hermanowicz P, et al. Engineering the phototropin photocycle improves photoreceptor performance and plant biomass production. Proc Natl Acad Sci USA, 2019, 116: 12550-7. DOI:10.1073/pnas.1902915116 |
| [45] |
Miyashita H, Ikemoto H, Kurano N, et al. Chlorophyll d as a major pigment. Nature, 1996, 383: 402-2. DOI:10.1038/383402a0 |
| [46] |
Chen M, Schliep M, Willows RD, et al. A red-shifted chlorophyll. Science, 2010, 329: 1318-9. DOI:10.1126/science.1191127 |
| [47] |
Chen M, Blankenship RE. Expanding the solar spectrum used by photosynthesis. Trends Plant Sci, 2011, 16: 427-31. DOI:10.1016/j.tplants.2011.03.011 |
| [48] |
Tsuchiya T, Mizoguchi T, Akimoto S, et al. Metabolic engineering of the Chl d-dominated cyanobacterium acaryochloris marina: production of a novel Chl species by the introduction of the chlorophyllide a oxygenase gene. Plant Cell Physiol, 2012, 53: 518-27. DOI:10.1093/pcp/pcs007 |
| [49] |
Nürnberg DJ, Morton J, Santabarbara S, et al. Photochemistry beyond the red limit in chlorophyll f-containing photosystems. Science, 2018, 360: 1210-3. DOI:10.1126/science.aar8313 |
| [50] |
Wolf BM, Blankenship RE. Far-red light acclimation in diverse oxygenic photosynthetic organisms. Photosyn Res, 2019, 142: 349-59. DOI:10.1007/s11120-019-00653-6 |
| [51] |
Shen G, Canniffe DP, Ho MY, et al. Characterization of chlorophyll f synthase heterologously produced in Synechococcus sp. PCC 7002. Photosyn Res, 2019, 140: 77-92. DOI:10.1007/s11120-018-00610-9 |
| [52] |
Blankenship RE, Tiede DM, Barber J, et al. Comparing photosynthetic and photovoltaic efficiencies and recognizing the potential for improvement. Science, 2011, 332: 805-9. DOI:10.1126/science.1200165 |
| [53] |
Duncan WG. Leaf angles, leaf area, and canopy photosynthesis. Crop Sci, 1971, 11: 482-5. DOI:10.2135/cropsci1971.0011183X001100040006x |
| [54] |
Mantilla-Perez MB, Salas Fernandez MG. Differential manipulation of leaf angle throughout the canopy: current status and prospects. J Exp Bot, 2017, 68: 5699-717. DOI:10.1093/jxb/erx378 |
| [55] |
Ort DR, Merchant SS, Alric J, et al. Redesigning photosynthesis to sustainably meet global food and bioenergy demand. Proc Natl Acad Sci USA, 2015, 112: 8529-36. DOI:10.1073/pnas.1424031112 |
| [56] |
Duvick DN, Cassman KG. Post-green revolution trends in yield potential of temperate maize in the north‐central United States. Crop Sci, 1999, 39: 1622-30. DOI:10.2135/cropsci1999.3961622x |
| [57] |
Wang T, Ma X, Li Y, et al. Changes in yield and yield components of single‐cross maize hybrids released in China between 1964 and 2001. Crop Sci, 2011, 51: 512-25. DOI:10.2135/cropsci2010.06.0383 |
| [58] |
Ma DL, Xie RZ, Niu XK, et al. Changes in the morphological traits of maize genotypes in China between the 1950s and 2000s. Eur J Agron, 2014, 58: 1-10. DOI:10.1016/j.eja.2014.04.001 |
| [59] |
Richards RA, Cavanagh CR, Riffkin P. Selection for erect canopy architecture can increase yield and biomass of spring wheat. Field Crops Res, 2019, 244: 107649. DOI:10.1016/j.fcr.2019.107649 |
| [60] |
Zhao SQ, Xiang JJ, Xue HW. Studies on the rice LEAF INCLINATION1 (LC1), an IAA–amido synthetase, reveal the effects of auxin in leaf inclination control. Mol Plant, 2013, 6: 174-87. DOI:10.1093/mp/sss064 |
| [61] |
Wang Q, Guo Q, Shi Q, et al. Histological and single-nucleus transcriptome analyses reveal the specialized functions of ligular sclerenchyma cells and key regulators of leaf angle in maize. Mol Plant, 2024, 17: 920-34. DOI:10.1016/j.molp.2024.05.001 |
| [62] |
Tian J, Wang C, Chen F, et al. Maize smart-canopy architecture enhances yield at high densities. Nature, 2024, 632: 576-84. DOI:10.1038/s41586-024-07669-6 |
 2024, Vol. 36
2024, Vol. 36 

 许大全,中国科学院上海植物生理生态研究所(现名分子植物科学卓越创新研究中心)研究员,博士研究生导师(2007年退休)。1981年研究生毕业后一直从事光合作用研究。1991年获国家教育委员会和国务院学位委员会授予的“做出突出贡献的中国博士硕士学位获得者”称号,享受国务院特殊津贴。发表中文、英文论文110多篇,出版专著《光合作用效率》《光合作用学》和《新编光合作用学》等。曾任《植物生理学报》主编、上海市植物生理学会理事长和上海交通大学兼职教授,《大辞海》《辞海》分科主编;
许大全,中国科学院上海植物生理生态研究所(现名分子植物科学卓越创新研究中心)研究员,博士研究生导师(2007年退休)。1981年研究生毕业后一直从事光合作用研究。1991年获国家教育委员会和国务院学位委员会授予的“做出突出贡献的中国博士硕士学位获得者”称号,享受国务院特殊津贴。发表中文、英文论文110多篇,出版专著《光合作用效率》《光合作用学》和《新编光合作用学》等。曾任《植物生理学报》主编、上海市植物生理学会理事长和上海交通大学兼职教授,《大辞海》《辞海》分科主编; 陈根云,中国科学院植物生理生态研究所/分子植物科学卓越创新中心研究员,博士生导师。1999年获博士学位,长期从事光合碳同化机理和田间作物光合效率等相关领域的研究。在J Exp Bot、Plant J、Mol Plant、Nat Biotech等刊物发表相关论文近100篇。作为课题组负责人或主要骨干,曾参与国家科技部“863”和“973”项目及国家自然科学基金委、中国科学院创新方向性项目等多个重点项目。曾任中国植物生理学会光合作用专业委员会委员,上海生物化学学会理事,上海生物物理学会光生物专业委员会副主任,上海生物工程学会一碳专业委员会委员等
陈根云,中国科学院植物生理生态研究所/分子植物科学卓越创新中心研究员,博士生导师。1999年获博士学位,长期从事光合碳同化机理和田间作物光合效率等相关领域的研究。在J Exp Bot、Plant J、Mol Plant、Nat Biotech等刊物发表相关论文近100篇。作为课题组负责人或主要骨干,曾参与国家科技部“863”和“973”项目及国家自然科学基金委、中国科学院创新方向性项目等多个重点项目。曾任中国植物生理学会光合作用专业委员会委员,上海生物化学学会理事,上海生物物理学会光生物专业委员会副主任,上海生物工程学会一碳专业委员会委员等